第七章 第三节 第2课时 乙酸 学案(含答案)
文档属性
| 名称 | 第七章 第三节 第2课时 乙酸 学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 540.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-31 23:00:35 | ||
图片预览


文档简介
第2课时 乙酸
[核心素养发展目标] 1.了解乙酸的物理性质和用途,培养科学态度与社会责任。2.掌握乙酸的组成、结构和化学性质,培养变化观念与平衡思想。3.掌握酯化反应的原理、实质和实验操作,能依据给出的问题,设计简单的实验方案,培养科学探究与创新意识。
一、乙酸的物理性质、结构及弱酸性
1.乙酸的物理性质
乙酸俗称________,是有强烈刺激性气味的无色液体,易溶于____________,当温度低于熔点(16.6 ℃)时,凝结成类似冰的晶体,所以纯净的乙酸又叫________。
2.乙酸的组成与结构
3.乙酸的酸性
乙酸是一元弱酸,其酸性比H2CO3______,具有酸的通性,滴入紫色石蕊溶液,溶液变________,写出下列反应的化学方程式。
(1)与Na反应:__________________________________________________________________;
(2)与NaOH反应:_______________________________________________________________;
(3)与Na2O反应:________________________________________________________________;
(4)与Na2CO3反应:______________________________________________________________;
(5)与NaHCO3反应:______________________________________________________________。
(1)在标准状况下醋酸是一种无色有强烈刺激性气味的液体( )
(2)乙酸中含有双键,因此属于不饱和烃( )
(3)乙酸分子中含有和—OH两种官能团( )
(4)乙酸分子中含有4个H原子,故为四元酸( )
(5)酸性高锰酸钾溶液、碳酸钠、紫色石蕊溶液均可鉴别乙醇和乙酸( )
1.某化学小组要证实乙酸的酸性强于碳酸的酸性,设计如图装置。
选择试剂:0.1 mol· L-1稀醋酸、碳酸钠粉末、醋酸钠、水。
试回答下列问题:
(1)A试剂为______________,B试剂为__________________。
(2)证明乙酸强于碳酸的实验现象:__________________________________________________
_______________________________________________________________________________。
(3)涉及反应的化学方程式为_______________________________________________________
_______________________________________________________________________________。
(4)下列物质:①C2H5OH ②CH3COOH ③H2O都能与Na反应放出H2,其产生H2速率由快到慢的顺序为________________(填序号)。
2.在家庭生活中,常用食醋(3%~5%的乙酸)清除水壶中少量的水垢(主要成分为碳酸钙),写出清除过程发生反应的化学方程式:________________________________________________。
乙酸能与活泼金属反应,写出乙酸和镁反应的离子方程式:_____________________________。
乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CH3COOH H—OH C2H5OH
与羟基直接相连的原子或原子团 —H C2H5—
遇石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与Na2CO3 反应 — 不反应 反应
羟基氢的活 泼性强弱 CH3COOH>H2CO3>H2O>C2H5OH
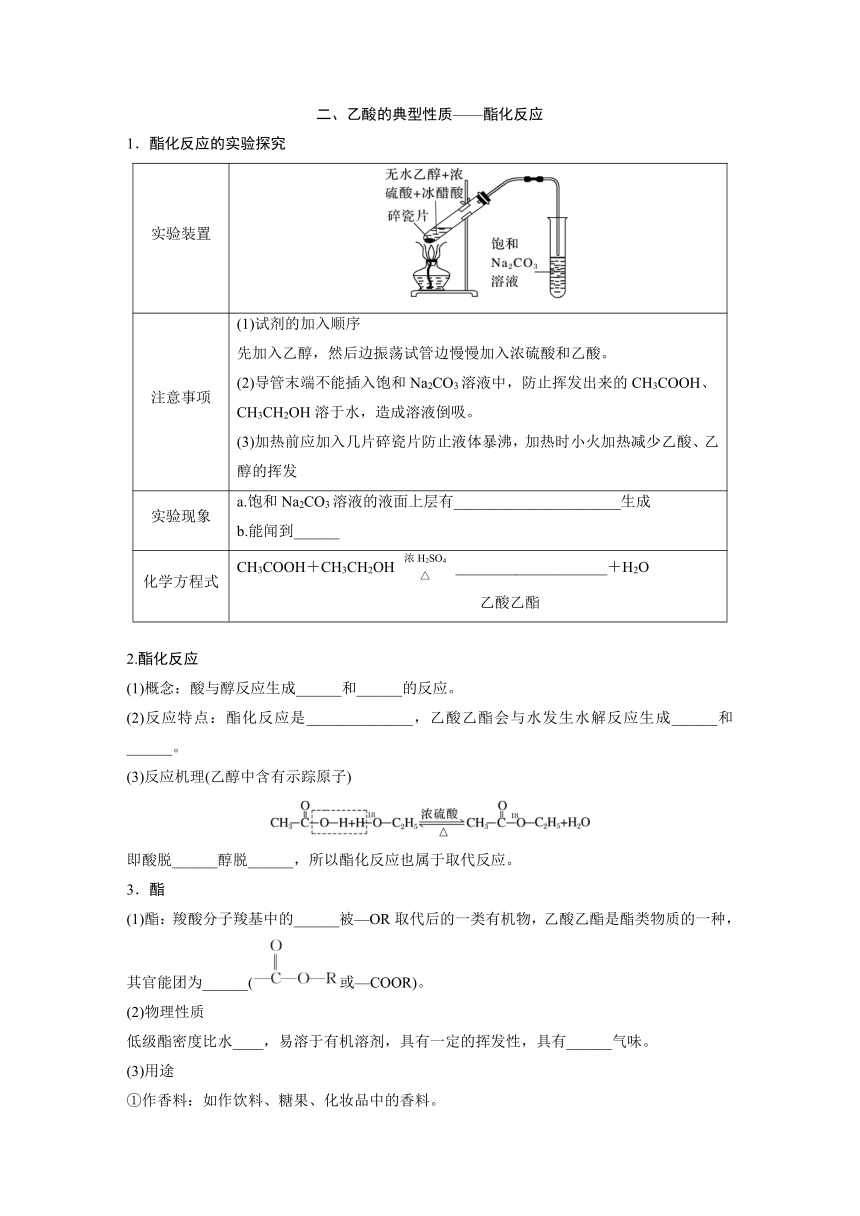
二、乙酸的典型性质——酯化反应
1.酯化反应的实验探究
实验装置
注意事项 (1)试剂的加入顺序 先加入乙醇,然后边振荡试管边慢慢加入浓硫酸和乙酸。 (2)导管末端不能插入饱和Na2CO3溶液中,防止挥发出来的CH3COOH、CH3CH2OH溶于水,造成溶液倒吸。 (3)加热前应加入几片碎瓷片防止液体暴沸,加热时小火加热减少乙酸、乙醇的挥发
实验现象 a.饱和Na2CO3溶液的液面上层有______________________生成 b.能闻到______
化学方程式 CH3COOH+CH3CH2OH____________________+H2O 乙酸乙酯
2.酯化反应
(1)概念:酸与醇反应生成______和______的反应。
(2)反应特点:酯化反应是______________,乙酸乙酯会与水发生水解反应生成______和______。
(3)反应机理(乙醇中含有示踪原子)
即酸脱______醇脱______,所以酯化反应也属于取代反应。
3.酯
(1)酯:羧酸分子羧基中的______被—OR取代后的一类有机物,乙酸乙酯是酯类物质的一种,其官能团为______(或—COOR)。
(2)物理性质
低级酯密度比水____,易溶于有机溶剂,具有一定的挥发性,具有______气味。
(3)用途
①作香料:如作饮料、糖果、化妆品中的香料。
②作有机溶剂。
(1)在酯化反应实验时,可以先加入浓硫酸,然后边振荡试管,边加入乙醇和乙酸( )
(2)在酯化反应中,只要乙醇过量,可以把乙酸完全反应生成乙酸乙酯( )
(3)酯化反应一定为取代反应( )
(4)乙酸乙酯是有特殊香味的、易溶于水的无色液体( )
(5)在酯化反应实验中,可用稀硫酸代替浓硫酸( )
某研究小组用如图所示装置制取乙酸乙酯,请回答下列问题:
(1)为防止试管a中液体实验时发生暴沸,加热前应采取的措施为________________。
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_________________________。
(3)试管b中饱和碳酸钠溶液的作用除了溶解乙醇,还有________________________________,_______________________________________________________________________________。
(4)待试管b收集到一定量产物后停止加热,撤去试管b并用力振荡试管b,静置后试管b中所观察到的实验现象:____________________________。
(5)如果用含示踪原子18O的乙醇参与反应,生成的产物中,只有乙酸乙酯中含有18O,则酯化反应中,乙酸和乙醇分子中断裂的各是什么键,在化学方程式中表示出其断键部位:_______
_______________________________________________________________________________。
酯化反应中的“一原理”“两作用”
1.一原理
在酯化反应中,有机羧酸断C—O,醇分子断O—H,即“酸脱羟基醇脱氢”,表示如下:
2.两作用
(1)浓硫酸的作用
①催化剂——加快反应速率。
②吸水剂——除去反应的副产物水,提高酯的产率。
(2)饱和Na2CO3溶液的作用
①降低乙酸乙酯的溶解度,便于分层,得到酯。
②与挥发出来的乙酸反应。
③溶解挥发出来的乙醇。
1.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
2.将CH3COOH和H18O—C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是( )
A.18O存在于所有物质里
B.18O仅存在于乙醇和乙酸乙酯里
C.18O仅存在于乙醇和水里
D.有的乙醇分子可能不含18O
3.(2022·豫西名校高一检测)乙酸分子的结构式为,已知:CH3COOH+Br2BrCH2COOH+HBr,下列反应及断键部位正确的是( )
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时,Br2与CH3COOH的反应是③键断裂
(4)乙酸在空气中燃烧是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4)
C.(2)(3)(4) D.(1)(3)(4)
4.(2022·天津高一检测)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、无水乙酸,D中盛有饱和碳酸钠溶液。
已知:无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
请回答下列问题:
(1)若实验中用乙酸和含18O的乙醇反应,写出该反应的化学方程式:______________________
_______________________________________________________________________________。
(2)球形干燥管C的作用是_________________________________________________________
_______________________________________________________________________________。
若反应前向D中加入几滴酚酞溶液,溶液呈红色,说明碳酸钠溶液显________性;反应结束后,D中的现象是________________________________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________。
第2课时 乙酸
一、
1.醋酸 水和乙醇 冰醋酸
2. CH3COOH C2H4O2 —COOH
3.强 红色 (1)2CH3COOH+2Na―→2CH3COONa+H2↑ (2)CH3COOH+NaOH―→CH3COONa+H2O (3)2CH3COOH+Na2O―→2CH3COONa+H2O (4)2CH3COOH+Na2CO3―→2CH3COONa+H2O+CO2↑ (5)CH3COOH+NaHCO3―→CH3COONa+CO2↑+H2O
正误判断
(1)× (2)× (3)× (4)× (5)√
深度思考
1.(1)0.1 mol·L-1稀醋酸 碳酸钠粉末 (2)当0.1 mol·L-1稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
(3)2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O、CO2+Ca(OH)2―→CaCO3↓+H2O (4)②>③>①
2.2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O
Mg+2CH3COOH―→Mg2++2CH3COO-+H2↑
二、
1.无色透明的油状液体 香味 CH3COOC2H5
2.(1)酯 水 (2)可逆反应 乙酸 乙醇 (3)羟基 氢
3.(1)羟基 酯基 (2)小 芳香
正误判断
(1)× (2)× (3)√ (4)× (5)×
深度思考
(1)加入碎瓷片(或沸石) (2)防止倒吸 (3)中和乙酸 降低乙酸乙酯的溶解度 (4)液体分层,上层为无色有香味的油状液体
(5)
随堂演练 知识落实
1.C 2.B
3.A [乙酸电离出H+时,断裂①键;发生酯化反应时酸脱羟基,断裂②键;在红磷存在时,乙酸与Br2反应,溴原子取代了甲基上的氢原子,断裂③键;乙酸在空气中燃烧生成CO2和H2O,分子结构中的所有键均断裂。]
4.(1)CH3COOH+C2HOH+H2O (2)冷凝蒸气,防止倒吸 碱 溶液分层,上层为无色油状液体,下层溶液红色变浅 (3)乙醇
解析 (1)在酯化反应中,羧酸提供羟基,醇提供氢原子,所以反应后乙醇中的18O在乙酸乙酯中。(2)球形干燥管容积大,可以防止倒吸,同时可冷凝乙酸乙酯蒸气。酚酞遇碱变红,故碳酸钠溶液呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,且其密度比水的小,故D中溶液分层,上层为无色油状液体,反应中挥发出来的乙酸和碳酸钠反应而使下层溶液红色变浅。(3)无水氯化钙能与乙醇形成难溶于水的物质,所以先加入无水氯化钙,分离出乙醇。
[核心素养发展目标] 1.了解乙酸的物理性质和用途,培养科学态度与社会责任。2.掌握乙酸的组成、结构和化学性质,培养变化观念与平衡思想。3.掌握酯化反应的原理、实质和实验操作,能依据给出的问题,设计简单的实验方案,培养科学探究与创新意识。
一、乙酸的物理性质、结构及弱酸性
1.乙酸的物理性质
乙酸俗称________,是有强烈刺激性气味的无色液体,易溶于____________,当温度低于熔点(16.6 ℃)时,凝结成类似冰的晶体,所以纯净的乙酸又叫________。
2.乙酸的组成与结构
3.乙酸的酸性
乙酸是一元弱酸,其酸性比H2CO3______,具有酸的通性,滴入紫色石蕊溶液,溶液变________,写出下列反应的化学方程式。
(1)与Na反应:__________________________________________________________________;
(2)与NaOH反应:_______________________________________________________________;
(3)与Na2O反应:________________________________________________________________;
(4)与Na2CO3反应:______________________________________________________________;
(5)与NaHCO3反应:______________________________________________________________。
(1)在标准状况下醋酸是一种无色有强烈刺激性气味的液体( )
(2)乙酸中含有双键,因此属于不饱和烃( )
(3)乙酸分子中含有和—OH两种官能团( )
(4)乙酸分子中含有4个H原子,故为四元酸( )
(5)酸性高锰酸钾溶液、碳酸钠、紫色石蕊溶液均可鉴别乙醇和乙酸( )
1.某化学小组要证实乙酸的酸性强于碳酸的酸性,设计如图装置。
选择试剂:0.1 mol· L-1稀醋酸、碳酸钠粉末、醋酸钠、水。
试回答下列问题:
(1)A试剂为______________,B试剂为__________________。
(2)证明乙酸强于碳酸的实验现象:__________________________________________________
_______________________________________________________________________________。
(3)涉及反应的化学方程式为_______________________________________________________
_______________________________________________________________________________。
(4)下列物质:①C2H5OH ②CH3COOH ③H2O都能与Na反应放出H2,其产生H2速率由快到慢的顺序为________________(填序号)。
2.在家庭生活中,常用食醋(3%~5%的乙酸)清除水壶中少量的水垢(主要成分为碳酸钙),写出清除过程发生反应的化学方程式:________________________________________________。
乙酸能与活泼金属反应,写出乙酸和镁反应的离子方程式:_____________________________。
乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CH3COOH H—OH C2H5OH
与羟基直接相连的原子或原子团 —H C2H5—
遇石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与Na2CO3 反应 — 不反应 反应
羟基氢的活 泼性强弱 CH3COOH>H2CO3>H2O>C2H5OH
二、乙酸的典型性质——酯化反应
1.酯化反应的实验探究
实验装置
注意事项 (1)试剂的加入顺序 先加入乙醇,然后边振荡试管边慢慢加入浓硫酸和乙酸。 (2)导管末端不能插入饱和Na2CO3溶液中,防止挥发出来的CH3COOH、CH3CH2OH溶于水,造成溶液倒吸。 (3)加热前应加入几片碎瓷片防止液体暴沸,加热时小火加热减少乙酸、乙醇的挥发
实验现象 a.饱和Na2CO3溶液的液面上层有______________________生成 b.能闻到______
化学方程式 CH3COOH+CH3CH2OH____________________+H2O 乙酸乙酯
2.酯化反应
(1)概念:酸与醇反应生成______和______的反应。
(2)反应特点:酯化反应是______________,乙酸乙酯会与水发生水解反应生成______和______。
(3)反应机理(乙醇中含有示踪原子)
即酸脱______醇脱______,所以酯化反应也属于取代反应。
3.酯
(1)酯:羧酸分子羧基中的______被—OR取代后的一类有机物,乙酸乙酯是酯类物质的一种,其官能团为______(或—COOR)。
(2)物理性质
低级酯密度比水____,易溶于有机溶剂,具有一定的挥发性,具有______气味。
(3)用途
①作香料:如作饮料、糖果、化妆品中的香料。
②作有机溶剂。
(1)在酯化反应实验时,可以先加入浓硫酸,然后边振荡试管,边加入乙醇和乙酸( )
(2)在酯化反应中,只要乙醇过量,可以把乙酸完全反应生成乙酸乙酯( )
(3)酯化反应一定为取代反应( )
(4)乙酸乙酯是有特殊香味的、易溶于水的无色液体( )
(5)在酯化反应实验中,可用稀硫酸代替浓硫酸( )
某研究小组用如图所示装置制取乙酸乙酯,请回答下列问题:
(1)为防止试管a中液体实验时发生暴沸,加热前应采取的措施为________________。
(2)装置中的球形干燥管除起冷凝作用外,它的另一重要作用是_________________________。
(3)试管b中饱和碳酸钠溶液的作用除了溶解乙醇,还有________________________________,_______________________________________________________________________________。
(4)待试管b收集到一定量产物后停止加热,撤去试管b并用力振荡试管b,静置后试管b中所观察到的实验现象:____________________________。
(5)如果用含示踪原子18O的乙醇参与反应,生成的产物中,只有乙酸乙酯中含有18O,则酯化反应中,乙酸和乙醇分子中断裂的各是什么键,在化学方程式中表示出其断键部位:_______
_______________________________________________________________________________。
酯化反应中的“一原理”“两作用”
1.一原理
在酯化反应中,有机羧酸断C—O,醇分子断O—H,即“酸脱羟基醇脱氢”,表示如下:
2.两作用
(1)浓硫酸的作用
①催化剂——加快反应速率。
②吸水剂——除去反应的副产物水,提高酯的产率。
(2)饱和Na2CO3溶液的作用
①降低乙酸乙酯的溶解度,便于分层,得到酯。
②与挥发出来的乙酸反应。
③溶解挥发出来的乙醇。
1.下列关于乙酸性质的叙述中,错误的是( )
A.乙酸的酸性比碳酸的强,所以它可以与碳酸盐溶液反应,产生CO2气体
B.乙酸具有酸性,所以能与钠反应放出H2
C.乙酸分子中含有碳氧双键,所以它能使溴水褪色
D.乙酸在温度低于16.6 ℃时,就凝结成冰状晶体
2.将CH3COOH和H18O—C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是( )
A.18O存在于所有物质里
B.18O仅存在于乙醇和乙酸乙酯里
C.18O仅存在于乙醇和水里
D.有的乙醇分子可能不含18O
3.(2022·豫西名校高一检测)乙酸分子的结构式为,已知:CH3COOH+Br2BrCH2COOH+HBr,下列反应及断键部位正确的是( )
(1)乙酸的电离,是①键断裂
(2)乙酸与乙醇发生酯化反应,是②键断裂
(3)在红磷存在时,Br2与CH3COOH的反应是③键断裂
(4)乙酸在空气中燃烧是①②键断裂
A.(1)(2)(3) B.(1)(2)(3)(4)
C.(2)(3)(4) D.(1)(3)(4)
4.(2022·天津高一检测)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、无水乙酸,D中盛有饱和碳酸钠溶液。
已知:无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
请回答下列问题:
(1)若实验中用乙酸和含18O的乙醇反应,写出该反应的化学方程式:______________________
_______________________________________________________________________________。
(2)球形干燥管C的作用是_________________________________________________________
_______________________________________________________________________________。
若反应前向D中加入几滴酚酞溶液,溶液呈红色,说明碳酸钠溶液显________性;反应结束后,D中的现象是________________________________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________。
第2课时 乙酸
一、
1.醋酸 水和乙醇 冰醋酸
2. CH3COOH C2H4O2 —COOH
3.强 红色 (1)2CH3COOH+2Na―→2CH3COONa+H2↑ (2)CH3COOH+NaOH―→CH3COONa+H2O (3)2CH3COOH+Na2O―→2CH3COONa+H2O (4)2CH3COOH+Na2CO3―→2CH3COONa+H2O+CO2↑ (5)CH3COOH+NaHCO3―→CH3COONa+CO2↑+H2O
正误判断
(1)× (2)× (3)× (4)× (5)√
深度思考
1.(1)0.1 mol·L-1稀醋酸 碳酸钠粉末 (2)当0.1 mol·L-1稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
(3)2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O、CO2+Ca(OH)2―→CaCO3↓+H2O (4)②>③>①
2.2CH3COOH+CaCO3―→(CH3COO)2Ca+CO2↑+H2O
Mg+2CH3COOH―→Mg2++2CH3COO-+H2↑
二、
1.无色透明的油状液体 香味 CH3COOC2H5
2.(1)酯 水 (2)可逆反应 乙酸 乙醇 (3)羟基 氢
3.(1)羟基 酯基 (2)小 芳香
正误判断
(1)× (2)× (3)√ (4)× (5)×
深度思考
(1)加入碎瓷片(或沸石) (2)防止倒吸 (3)中和乙酸 降低乙酸乙酯的溶解度 (4)液体分层,上层为无色有香味的油状液体
(5)
随堂演练 知识落实
1.C 2.B
3.A [乙酸电离出H+时,断裂①键;发生酯化反应时酸脱羟基,断裂②键;在红磷存在时,乙酸与Br2反应,溴原子取代了甲基上的氢原子,断裂③键;乙酸在空气中燃烧生成CO2和H2O,分子结构中的所有键均断裂。]
4.(1)CH3COOH+C2HOH+H2O (2)冷凝蒸气,防止倒吸 碱 溶液分层,上层为无色油状液体,下层溶液红色变浅 (3)乙醇
解析 (1)在酯化反应中,羧酸提供羟基,醇提供氢原子,所以反应后乙醇中的18O在乙酸乙酯中。(2)球形干燥管容积大,可以防止倒吸,同时可冷凝乙酸乙酯蒸气。酚酞遇碱变红,故碳酸钠溶液呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,且其密度比水的小,故D中溶液分层,上层为无色油状液体,反应中挥发出来的乙酸和碳酸钠反应而使下层溶液红色变浅。(3)无水氯化钙能与乙醇形成难溶于水的物质,所以先加入无水氯化钙,分离出乙醇。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
