化学人教版(2019)必修第一册2.3《物质的量》 (共64张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3《物质的量》 (共64张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 00:00:00 | ||
图片预览











文档简介
(共64张PPT)
第三节
物质的量
新人教版必修第一册
第二章 海水中的重要元素——钠和氯
物质的量
第1课时
活动1 回顾常见的计量方式,寻找规律
问题1 水是重要的物质,如何计量?
3.34×1028个水分子
3.34×1025个水分子
3.34×1025个水分子(按1 g/mL计算)
3.34×1022个水分子(按1 g/mL计算)
1 t水
1 L水
1 kg水
1 mL水
1971年,在第14届国际计量大会上,正式宣布了“物质的量”是国际单位制中的一个基本物理量,其单位为摩尔。
任务一 认识计量微观粒子的物理量
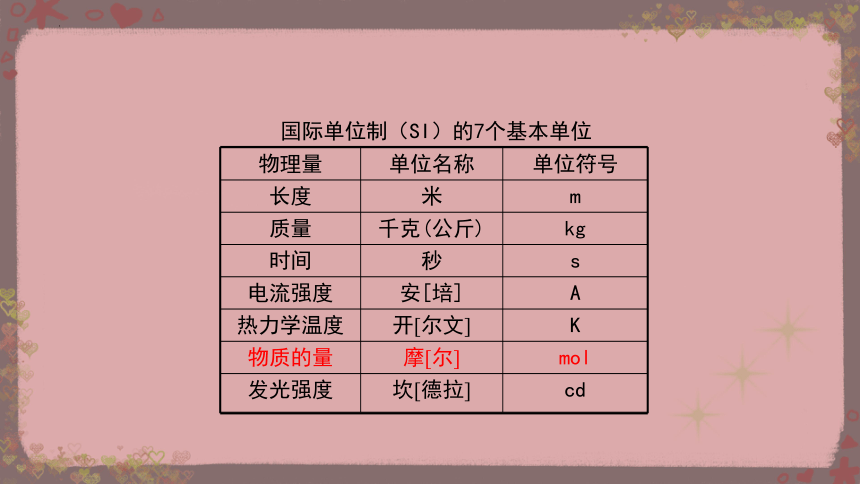
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 s
电流强度 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
一、物质的量的单位——摩尔
物质的量
——表示含有一定数目粒子的集合体
符号: n
单位: 摩尔 (mol),简称摩
1 mol粒子
多少个?
1盒签字笔 12支
1包白纸 500张
1盒曲别针 100个
……
一、物质的量的单位——摩尔
1. 国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023。1 mol任何粒子的粒子数叫做阿伏加德罗常数,符号为NA,通常用6.02×1023 mol-1表示。
一、物质的量的单位——摩尔
意大利物理学家、化学家,1776年生于意大利都灵市。
阿伏加德罗
作为物质的量的单位,摩尔可以计量原子、分子、离子、原子团、电子、质子、中子等微观粒子。
如1 mol Fe、1 mol O2、1 mol Na+、1 mol SO 等
2
4
3
4. 1.204×1024个NO 相当于 mol NO 。
3
1. 1 mol H2O中约含有 个水分子;
2. 0.5 mol NaOH中约含有 个Na+;
6.02×1023
3.01×1023
知识巩固
3. 6.02×1023个H2相当于 mol H2 ;
1
2
任务二 建立以物质的量为中心的计量体系
物质的量
n (mol)
粒子数
N(个)
2.物质的量与粒子数之间的关系:
一、物质的量的单位——摩尔
n =
NA
N
× NA (mol-1)
÷ NA (mol-1)
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
粒子数之比 = 物质的量之比
=
N2
N1
n2
n1
知识迁移
问题2 分享“1 mol H2O”的含义
同学A: 水分子的物质的量为1 mol;
同学B: 1 mol H2O所含的分子数约为6.02×1023个;
同学C: 1 mol H2O中所含的氢原子数约为1.204×1024个;
同学D: 1 mol H2O中所含的氧原子数约为6.02×1023个;
同学E: 1 mol H2O中含有2 mol氢原子,1 mol氧原子
……
1 mol H2O
2 mol氢原子和1 mol氧原子
1 mol水分子
6.02×1023个水分子
1 mol水中
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
质量?
①1个水分子的质量
②总结规律
③数学推导
问题2 分享“1 mol H2O”的含义
物质的量为1 mol的几种物质
教材第51页 图2-21
序号 物质 相对原子(分子)质量 质量 物质的量
1 Fe 56 g 1 mol
2 Cu 64 g 1 mol
3 Al 27 g 1 mol
4 Zn 65 g 1 mol
5 S 32 g 1 mol
6 NaCl 58.5 g 1 mol
7 H2O 18 g 1 mol
8 蔗糖 342 g 1 mol
56
活动2 阅读教材,总结规律
64
27
65
32
58.5
18
342
M =
m
n
3. 摩尔质量
——单位物质的量的物质所具有的质量
单位: g/mol 或 g·mol-1
符号: M
一、物质的量的单位——摩尔
表达式:
摩尔质量数值 = 相对原子(分子)质量
摩尔质量 相对分子质量
H2O 18
H2SO4 98
NaOH 40
18 g/mol
98 g/mol
40 g/mol
知识巩固
4. 物质的量与质量之间的关系:
物质的量
n(mol)
质量
m(g)
(g/mol)
一、物质的量的单位——摩尔
n =
M
m
×M
÷M
(g/mol)
1 mol H2O
6.02×1023个水分子
1.204×1024个氢原子
6.02×1023个氧原子
2 mol氢原子和1 mol氧原子
1 mol水分子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
问题3 计算1 mol H2O的质量
问题3 计算1 mol H2O的质量
微观
宏观
物质的量(n)
质量(m)
粒子数(N)
1 mol H2O
6.02×1023个水分子
1.204×1024个氢原子
6.02×1023个氧原子
2 mol氢原子和1 mol氧原子
1 mol水分子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
6.02×1023个水分子
2 mol氢原子和1 mol氧原子
1 mol H2O
1 mol水分子
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
计算H2O的质量
1 mol水分子
6.02×1023个水分子
2 mol氢原子和1 mol氧原子
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
1 mol H2O
÷18 g/mol
计算H2O中的粒子数
1 mol H2O
1 mol氧原子
6.02 ×1023个氧原子
16 g O2
×32 g/mol
问题4 与1 mol H2O含有相同氧原子数的O2的质量
0.5 mol O2
相同氧原子数
任务三 多水平定量认识物质
27 g Al
学以致用
称质量
1 mol Al
约6.02×1023个铝原子
物质的量
宏观
微观
质量
( m )
物质的量
( n )
粒子数
( N )
×摩尔质量(M)
÷摩尔质量(M)
质量、物质的量与粒子数之间的关系:
课堂小结
÷阿伏加德罗常数(NA)
×阿伏加德罗常数(NA)
n =
NA
N
=
M
m
物质的量
宏观
微观
课后思考
在科学研究或实际生产中,涉及气态物质时,测量体积往往比称量质量更方便。那么气体体积与物质的量之间又有什么关系呢?
物质的量
第2课时
任务一 复习“物质的量”及相关概念
物质的量、物质的质量与粒子数之间的关系
质量(m)
物质的量(n)
粒子数(N)
×摩尔质量(M)
÷摩尔质量(M)
×阿伏加德罗常数(NA)
÷阿伏加德罗常数(NA)
请思考以下问题:
怎样能从试剂瓶中取出约6.02×1023个Zn原子呢
怎样能从试剂瓶中取出约6.02×1023个乙醇分子(C2H6O)呢
怎样能从储气瓶中取出约6.02×1023个氢气分子呢
m =6.02×1023/NA×(65 g·mol-1)=65 g
m =46 g
请思考以下问题:
怎样能从试剂瓶中取出约6.02×1023个Zn原子呢
怎样能从试剂瓶中取出约6.02×1023个乙醇分子(C2H6O)呢
乙醇密度:0.79 g·cm-3 (25 ℃)
怎样能从储气瓶中取出约6.02×1023个氢气分子呢
m =6.02×1023/NA×(65 g·mol-1)=65 g
m =46 g
V =46 g/(0.79 g·cm-3)=58.2 cm3
m =2 g
实际生活中气体常见的计量方式
实际生活中气体常见的计量方式
物质的量与气体体积之间有什么关系?
任务二 研究气体体积与粒子数的关系
活动1 请思考并回答以下关于氢气体积与其分子数的问题 (0 ℃、101 kPa)
22.4 L氢气含 个H2分子
44.8 L氢气含 个H2分子
你需要什么数据?
物质 每个H2分子体积/L 体积/L H2分子数/个
H2 1.18×10-30 22.4
44.8
1.90×1031
3.80×1031
×
思路一:
气体总体积
H2分子数
÷每个H2分子的体积
物质 密 度 (g·L-1) 体积 L 质量 g 摩尔质量 (g·mol-1) 物质的量 mol 分子数
个
H2 0.089 22.4
44.8
思路二:
体积
质量
粒子数
×密度
×阿伏加德罗常数
÷摩尔质量
物质的量
(0 ℃ 101 kPa)
物质 密 度 (g·L-1) 体积 L 质量 g 摩尔质量 (g·mol-1) 物质的量 mol 分子数
个
H2 0.089 22.4
44.8
思路二:
体积
质量
粒子数
×密度
×阿伏加德罗常数
÷摩尔质量
物质的量
6.02×1023
1.204×1024
1.994
3.987
2
2
2
1
(0 ℃ 101 kPa)
请思考:为什么不能用一个氢气分子体积来计算
气体分子本身大小与气体分子间的距离相比可以忽略不计
氢气分子个数呢?
物质 密 度 (g·L-1) 质量 g 摩尔质量 (g·mol-1) 分子数 个 物质的量 mol 体积
L
O2 1.429 1
CO2 1.965 1
N2 1.250 1
活动2 请思考并回答以下1 mol不同种气体的体积(0 ℃ 、101 kPa)
32
44
28
32
44
28
6.02×1023
6.02×1023
6.02×1023
22.4
22.4
22.4
活动3 请观察1 mol物质在0 ℃、101 kPa下的数据,结合物质状态,你能得出什么结论
物质 状态 密度 体积
Fe 固体 7.8 g/mL 7.2 mL
Al 固体 2.7 g/mL 10 mL
H2O 液体 1 g/mL 18 mL
H2SO4 液体 1.83 g/mL 53.6 mL
H2 气体 0.089 g/mL 22.4 L
O2 气体 1.43 g/mL 22.4 L
分组对比,总结规律
固体、液体、气体物质的微观特点示意图
固体
液体
气体
固体、液体物质粒子间间隔很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。
18.0 mL(0 ℃)
100 ℃ 1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
1 mol水
固体、液体的体积
物质的
体积
气体的
体积
粒子
的大小
粒子
的数目
粒子间
的距离
决定于
物质体积的影响因素
气体摩尔体积:
概念:单位物质的量的气体所占的体积。
符号:Vm
公式:
Vm =
V
n
常用单位有L/mol(L·mol-1)或m3/mol。
气体摩尔体积(Vm)的数值是否固定不变呢?
温度、压强
物质 气体摩尔体积 /(L·mol-1) 0 ℃ 101 kPa 25 ℃ 101 kPa 0 ℃
202 kPa
H2 22.4 24.5 11.2
O2 22.4 24.5 11.2
CO2 22.4 24.5 11.2
不同温度、压强下的气体摩尔体积
温度升高:气体分子间的平均距离增大,Vm增大
压强增大:气体分子间的平均距离减小,Vm减小
结论:
当温度和压强一定时,粒子数目相同的任何气体都具有相同的体积。
标准状况时(0 ℃,101 kPa),1 mol的任何气体的体积均约为22.4 L。
条件:标准状况
( 0 ℃,101 kPa )
对象:任何气体
物质的量:1 mol
体积约占
22.4 L
22.4 L
(标准状况)
6.02×1023分子
0.282 m
标准状况下的气体摩尔体积示意图
标准状况下气体摩尔体积
气体摩尔体积的一个特例
任务三 建立物质的量与粒子数目、气体体积(标准状况下)之间的相互关系
活动1 请判断正误,并进行解释说明
(1)标准状况下,1 mol任何物质的体积都约为
22.4 L。
(2) 1 mol气体的体积约为22.4 L。
错误,物质应是气体
错误,未指明条件——标准状况
(4)22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
错误,未指明气体体积是否在相同温度和压强下测定
(3)标准状况下,1 mol的O2和N2混合气(任意比),其体积约为22.4 L。
正确,气体体积与分子种类无关
(5)任何条件下,气体摩尔体积都是22.4 L。
错误,未指明温度和压强;气体摩尔体积的单位是L/mol
活动2 请计算并回答以下问题(标准状况下)。
(1)33.6 L H2的物质的量是多少
V =n×Vm=0.5 mol×22.4 L·mol-1=11.2 L
(2)16 g O2的体积是多少?
n =V/Vm=33.6 L/(22.4 L·mol-1)=1.5 mol
n =m/M =16 g/(32 g·mol-1)=0.5 mol
(3)44.8 L N2中含有的N2分子数是多少?
n =V/Vm=44.8 L/22.4 (L·mol-1) =2 mol
N =n×NA=2 mol×6.02×1023 mol-1=1.204×1024
活动2 请计算并回答以下问题(标准状况下)。
×M
× NA
×Vm
标准状况\气体
1 mol
44 g
6.02×1023
22.4 L
活动3 从质量、标准状况下的体积、分子数等方面描述1 mol CO2,思考宏观物质与微观粒子之间是如何建立联系的?
×M
× NA
×Vm
标准状况\气体
1 mol
44 g
6.02×1023
22.4 L
活动3 从质量、标准状况下的体积、分子数等方面描述1 mol CO2,思考宏观物质与微观粒子之间是如何建立联系的?
气体的摩尔体积
小结
气体摩尔体积:
Vm =
V
n
概念:单位物质的量的气体所占的体积。
常用单位:L/mol(L·mol-1)或m3/mol。
小结
标准状况下气体摩尔体积
小结
条件:标准状况
( 0 ℃,101 kPa )
对象:任何气体
(单一气体或混合气体)
物质的量:1 mol
体积约占22.4 L
小结
×M
× NA
×Vm
(气体/液体/固体)
(气体/液体/固体)
(气体/液体/固体)
(气体)
谢谢观看!
第三节
物质的量
新人教版必修第一册
第二章 海水中的重要元素——钠和氯
物质的量
第1课时
活动1 回顾常见的计量方式,寻找规律
问题1 水是重要的物质,如何计量?
3.34×1028个水分子
3.34×1025个水分子
3.34×1025个水分子(按1 g/mL计算)
3.34×1022个水分子(按1 g/mL计算)
1 t水
1 L水
1 kg水
1 mL水
1971年,在第14届国际计量大会上,正式宣布了“物质的量”是国际单位制中的一个基本物理量,其单位为摩尔。
任务一 认识计量微观粒子的物理量
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 s
电流强度 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
一、物质的量的单位——摩尔
物质的量
——表示含有一定数目粒子的集合体
符号: n
单位: 摩尔 (mol),简称摩
1 mol粒子
多少个?
1盒签字笔 12支
1包白纸 500张
1盒曲别针 100个
……
一、物质的量的单位——摩尔
1. 国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023。1 mol任何粒子的粒子数叫做阿伏加德罗常数,符号为NA,通常用6.02×1023 mol-1表示。
一、物质的量的单位——摩尔
意大利物理学家、化学家,1776年生于意大利都灵市。
阿伏加德罗
作为物质的量的单位,摩尔可以计量原子、分子、离子、原子团、电子、质子、中子等微观粒子。
如1 mol Fe、1 mol O2、1 mol Na+、1 mol SO 等
2
4
3
4. 1.204×1024个NO 相当于 mol NO 。
3
1. 1 mol H2O中约含有 个水分子;
2. 0.5 mol NaOH中约含有 个Na+;
6.02×1023
3.01×1023
知识巩固
3. 6.02×1023个H2相当于 mol H2 ;
1
2
任务二 建立以物质的量为中心的计量体系
物质的量
n (mol)
粒子数
N(个)
2.物质的量与粒子数之间的关系:
一、物质的量的单位——摩尔
n =
NA
N
× NA (mol-1)
÷ NA (mol-1)
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
粒子数之比 = 物质的量之比
=
N2
N1
n2
n1
知识迁移
问题2 分享“1 mol H2O”的含义
同学A: 水分子的物质的量为1 mol;
同学B: 1 mol H2O所含的分子数约为6.02×1023个;
同学C: 1 mol H2O中所含的氢原子数约为1.204×1024个;
同学D: 1 mol H2O中所含的氧原子数约为6.02×1023个;
同学E: 1 mol H2O中含有2 mol氢原子,1 mol氧原子
……
1 mol H2O
2 mol氢原子和1 mol氧原子
1 mol水分子
6.02×1023个水分子
1 mol水中
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
质量?
①1个水分子的质量
②总结规律
③数学推导
问题2 分享“1 mol H2O”的含义
物质的量为1 mol的几种物质
教材第51页 图2-21
序号 物质 相对原子(分子)质量 质量 物质的量
1 Fe 56 g 1 mol
2 Cu 64 g 1 mol
3 Al 27 g 1 mol
4 Zn 65 g 1 mol
5 S 32 g 1 mol
6 NaCl 58.5 g 1 mol
7 H2O 18 g 1 mol
8 蔗糖 342 g 1 mol
56
活动2 阅读教材,总结规律
64
27
65
32
58.5
18
342
M =
m
n
3. 摩尔质量
——单位物质的量的物质所具有的质量
单位: g/mol 或 g·mol-1
符号: M
一、物质的量的单位——摩尔
表达式:
摩尔质量数值 = 相对原子(分子)质量
摩尔质量 相对分子质量
H2O 18
H2SO4 98
NaOH 40
18 g/mol
98 g/mol
40 g/mol
知识巩固
4. 物质的量与质量之间的关系:
物质的量
n(mol)
质量
m(g)
(g/mol)
一、物质的量的单位——摩尔
n =
M
m
×M
÷M
(g/mol)
1 mol H2O
6.02×1023个水分子
1.204×1024个氢原子
6.02×1023个氧原子
2 mol氢原子和1 mol氧原子
1 mol水分子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
问题3 计算1 mol H2O的质量
问题3 计算1 mol H2O的质量
微观
宏观
物质的量(n)
质量(m)
粒子数(N)
1 mol H2O
6.02×1023个水分子
1.204×1024个氢原子
6.02×1023个氧原子
2 mol氢原子和1 mol氧原子
1 mol水分子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
6.02×1023个水分子
2 mol氢原子和1 mol氧原子
1 mol H2O
1 mol水分子
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
计算H2O的质量
1 mol水分子
6.02×1023个水分子
2 mol氢原子和1 mol氧原子
1.204×1024个氢原子
6.02×1023个氧原子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
1 mol H2O
÷18 g/mol
计算H2O中的粒子数
1 mol H2O
1 mol氧原子
6.02 ×1023个氧原子
16 g O2
×32 g/mol
问题4 与1 mol H2O含有相同氧原子数的O2的质量
0.5 mol O2
相同氧原子数
任务三 多水平定量认识物质
27 g Al
学以致用
称质量
1 mol Al
约6.02×1023个铝原子
物质的量
宏观
微观
质量
( m )
物质的量
( n )
粒子数
( N )
×摩尔质量(M)
÷摩尔质量(M)
质量、物质的量与粒子数之间的关系:
课堂小结
÷阿伏加德罗常数(NA)
×阿伏加德罗常数(NA)
n =
NA
N
=
M
m
物质的量
宏观
微观
课后思考
在科学研究或实际生产中,涉及气态物质时,测量体积往往比称量质量更方便。那么气体体积与物质的量之间又有什么关系呢?
物质的量
第2课时
任务一 复习“物质的量”及相关概念
物质的量、物质的质量与粒子数之间的关系
质量(m)
物质的量(n)
粒子数(N)
×摩尔质量(M)
÷摩尔质量(M)
×阿伏加德罗常数(NA)
÷阿伏加德罗常数(NA)
请思考以下问题:
怎样能从试剂瓶中取出约6.02×1023个Zn原子呢
怎样能从试剂瓶中取出约6.02×1023个乙醇分子(C2H6O)呢
怎样能从储气瓶中取出约6.02×1023个氢气分子呢
m =6.02×1023/NA×(65 g·mol-1)=65 g
m =46 g
请思考以下问题:
怎样能从试剂瓶中取出约6.02×1023个Zn原子呢
怎样能从试剂瓶中取出约6.02×1023个乙醇分子(C2H6O)呢
乙醇密度:0.79 g·cm-3 (25 ℃)
怎样能从储气瓶中取出约6.02×1023个氢气分子呢
m =6.02×1023/NA×(65 g·mol-1)=65 g
m =46 g
V =46 g/(0.79 g·cm-3)=58.2 cm3
m =2 g
实际生活中气体常见的计量方式
实际生活中气体常见的计量方式
物质的量与气体体积之间有什么关系?
任务二 研究气体体积与粒子数的关系
活动1 请思考并回答以下关于氢气体积与其分子数的问题 (0 ℃、101 kPa)
22.4 L氢气含 个H2分子
44.8 L氢气含 个H2分子
你需要什么数据?
物质 每个H2分子体积/L 体积/L H2分子数/个
H2 1.18×10-30 22.4
44.8
1.90×1031
3.80×1031
×
思路一:
气体总体积
H2分子数
÷每个H2分子的体积
物质 密 度 (g·L-1) 体积 L 质量 g 摩尔质量 (g·mol-1) 物质的量 mol 分子数
个
H2 0.089 22.4
44.8
思路二:
体积
质量
粒子数
×密度
×阿伏加德罗常数
÷摩尔质量
物质的量
(0 ℃ 101 kPa)
物质 密 度 (g·L-1) 体积 L 质量 g 摩尔质量 (g·mol-1) 物质的量 mol 分子数
个
H2 0.089 22.4
44.8
思路二:
体积
质量
粒子数
×密度
×阿伏加德罗常数
÷摩尔质量
物质的量
6.02×1023
1.204×1024
1.994
3.987
2
2
2
1
(0 ℃ 101 kPa)
请思考:为什么不能用一个氢气分子体积来计算
气体分子本身大小与气体分子间的距离相比可以忽略不计
氢气分子个数呢?
物质 密 度 (g·L-1) 质量 g 摩尔质量 (g·mol-1) 分子数 个 物质的量 mol 体积
L
O2 1.429 1
CO2 1.965 1
N2 1.250 1
活动2 请思考并回答以下1 mol不同种气体的体积(0 ℃ 、101 kPa)
32
44
28
32
44
28
6.02×1023
6.02×1023
6.02×1023
22.4
22.4
22.4
活动3 请观察1 mol物质在0 ℃、101 kPa下的数据,结合物质状态,你能得出什么结论
物质 状态 密度 体积
Fe 固体 7.8 g/mL 7.2 mL
Al 固体 2.7 g/mL 10 mL
H2O 液体 1 g/mL 18 mL
H2SO4 液体 1.83 g/mL 53.6 mL
H2 气体 0.089 g/mL 22.4 L
O2 气体 1.43 g/mL 22.4 L
分组对比,总结规律
固体、液体、气体物质的微观特点示意图
固体
液体
气体
固体、液体物质粒子间间隔很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。
18.0 mL(0 ℃)
100 ℃ 1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
1 mol水
固体、液体的体积
物质的
体积
气体的
体积
粒子
的大小
粒子
的数目
粒子间
的距离
决定于
物质体积的影响因素
气体摩尔体积:
概念:单位物质的量的气体所占的体积。
符号:Vm
公式:
Vm =
V
n
常用单位有L/mol(L·mol-1)或m3/mol。
气体摩尔体积(Vm)的数值是否固定不变呢?
温度、压强
物质 气体摩尔体积 /(L·mol-1) 0 ℃ 101 kPa 25 ℃ 101 kPa 0 ℃
202 kPa
H2 22.4 24.5 11.2
O2 22.4 24.5 11.2
CO2 22.4 24.5 11.2
不同温度、压强下的气体摩尔体积
温度升高:气体分子间的平均距离增大,Vm增大
压强增大:气体分子间的平均距离减小,Vm减小
结论:
当温度和压强一定时,粒子数目相同的任何气体都具有相同的体积。
标准状况时(0 ℃,101 kPa),1 mol的任何气体的体积均约为22.4 L。
条件:标准状况
( 0 ℃,101 kPa )
对象:任何气体
物质的量:1 mol
体积约占
22.4 L
22.4 L
(标准状况)
6.02×1023分子
0.282 m
标准状况下的气体摩尔体积示意图
标准状况下气体摩尔体积
气体摩尔体积的一个特例
任务三 建立物质的量与粒子数目、气体体积(标准状况下)之间的相互关系
活动1 请判断正误,并进行解释说明
(1)标准状况下,1 mol任何物质的体积都约为
22.4 L。
(2) 1 mol气体的体积约为22.4 L。
错误,物质应是气体
错误,未指明条件——标准状况
(4)22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
错误,未指明气体体积是否在相同温度和压强下测定
(3)标准状况下,1 mol的O2和N2混合气(任意比),其体积约为22.4 L。
正确,气体体积与分子种类无关
(5)任何条件下,气体摩尔体积都是22.4 L。
错误,未指明温度和压强;气体摩尔体积的单位是L/mol
活动2 请计算并回答以下问题(标准状况下)。
(1)33.6 L H2的物质的量是多少
V =n×Vm=0.5 mol×22.4 L·mol-1=11.2 L
(2)16 g O2的体积是多少?
n =V/Vm=33.6 L/(22.4 L·mol-1)=1.5 mol
n =m/M =16 g/(32 g·mol-1)=0.5 mol
(3)44.8 L N2中含有的N2分子数是多少?
n =V/Vm=44.8 L/22.4 (L·mol-1) =2 mol
N =n×NA=2 mol×6.02×1023 mol-1=1.204×1024
活动2 请计算并回答以下问题(标准状况下)。
×M
× NA
×Vm
标准状况\气体
1 mol
44 g
6.02×1023
22.4 L
活动3 从质量、标准状况下的体积、分子数等方面描述1 mol CO2,思考宏观物质与微观粒子之间是如何建立联系的?
×M
× NA
×Vm
标准状况\气体
1 mol
44 g
6.02×1023
22.4 L
活动3 从质量、标准状况下的体积、分子数等方面描述1 mol CO2,思考宏观物质与微观粒子之间是如何建立联系的?
气体的摩尔体积
小结
气体摩尔体积:
Vm =
V
n
概念:单位物质的量的气体所占的体积。
常用单位:L/mol(L·mol-1)或m3/mol。
小结
标准状况下气体摩尔体积
小结
条件:标准状况
( 0 ℃,101 kPa )
对象:任何气体
(单一气体或混合气体)
物质的量:1 mol
体积约占22.4 L
小结
×M
× NA
×Vm
(气体/液体/固体)
(气体/液体/固体)
(气体/液体/固体)
(气体)
谢谢观看!
