8.4盐的化学性质-2022-2023学年九年级化学下册(课件27页)(科粤版2012)
文档属性
| 名称 | 8.4盐的化学性质-2022-2023学年九年级化学下册(课件27页)(科粤版2012) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 00:00:00 | ||
图片预览







文档简介
(共27张PPT)
第八章 常见的酸碱盐
——盐的化学性质
8.4 常见的盐
CONTENTS
1
进一步理解酸碱盐的基本概念
2
掌握盐的化学性质
3
初步学会判断复分解反应的发生
盐是什么?
What is salt
日常生活中所说的盐,通常指食盐(NaCl)
金属离子
酸根离子
化学中的盐是指含有金属离子(或铵根离子)和酸根离子的一类化合物。如碳酸钠、碳酸氢钠、碳酸钙、硫酸铜等都属于盐
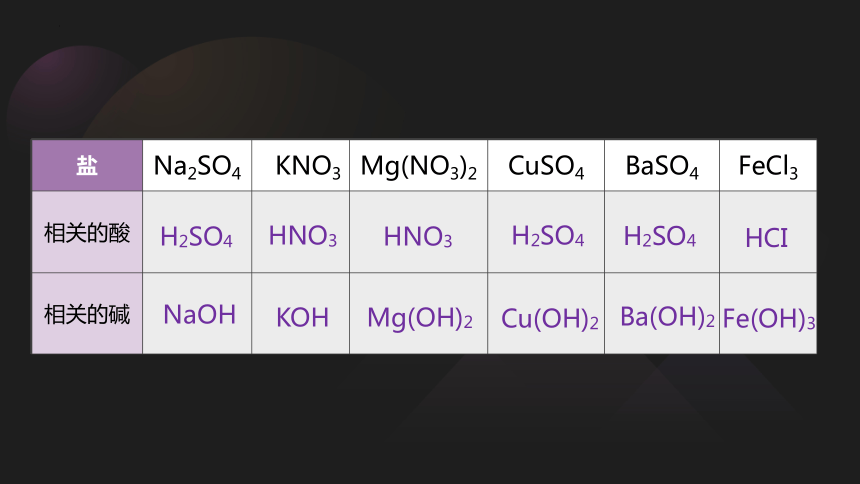
盐 Na2SO4 KNO3 Mg(NO3)2 CuSO4 BaSO4 FeCl3
相关的酸
相关的碱
NaOH
H2SO4
H2SO4
KOH
HNO3
HNO3
Mg(OH)2
Cu(OH)2
H2SO4
HCI
Ba(OH)2
Fe(OH)3
盐的化学性质
ONE
01
一、盐的化学性质
(1)与酸反应
前面我们学到了碳酸钙可以与盐酸反应:
CaCO3+2HCl=CaCl2+H2CO3
碳酸钠和碳酸氢钠是否也发生类似的反应?
盐酸腐蚀含碳酸钙的建材
H2O + CO2↑
一、盐的化学性质
(1)与酸反应
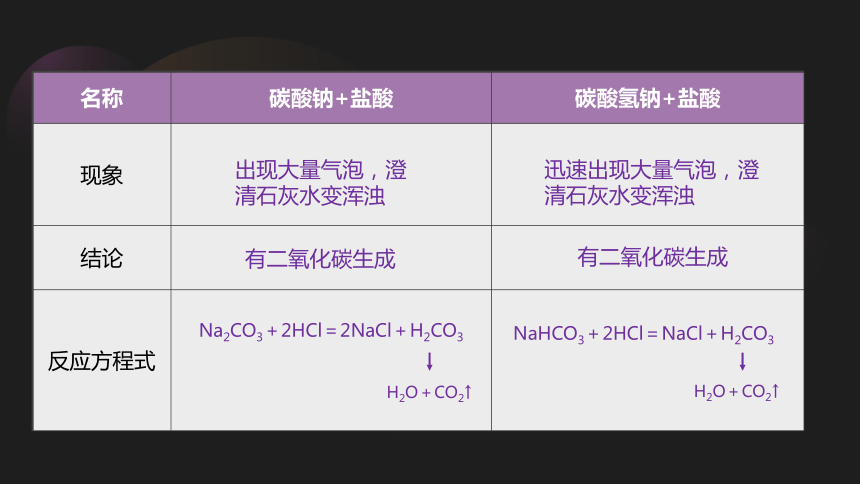
碳酸钠、碳酸氢钠与盐酸反应
名称 碳酸钠+盐酸 碳酸氢钠+盐酸
现象
结论
反应方程式
出现大量气泡,澄清石灰水变浑浊
迅速出现大量气泡,澄清石灰水变浑浊
有二氧化碳生成
有二氧化碳生成
Na2CO3+2HCl=2NaCl+H2CO3
H2O+CO2↑
NaHCO3+2HCl=NaCl+H2CO3
H2O+CO2↑
如何检验含有CO32-(或HCO3-)离子的盐?
思考与交流
CO32-(或HCO3- )的检验方法
实验操作 实验现象 实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水
有无色气体生成
澄清石灰水变浑浊
该样品含有CO32-(或HCO3-)离子的盐
一、盐的化学性质
(1)与酸反应
还学到了硝酸银可以与盐酸反应:
AgNO3 + HCl =
AgCI↓ + HNO3
(1)与酸反应
实验现象:
有白色沉淀产生
有白色沉淀产生
一、盐的化学性质
(1)与酸反应
一、盐的化学性质
CaCO3+2HCl = CaCl2+H2O+CO2↑
AgNO3 + HCl = AgCl↓ + HNO3
酸可溶 盐爱溶不溶
盐 + 酸 → 新盐 + 新酸
一、盐的化学性质
(2)与碱溶液反应
实验现象 化学方程式
氢氧化钙+硫酸铜
氢氧化钙+氯化铁
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
Ca(OH)2+CuSO4 =Cu(OH)2↓+CaSO4
蓝色沉淀
红褐色沉淀
碱溶液 + 盐溶液→ 新碱 + 新盐
反应物均可溶
一、盐的化学性质
(3)与盐溶液反应
实验现象 化学方程式
碳酸钠+氯化钡
硝酸钡+硫酸钠
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
Ca(OH)2+CuSO4 =Cu(OH)2↓+CaSO4
蓝色沉淀
红褐色沉淀
碱溶液 + 盐溶液→ 新碱 + 新盐
反应物均可溶
一、盐的化学性质
(4)与金属单质的反应
一、盐的化学性质
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
反应规律:活动性强的金属能把活动性较弱的金属从它的化合物溶液 中置换出来
盐溶液 + 金属 = 新盐(溶液)+ 新金属
盐的化学性质
盐与酸的反应
盐与碱的反应
盐与盐的反应
盐与金属单质的反应
复分解反应发生的条件
TWO
02
根据如下复分解反应化学方程式,猜想复分解反应发生条件?
H2SO4+2NaOH = Na2SO4 + 2H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
CuSO4+2NaOH = Cu(OH)2↓ +Na2SO4
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
HCl + NaOH = NaCl + H2O
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或水(难电离的物质)生成时,复分解反应才可以发生
生成水
生成气体
生成沉淀
Na+
OH-
H+
Cl-
H2O
实 质:
旁观者:
Na+和Cl-
溶液中H+和OH-的离子数目减少
复分解反应的实质:
溶液中的阴阳离子重新结合成沉淀、气体或水而减少
氢氧化钠和盐酸的反应
氯化钡和硫酸钠的反应
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
复分解反应的实质:
溶液中的阴阳离子重新结合成沉淀、气体或水而减少
碳酸钠和盐酸的反应
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
CO2
① 常见的酸大多溶于水
物质的溶解性
② 可溶的碱有:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O
③ 钾盐、钠盐、铵盐、硝酸盐都易溶于水
④ 盐酸盐中只有AgCl不溶于水
⑤ 硫酸盐中只有BaSO4不溶于水
⑥ 碳酸盐大部分不溶于水,除钾、钠、铵盐外
名称 NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
能
有水生成
不能
能
能
无气体、无沉淀、无水生成
有气体生成
有沉淀生成
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物是否能发生反应
1、根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是( )
A、Na2CO3溶液和CaCl2溶液
B、NaOH溶液和盐酸溶液
C、CuSO4溶液和BaCl2溶液
D、K2SO4溶液和NaCl溶液
D
随堂练习
2、化学反应要符合一定的原理和条件,下列认识正确的是( )
A、化合反应和分解反应一定有单质参加或生成
B、置换反应只能发生在金属与金属的化合物之间
C、复分解反应要有沉淀或气体或水生成
D、有盐和水生成的反应一定是中和反应
C
随堂练习
永远不要停下前进的脚步
第八章 常见的酸碱盐
——盐的化学性质
8.4 常见的盐
CONTENTS
1
进一步理解酸碱盐的基本概念
2
掌握盐的化学性质
3
初步学会判断复分解反应的发生
盐是什么?
What is salt
日常生活中所说的盐,通常指食盐(NaCl)
金属离子
酸根离子
化学中的盐是指含有金属离子(或铵根离子)和酸根离子的一类化合物。如碳酸钠、碳酸氢钠、碳酸钙、硫酸铜等都属于盐
盐 Na2SO4 KNO3 Mg(NO3)2 CuSO4 BaSO4 FeCl3
相关的酸
相关的碱
NaOH
H2SO4
H2SO4
KOH
HNO3
HNO3
Mg(OH)2
Cu(OH)2
H2SO4
HCI
Ba(OH)2
Fe(OH)3
盐的化学性质
ONE
01
一、盐的化学性质
(1)与酸反应
前面我们学到了碳酸钙可以与盐酸反应:
CaCO3+2HCl=CaCl2+H2CO3
碳酸钠和碳酸氢钠是否也发生类似的反应?
盐酸腐蚀含碳酸钙的建材
H2O + CO2↑
一、盐的化学性质
(1)与酸反应
碳酸钠、碳酸氢钠与盐酸反应
名称 碳酸钠+盐酸 碳酸氢钠+盐酸
现象
结论
反应方程式
出现大量气泡,澄清石灰水变浑浊
迅速出现大量气泡,澄清石灰水变浑浊
有二氧化碳生成
有二氧化碳生成
Na2CO3+2HCl=2NaCl+H2CO3
H2O+CO2↑
NaHCO3+2HCl=NaCl+H2CO3
H2O+CO2↑
如何检验含有CO32-(或HCO3-)离子的盐?
思考与交流
CO32-(或HCO3- )的检验方法
实验操作 实验现象 实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水
有无色气体生成
澄清石灰水变浑浊
该样品含有CO32-(或HCO3-)离子的盐
一、盐的化学性质
(1)与酸反应
还学到了硝酸银可以与盐酸反应:
AgNO3 + HCl =
AgCI↓ + HNO3
(1)与酸反应
实验现象:
有白色沉淀产生
有白色沉淀产生
一、盐的化学性质
(1)与酸反应
一、盐的化学性质
CaCO3+2HCl = CaCl2+H2O+CO2↑
AgNO3 + HCl = AgCl↓ + HNO3
酸可溶 盐爱溶不溶
盐 + 酸 → 新盐 + 新酸
一、盐的化学性质
(2)与碱溶液反应
实验现象 化学方程式
氢氧化钙+硫酸铜
氢氧化钙+氯化铁
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
Ca(OH)2+CuSO4 =Cu(OH)2↓+CaSO4
蓝色沉淀
红褐色沉淀
碱溶液 + 盐溶液→ 新碱 + 新盐
反应物均可溶
一、盐的化学性质
(3)与盐溶液反应
实验现象 化学方程式
碳酸钠+氯化钡
硝酸钡+硫酸钠
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
Ca(OH)2+CuSO4 =Cu(OH)2↓+CaSO4
蓝色沉淀
红褐色沉淀
碱溶液 + 盐溶液→ 新碱 + 新盐
反应物均可溶
一、盐的化学性质
(4)与金属单质的反应
一、盐的化学性质
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
反应规律:活动性强的金属能把活动性较弱的金属从它的化合物溶液 中置换出来
盐溶液 + 金属 = 新盐(溶液)+ 新金属
盐的化学性质
盐与酸的反应
盐与碱的反应
盐与盐的反应
盐与金属单质的反应
复分解反应发生的条件
TWO
02
根据如下复分解反应化学方程式,猜想复分解反应发生条件?
H2SO4+2NaOH = Na2SO4 + 2H2O
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
CuSO4+2NaOH = Cu(OH)2↓ +Na2SO4
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
NaHCO3 + HCl = NaCl + H2O + CO2↑
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
HCl + NaOH = NaCl + H2O
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或水(难电离的物质)生成时,复分解反应才可以发生
生成水
生成气体
生成沉淀
Na+
OH-
H+
Cl-
H2O
实 质:
旁观者:
Na+和Cl-
溶液中H+和OH-的离子数目减少
复分解反应的实质:
溶液中的阴阳离子重新结合成沉淀、气体或水而减少
氢氧化钠和盐酸的反应
氯化钡和硫酸钠的反应
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
复分解反应的实质:
溶液中的阴阳离子重新结合成沉淀、气体或水而减少
碳酸钠和盐酸的反应
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
CO2
① 常见的酸大多溶于水
物质的溶解性
② 可溶的碱有:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O
③ 钾盐、钠盐、铵盐、硝酸盐都易溶于水
④ 盐酸盐中只有AgCl不溶于水
⑤ 硫酸盐中只有BaSO4不溶于水
⑥ 碳酸盐大部分不溶于水,除钾、钠、铵盐外
名称 NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断依据
能
有水生成
不能
能
能
无气体、无沉淀、无水生成
有气体生成
有沉淀生成
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物是否能发生反应
1、根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是( )
A、Na2CO3溶液和CaCl2溶液
B、NaOH溶液和盐酸溶液
C、CuSO4溶液和BaCl2溶液
D、K2SO4溶液和NaCl溶液
D
随堂练习
2、化学反应要符合一定的原理和条件,下列认识正确的是( )
A、化合反应和分解反应一定有单质参加或生成
B、置换反应只能发生在金属与金属的化合物之间
C、复分解反应要有沉淀或气体或水生成
D、有盐和水生成的反应一定是中和反应
C
随堂练习
永远不要停下前进的脚步
