化学人教版(2019)必修第一册4.2《元素周期律》(共84张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2《元素周期律》(共84张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 09:44:31 | ||
图片预览








文档简介
(共84张PPT)
第二节
元素周期律
新人教版必修第一册
第四章 物质结构元素周期律
元素周期律
第1课时
归纳提升
碱金属元素
卤族元素
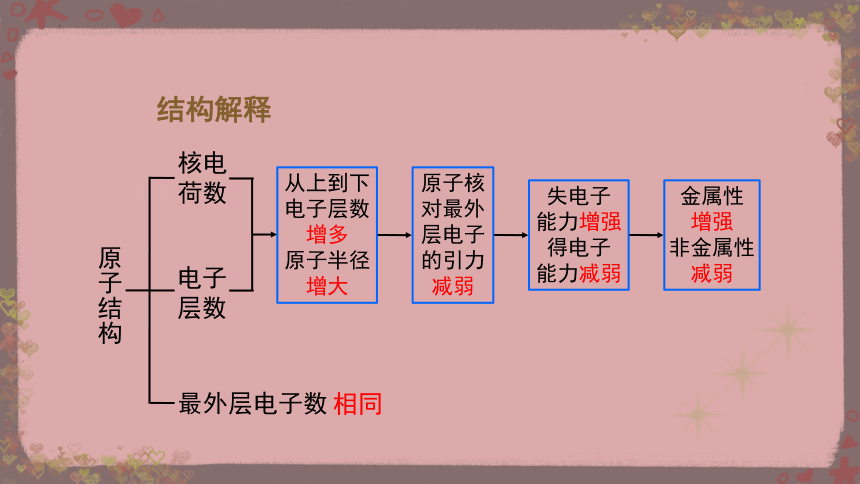
原子结构
核电
荷数
电子
层数
最外层电子数
从上到下
电子层数
增多
原子半径
增大
原子核
对最外
层电子
的引力
减弱
失电子
能力增强
得电子
能力减弱
金属性
增强
非金属性
减弱
相同
结构解释
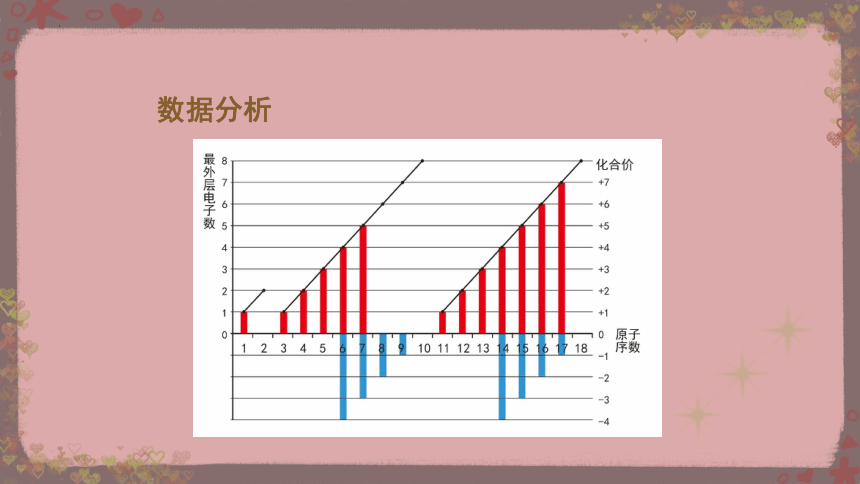
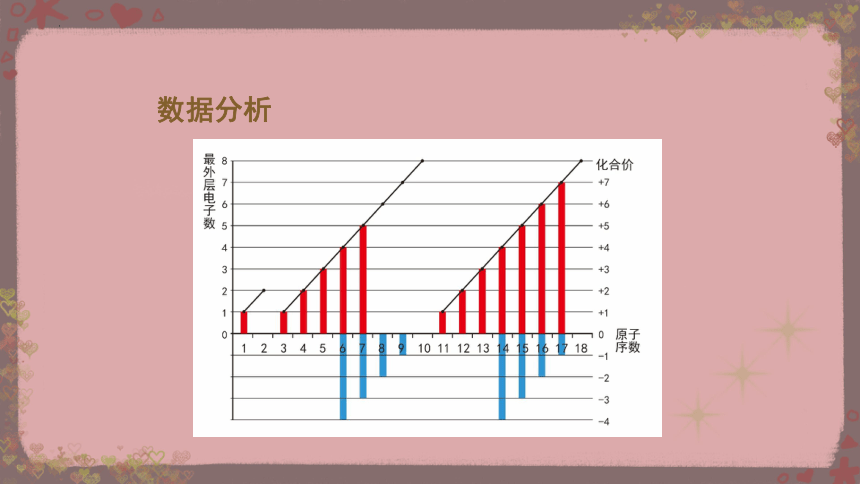
依据教材中表4-5,以原子序数为横坐标,原子最外层电子数及化合价为纵坐标,制作折线图和柱状图。
【任务一】
数据分析
数据分析
数据分析
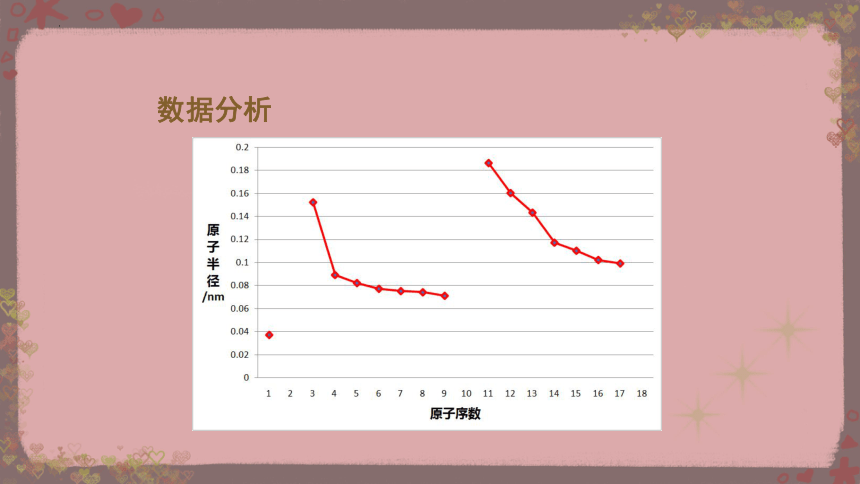
依据教材中表4-5,以原子序数为横坐标,原子半径为纵坐标,绘制折线图。
【任务二】
数据分析
数据分析
为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
【问题1】
结构解释
原子结构
核电荷数
电子层数
最外层电子数
核电荷数
增多
原子半径
减小
相同
结构解释
你能预测第三周期元素金属性的递变规律吗?依据是什么?
【问题2】
性质预测
性质预测
你能预测第三周期元素金属性的递变规律吗?依据是什么?
【问题2】
甲同学:依据金属性活动顺序,预测金属性顺序为 Na>Mg>Al
乙同学:依据钠与水的剧烈反应,预测第三周期中Na金属性最强
性质预测
丙同学:依据最外层电子数多少预测,金属性顺序为Na>Mg>Al,最外层电子数越少越容易失去
丁同学:依据核电荷数多少预测,金属性顺序为
Na>Mg>Al,核电荷数越多越难失去最外层电子
性质预测
原子结构
核电
荷数
电子层数
最外层电子数
结构解释
从左到右
核电荷数
增多
原子半径
减小
原子核
对最外
层电子
的引力
增强
失电子
能力减弱
金属性
减弱
相同
原子结构
核电
荷数
电子层数
最外层电子数
结构解释
你能设计实验验证金属性:Na>Mg>Al 吗?实验设计的依据是什么呢?
【问题3】
金属单质与水(或酸)反应置换出氢的难易程度
判断元素金属性强弱的依据
寻找证据
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
判断元素金属性强弱的依据
金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱。
如何设计实验证明NaOH、Mg(OH)2和Al(OH) 3三者碱性的强弱呢?
寻找证据
比较Mg(OH)2和Al(OH)3的碱性强弱
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2Oa
比较Mg(OH)2和Al(OH)3的碱性强弱
说明Al(OH)3是两性氢氧化物,表明金属铝已表现出一定的非金属性。
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
比较Mg(OH)2和Al(OH)3的碱性强弱
【实验结论】
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
得出结论
元素金属性:Na > Mg > Al
得出结论
【实验结论】
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
你能依据第三周期元素金属性的研究方法继续研究第三周期元素非金属性的递变规律吗?
【问题4】
判断元素非金属性强弱的依据
元素
非金属性
非金属单质与氢气反应生成气态氢化物的难易程度及氢化物的稳定性。
非金属元素的最高价氧化物对应的水化物——最高价含氧酸的酸性强弱。
寻找证据
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4)
Cl 高氯酸(HClO4)
寻找证据
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4) 强酸
Cl 高氯酸(HClO4) 酸性比硫酸的强
寻找证据
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4) 强酸
Cl 高氯酸(HClO4) 酸性比硫酸的强
寻找证据
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
寻找证据
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
寻找证据
与氢气化合的难易:磷 < 硫 < 氯气;稳定性: H2S<HCl
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
寻找证据
非金属性:Si<P<S<Cl
得出结论
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
得出结论
对其它周期主族元素进行同样的研究,一般情况下也会得出同样的规律。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
得出结论
元素周期律
含义:元素的性质随着原子序数的递增而呈周期性的变化。
总结归纳
本质:元素原子的核外电子排布呈周期性变化。
总结归纳
元素周期律
含义:元素的性质随着原子序数的递增而呈周期性的变化。
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
总结归纳
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
总结归纳
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
总结归纳
元素周期律
第2课时
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
归纳提升
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
归纳提升
原子
结构
最外层
电子数
电子层数
核电荷数 = 核外电子数
元素
位置
= 原子序数 族 周期
归纳提升
原子
结构
最外层
电子数
电子层数
核电荷数 = 核外电子数
元素
性质
化合价 原子半径 金属性/
非金属性
归纳提升
归纳提升
原子
结构
最外层
电子数
电子层数
核电荷数 = 核外电子数
元素
性质
化合价 原子半径 金属性/
非金属性
原子
结构
最外层
电子数
电子
层数
核电荷数
元素位置
元素性质
原子序数
周期
族
化合价
原子半径
金属性/非金属性
判断依据
得失电子难易程度
归纳提升
例1.有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
ⅥA
ⅦA
ⅤA
例题分析
D
例1.有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
ⅥA
ⅦA
ⅤA
例题分析
Y为氧元素
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
Y为氧元素
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
SiO2
Si
O
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
A
同主族非金属元素最高价氧化物对应的水化物酸性
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
例3. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( )
A.原子半径: W > Z > Y > X
B. 最高价氧化物对应的水化物的酸性: Z > W > X
C. W单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
X
Y
Z
W
例题分析
例3. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( )
X
Y
Z
W
N
O
S
Cl
例题分析
A.原子半径: W > Z > Y > X
B. 最高价氧化物对应的水化物的酸性: Z > W > X
Z > W > X> Y
酸性:HClO4 > H2SO4
X
Y
Z
W
N
O
S
Cl
例题分析
C. W单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
Cl2 + H2O = HCl + HClO
气体:N2 O2 Cl2
X
Y
Z
W
N
O
S
Cl
例题分析
归纳提升
归纳提升
归纳提升
归纳提升
硅芯片
实际应用
高效低毒的有机磷农药
硅芯片
实际应用
耐高温、耐腐蚀
铱合金用于制造
发动机的火花塞
高效低毒的有机磷农药
硅芯片
实际应用
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
实际应用
南极臭氧空洞示意图
新的制冷剂
氟利昂
实际应用
实际应用
已知34号硒(Se)元素,在周期表中的位置是第四周期ⅥA族元素,依据你所学的元素周期律的知识,预测该元素及其化合物的性质。
实际应用
氧族元素
Se
实际应用
与氢气生成气态氢化物由易到难:
O2 > S > Se
氢化物稳定性由强到弱:
H2O > H2S > H2Se
最高价氧化物对应的水化物的酸性:
H2SeO4 < H2SO4
34
Se
78.97
16
S
32.06
8
O
16.00
实际应用
与氢气生成气态氢化物由难到易:
As < Se < Br2
氢化物稳定性由弱到强:
AsH3 < H2Se < HBr
最高价氧化物对应的水化物的酸性:
H3AsO4 < H2SeO4 < HBrO4
33
As
74.92
35
Br
79.90
34
Se
78.97
16
S
32.06
8
O
16.00
实际应用
门捷列夫的预言
科学史话
镓
(1875)
门捷列夫的预言
科学史话
镓
(1875)
门捷列夫的预言
科学史话
教材114页第8题
门捷列夫
镓、钪、锗
预测
证实
科学家
莫塞莱
锝、钷、铪、铼
预测
证实
科学家
门捷列夫的预言
科学史话
碱金属元素
门捷列夫的预言
科学史话
碱金属元素
门捷列夫的预言
科学史话
8 119 ……
碱金属元素
门捷列夫的预言
科学史话
8 119 ……
元素周期律的应用和意义
学习化学的一种重要工具
预测或推测元素的原子结构和性质
应用于科学研究和生产
论证了事物变化的量变引起质变
课堂小结
谢谢观看!
第二节
元素周期律
新人教版必修第一册
第四章 物质结构元素周期律
元素周期律
第1课时
归纳提升
碱金属元素
卤族元素
原子结构
核电
荷数
电子
层数
最外层电子数
从上到下
电子层数
增多
原子半径
增大
原子核
对最外
层电子
的引力
减弱
失电子
能力增强
得电子
能力减弱
金属性
增强
非金属性
减弱
相同
结构解释
依据教材中表4-5,以原子序数为横坐标,原子最外层电子数及化合价为纵坐标,制作折线图和柱状图。
【任务一】
数据分析
数据分析
数据分析
依据教材中表4-5,以原子序数为横坐标,原子半径为纵坐标,绘制折线图。
【任务二】
数据分析
数据分析
为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
【问题1】
结构解释
原子结构
核电荷数
电子层数
最外层电子数
核电荷数
增多
原子半径
减小
相同
结构解释
你能预测第三周期元素金属性的递变规律吗?依据是什么?
【问题2】
性质预测
性质预测
你能预测第三周期元素金属性的递变规律吗?依据是什么?
【问题2】
甲同学:依据金属性活动顺序,预测金属性顺序为 Na>Mg>Al
乙同学:依据钠与水的剧烈反应,预测第三周期中Na金属性最强
性质预测
丙同学:依据最外层电子数多少预测,金属性顺序为Na>Mg>Al,最外层电子数越少越容易失去
丁同学:依据核电荷数多少预测,金属性顺序为
Na>Mg>Al,核电荷数越多越难失去最外层电子
性质预测
原子结构
核电
荷数
电子层数
最外层电子数
结构解释
从左到右
核电荷数
增多
原子半径
减小
原子核
对最外
层电子
的引力
增强
失电子
能力减弱
金属性
减弱
相同
原子结构
核电
荷数
电子层数
最外层电子数
结构解释
你能设计实验验证金属性:Na>Mg>Al 吗?实验设计的依据是什么呢?
【问题3】
金属单质与水(或酸)反应置换出氢的难易程度
判断元素金属性强弱的依据
寻找证据
比较钠、镁单质与水反应的难易程度
比较镁、铝单质与盐酸反应置换出氢气的难易程度
判断元素金属性强弱的依据
金属元素最高价氧化物对应的水化物——氢氧化物的碱性强弱。
如何设计实验证明NaOH、Mg(OH)2和Al(OH) 3三者碱性的强弱呢?
寻找证据
比较Mg(OH)2和Al(OH)3的碱性强弱
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2Oa
比较Mg(OH)2和Al(OH)3的碱性强弱
说明Al(OH)3是两性氢氧化物,表明金属铝已表现出一定的非金属性。
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
比较Mg(OH)2和Al(OH)3的碱性强弱
【实验结论】
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
得出结论
元素金属性:Na > Mg > Al
得出结论
【实验结论】
NaOH是强碱,Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物
碱性强弱:NaOH > Mg(OH)2 > Al(OH)3
你能依据第三周期元素金属性的研究方法继续研究第三周期元素非金属性的递变规律吗?
【问题4】
判断元素非金属性强弱的依据
元素
非金属性
非金属单质与氢气反应生成气态氢化物的难易程度及氢化物的稳定性。
非金属元素的最高价氧化物对应的水化物——最高价含氧酸的酸性强弱。
寻找证据
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4)
Cl 高氯酸(HClO4)
寻找证据
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4) 强酸
Cl 高氯酸(HClO4) 酸性比硫酸的强
寻找证据
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
元素 最高价氧化物 对应的水化物 酸性强弱
Si 硅酸(H2SiO3) 很弱的酸
P 磷酸(H3PO4) 中强酸
S 硫酸(H2SO4) 强酸
Cl 高氯酸(HClO4) 酸性比硫酸的强
寻找证据
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
寻找证据
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
寻找证据
与氢气化合的难易:磷 < 硫 < 氯气;稳定性: H2S<HCl
元素 单质与氢气化合的难易 氢化物稳定性
P 磷蒸气与氢气能反应生成气态氢化物 ——磷化氢(PH3)
S 硫在加热时能与氢气反应生成气态氢化物——硫化氢(H2S) 硫化氢在较高温度时可以分解
Cl 氯气与氢气能在光照或点燃的条件下反应生成稳定的气态氢化物——氯化氢 氯化氢是稳定的气态氢化物
寻找证据
非金属性:Si<P<S<Cl
得出结论
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
得出结论
对其它周期主族元素进行同样的研究,一般情况下也会得出同样的规律。
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
得出结论
元素周期律
含义:元素的性质随着原子序数的递增而呈周期性的变化。
总结归纳
本质:元素原子的核外电子排布呈周期性变化。
总结归纳
元素周期律
含义:元素的性质随着原子序数的递增而呈周期性的变化。
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
总结归纳
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
总结归纳
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
总结归纳
元素周期律
第2课时
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
归纳提升
元素原子的核外电子排布周期性变化
元素性质的周期性变化
最外层电子数
核电荷数
电子层数
原子半径
金属性
非金属性
(得失电子能力)
化合价
决定
得失电子的趋势
归纳提升
原子
结构
最外层
电子数
电子层数
核电荷数 = 核外电子数
元素
位置
= 原子序数 族 周期
归纳提升
原子
结构
最外层
电子数
电子层数
核电荷数 = 核外电子数
元素
性质
化合价 原子半径 金属性/
非金属性
归纳提升
归纳提升
原子
结构
最外层
电子数
电子层数
核电荷数 = 核外电子数
元素
性质
化合价 原子半径 金属性/
非金属性
原子
结构
最外层
电子数
电子
层数
核电荷数
元素位置
元素性质
原子序数
周期
族
化合价
原子半径
金属性/非金属性
判断依据
得失电子难易程度
归纳提升
例1.有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
ⅥA
ⅦA
ⅤA
例题分析
D
例1.有同周期的三种元素X、Y、Z ,已知它们的最高价含氧酸的酸性由强到弱的顺序为 HXO4 > H2YO4 > H3ZO4,则下列叙述中不正确的是( )
A.非金属性 X > Y > Z
B. X、Y、Z 形成的阴离子还原性逐渐增强
C. 原子半径 X < Y < Z
D. X、Y、Z 的气态氢化物稳定性由弱到强
ⅥA
ⅦA
ⅤA
例题分析
Y为氧元素
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
Y为氧元素
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
SiO2
Si
O
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
A
同主族非金属元素最高价氧化物对应的水化物酸性
例2.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是次外层电子数的一半, Y的二价阴离子和Ne的电子层结构相同,关于X和Y形成的化合物Z的说法中正确的是( )
A. Z是酸性氧化物 B. Z的水化物是碱
C. Z 的化学式为X2Y D. Z的水化物的酸性强于碳酸
例题分析
例3. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( )
A.原子半径: W > Z > Y > X
B. 最高价氧化物对应的水化物的酸性: Z > W > X
C. W单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
X
Y
Z
W
例题分析
例3. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是( )
X
Y
Z
W
N
O
S
Cl
例题分析
A.原子半径: W > Z > Y > X
B. 最高价氧化物对应的水化物的酸性: Z > W > X
Z > W > X> Y
酸性:HClO4 > H2SO4
X
Y
Z
W
N
O
S
Cl
例题分析
C. W单质能与水反应生成两种强酸
D.四种元素的单质中,只有Z单质在常温常压下是固体
Cl2 + H2O = HCl + HClO
气体:N2 O2 Cl2
X
Y
Z
W
N
O
S
Cl
例题分析
归纳提升
归纳提升
归纳提升
归纳提升
硅芯片
实际应用
高效低毒的有机磷农药
硅芯片
实际应用
耐高温、耐腐蚀
铱合金用于制造
发动机的火花塞
高效低毒的有机磷农药
硅芯片
实际应用
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
美国化学家托马斯·米奇利
制冷剂——氟利昂
实际应用
实际应用
南极臭氧空洞示意图
新的制冷剂
氟利昂
实际应用
实际应用
已知34号硒(Se)元素,在周期表中的位置是第四周期ⅥA族元素,依据你所学的元素周期律的知识,预测该元素及其化合物的性质。
实际应用
氧族元素
Se
实际应用
与氢气生成气态氢化物由易到难:
O2 > S > Se
氢化物稳定性由强到弱:
H2O > H2S > H2Se
最高价氧化物对应的水化物的酸性:
H2SeO4 < H2SO4
34
Se
78.97
16
S
32.06
8
O
16.00
实际应用
与氢气生成气态氢化物由难到易:
As < Se < Br2
氢化物稳定性由弱到强:
AsH3 < H2Se < HBr
最高价氧化物对应的水化物的酸性:
H3AsO4 < H2SeO4 < HBrO4
33
As
74.92
35
Br
79.90
34
Se
78.97
16
S
32.06
8
O
16.00
实际应用
门捷列夫的预言
科学史话
镓
(1875)
门捷列夫的预言
科学史话
镓
(1875)
门捷列夫的预言
科学史话
教材114页第8题
门捷列夫
镓、钪、锗
预测
证实
科学家
莫塞莱
锝、钷、铪、铼
预测
证实
科学家
门捷列夫的预言
科学史话
碱金属元素
门捷列夫的预言
科学史话
碱金属元素
门捷列夫的预言
科学史话
8 119 ……
碱金属元素
门捷列夫的预言
科学史话
8 119 ……
元素周期律的应用和意义
学习化学的一种重要工具
预测或推测元素的原子结构和性质
应用于科学研究和生产
论证了事物变化的量变引起质变
课堂小结
谢谢观看!
