化学人教版(2019)选择性必修2 2.2.1 分子结构的测定和多样性 价层电子对互斥模型(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.2.1 分子结构的测定和多样性 价层电子对互斥模型(共28张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 25.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 09:53:58 | ||
图片预览





文档简介
(共28张PPT)
第二节 分子的空间结构
第1课时 分子结构的测定和多样性
价层电子对互斥模型
2019人教版 选择性必修2 第二章 分子结构与性质
【课程学习目标·学科核心素养】
知道分子的结构可以通过波谱、X身线衍射等技术进行测定。
认识共价分子结构的多样性和复杂性。
借助实物模型、计算机软件模拟、视频等手段,加深对分子具有特定空间结构的认识,发展“证据推理与模型认知”学科核心素养。
能运用价层电子对互斥模型预测简单粉子的空间结构,发展“科学探究与创新意识”学科核心素养。
知识导航
一.分子结构的测定
早年科学家主要靠对物质的化学性质进行系统总结得出规律后进行推测,现代科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、晶体X射线衍射等。
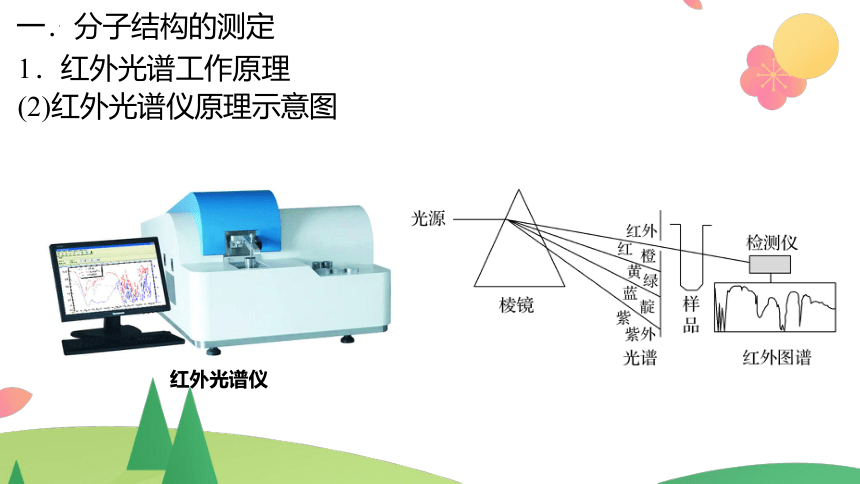
1.红外光谱工作原理
(1)原理:
红外线透过分子时,分子会吸收跟它的某些化学键振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
一.分子结构的测定
1.红外光谱工作原理
(2)红外光谱仪原理示意图
红外光谱仪
一.分子结构的测定
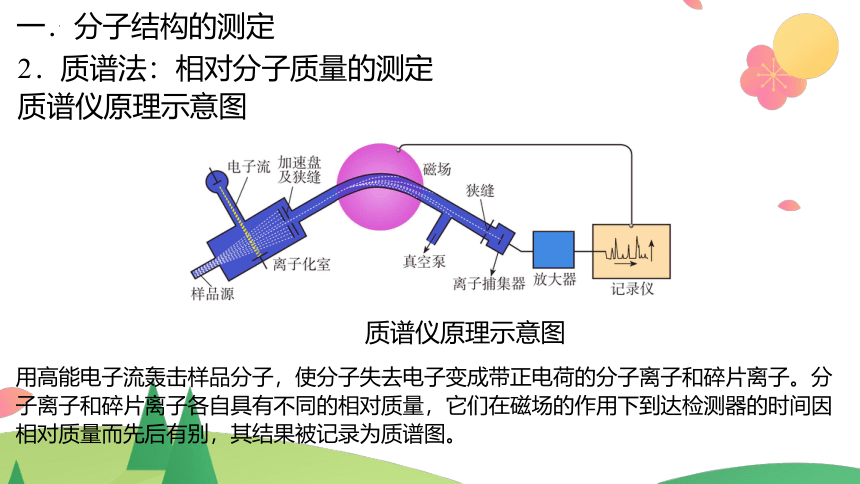
2.质谱法:相对分子质量的测定
现代化学常利用质谱仪测定分子的相对分子质量。
质谱仪
质谱仪原理示意图
一.分子结构的测定
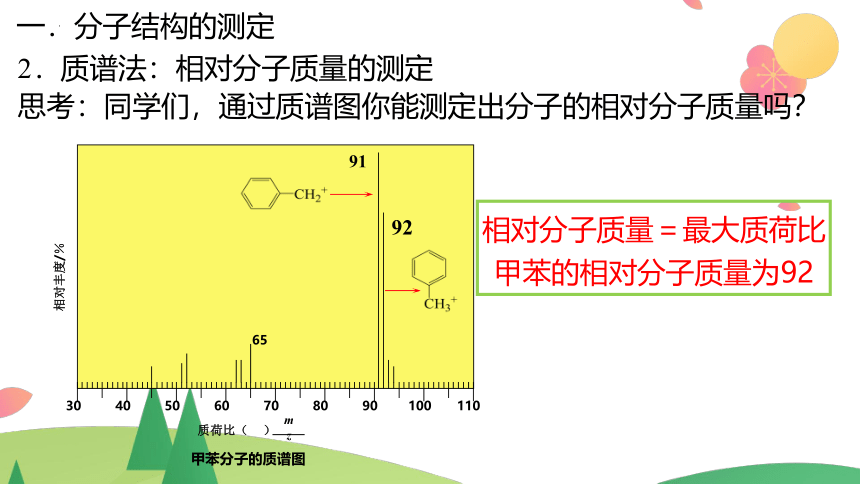
2.质谱法:相对分子质量的测定
质谱仪原理示意图
用高能电子流轰击样品分子,使分子失去电子变成带正电荷的分子离子和碎片离子。分子离子和碎片离子各自具有不同的相对质量,它们在磁场的作用下到达检测器的时间因相对质量而先后有别,其结果被记录为质谱图。
30
40
50
60
100
70
80
110
90
65
91
92
相对丰度/%
质荷比( )
m
z
甲苯分子的质谱图
相对分子质量=最大质荷比
甲苯的相对分子质量为92
一.分子结构的测定
2.质谱法:相对分子质量的测定
思考:同学们,通过质谱图你能测定出分子的相对分子质量吗?
二.多样的分子空间结构
大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
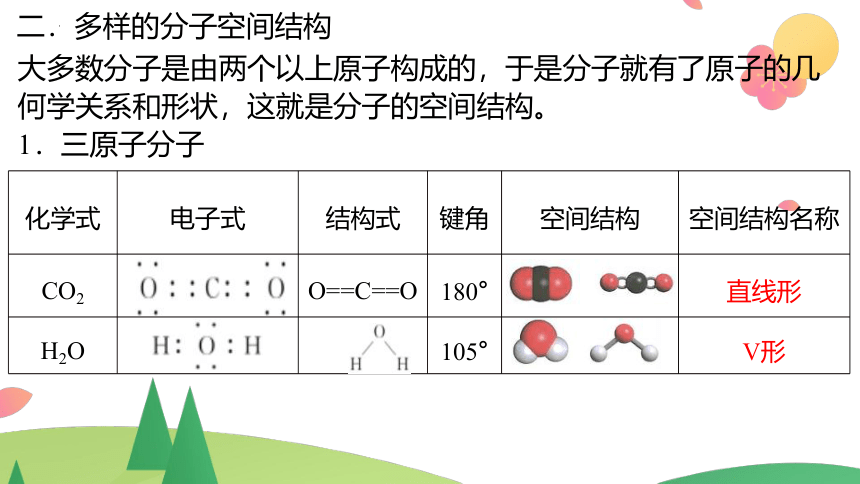
1.三原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CO2 O==C==O 180° 直线形
H2O 105° V形
二.多样的分子空间结构
2.四原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CH2O 约120° 平面三角形
NH3 107° 三角锥形
二.多样的分子空间结构
3.五原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CH4 109°28′ 正四面体形
CCl4 109°28′ 正四面体形
二.多样的分子空间结构
4.其他多原子分子的空间结构
P4O6
SF6
P4
P4O10
C60
S8
椅式C6H12
船式C6H12
三.价层电子对互斥模型
CO2和H2O都是三原子分子,为什么CO2呈直线形而H2O呈V形?CH2O和NH3都是四原子分子,为什么CH2O呈平面三角形而NH3呈三角锥形?
CO2 H2O
CH2O NH3
三.价层电子对互斥模型
1.价层电子对互斥模型(VSEPR model):
对ABn型的分子或离子,中心原子A的价层电子对(包括成键的σ键电子对和未成键的孤电子对)之间由于存在排斥力,将使分子的空间结构总是采取电子对相互排斥最弱的那种结构,以使彼此之间斥力最小,分子或离子的体系能量最低,最稳定。
价层电子对互斥模型认为,
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
三.价层电子对互斥模型
2.价层电子对的计算
(1)中心原子价层电子对数=σ键电子对数+孤电子对数。
(2) σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几对σ键电子对。如H2O分子中, O有2对σ键电子对。NH3分子中, N有3对σ键电子对。
(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数= (a-xb)
σ键电子对 ABn型分子 为n
中心原子价层电子对
孤电子对=
三.价层电子对互斥模型
①a表示中心原子的价电子数;
对主族元素:a=最外层电子数;
对于阳离子:a=价电子数-离子所带电荷数;
对于阴离子:a=价电子数+离子所带电荷数。
②x表示与中心原子结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,氢为1,
其他原子=8-该原子的价电子数,如Cl为1,S为2等。
三.价层电子对互斥模型
3.价层电子对的空间结构(即VSEPR模型)
价层电子对数 VSEPR模型(价层电子互斥模型)
2 直线形
3 平面三角形
4 (正)四面体形
这是价层电子在空间排列构型,以此延伸出分子在空间的构型,二者不完全一致。
与中心原子
孤电子对数有关
三.价层电子对互斥模型
利用VSEPR理论预测分子立体构型的思路:
σ键电子对数+孤电子对数=价层电子对数
VSEPR模型 分子的立体构型
SO2
NH3
价层电子对数 σ键电子 对数 孤电子 对数 VSEPR模型 分子的立 体构型 典例
2 2 0 直线形 直线形 CO2
3 3 0 平面三角形 平面三角形 BF3
2 1 V形 SO2
4 4 0 正四面体 正四面体 CH4
3 1 三角锥形 NH3
2 2 V形 H2O
三.价层电子对互斥模型
问题:CH4、NH3、H2O,VSEPR模型都是四面体形,键角为什么依次减小?
由于孤电子对对共用电子对的排斥作用更大,使键角变小,
孤电子对数越多排斥作用越大,键角越小。
三.价层电子对互斥模型
分子 VSEPR模型 杂化方式 键角
CH4 四面体形 sp3 109°28′
NH3 四面体形 sp3 107°
H2O 四面体形 sp3 105°
效果检测
【典例1】(2022·四川资阳·高二期末)下列微粒的VSEPR模型与空间立体构型一致的是
A.BF3 B.SO2 C.H2O D.SO32-
【答案】A
【典例2】(2021·四川·成都外国语学校高二期中)用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.SO2的分子构型为V形
B.SO3是三角锥形分子
C.BF3的键角为60°
D.PCl3是平面三角形分子
【答案】A
【典例3】(2021·北京市第十三中学高二期中)下列粒子的VSEPR模型为四面体,且空间构型结构为V型的是
A.H2O B.NF3 C.H3O+ D.SO2
【答案】A
【典例4】(2021·浙江·诸暨中学高二期中)下列关于价层电子对互斥模型(VSEPR 模型)的叙述中不正确的是
A.VSEPR 模型可用预测分子的立体构型
B.VSEPR 模型不能用于预测以过渡金属为中心原子的分子
C.中心原子上的孤电子对也要占据中心原子周围的空间并参与互相排斥
D.分子中键角越大,价层电子对相互排斥力越大,分子越稳定
【答案】D
【典例5】(2021·河北·河间市第十四中学高二期中)用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.PCl3为平面三角形 B.SO3与CO32-为平面三角形
C.SO2键角大于120o D.BF3是三角锥形分子
【答案】B
【典例6】(2021·四川省蒲江县蒲江中学高二阶段练习)下列对应关系不正确的是
【答案】A
选项 代表物 分子类型 有无孤电子对 空间构型
A SO2 AB2 无 直线形
B CH2O AB3 无 平面三角形
C H2O AB2 有 V形
D NH3 AB3 有 三角锥形
本课结束
第二节 分子的空间结构
第1课时 分子结构的测定和多样性
价层电子对互斥模型
2019人教版 选择性必修2 第二章 分子结构与性质
【课程学习目标·学科核心素养】
知道分子的结构可以通过波谱、X身线衍射等技术进行测定。
认识共价分子结构的多样性和复杂性。
借助实物模型、计算机软件模拟、视频等手段,加深对分子具有特定空间结构的认识,发展“证据推理与模型认知”学科核心素养。
能运用价层电子对互斥模型预测简单粉子的空间结构,发展“科学探究与创新意识”学科核心素养。
知识导航
一.分子结构的测定
早年科学家主要靠对物质的化学性质进行系统总结得出规律后进行推测,现代科学家应用了许多测定分子结构的现代仪器和方法,如红外光谱、晶体X射线衍射等。
1.红外光谱工作原理
(1)原理:
红外线透过分子时,分子会吸收跟它的某些化学键振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过和已有谱图库比对,或通过量子化学计算,可以得知分子中含有何种化学键或官能团的信息。
一.分子结构的测定
1.红外光谱工作原理
(2)红外光谱仪原理示意图
红外光谱仪
一.分子结构的测定
2.质谱法:相对分子质量的测定
现代化学常利用质谱仪测定分子的相对分子质量。
质谱仪
质谱仪原理示意图
一.分子结构的测定
2.质谱法:相对分子质量的测定
质谱仪原理示意图
用高能电子流轰击样品分子,使分子失去电子变成带正电荷的分子离子和碎片离子。分子离子和碎片离子各自具有不同的相对质量,它们在磁场的作用下到达检测器的时间因相对质量而先后有别,其结果被记录为质谱图。
30
40
50
60
100
70
80
110
90
65
91
92
相对丰度/%
质荷比( )
m
z
甲苯分子的质谱图
相对分子质量=最大质荷比
甲苯的相对分子质量为92
一.分子结构的测定
2.质谱法:相对分子质量的测定
思考:同学们,通过质谱图你能测定出分子的相对分子质量吗?
二.多样的分子空间结构
大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
1.三原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CO2 O==C==O 180° 直线形
H2O 105° V形
二.多样的分子空间结构
2.四原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CH2O 约120° 平面三角形
NH3 107° 三角锥形
二.多样的分子空间结构
3.五原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CH4 109°28′ 正四面体形
CCl4 109°28′ 正四面体形
二.多样的分子空间结构
4.其他多原子分子的空间结构
P4O6
SF6
P4
P4O10
C60
S8
椅式C6H12
船式C6H12
三.价层电子对互斥模型
CO2和H2O都是三原子分子,为什么CO2呈直线形而H2O呈V形?CH2O和NH3都是四原子分子,为什么CH2O呈平面三角形而NH3呈三角锥形?
CO2 H2O
CH2O NH3
三.价层电子对互斥模型
1.价层电子对互斥模型(VSEPR model):
对ABn型的分子或离子,中心原子A的价层电子对(包括成键的σ键电子对和未成键的孤电子对)之间由于存在排斥力,将使分子的空间结构总是采取电子对相互排斥最弱的那种结构,以使彼此之间斥力最小,分子或离子的体系能量最低,最稳定。
价层电子对互斥模型认为,
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
三.价层电子对互斥模型
2.价层电子对的计算
(1)中心原子价层电子对数=σ键电子对数+孤电子对数。
(2) σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几对σ键电子对。如H2O分子中, O有2对σ键电子对。NH3分子中, N有3对σ键电子对。
(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数= (a-xb)
σ键电子对 ABn型分子 为n
中心原子价层电子对
孤电子对=
三.价层电子对互斥模型
①a表示中心原子的价电子数;
对主族元素:a=最外层电子数;
对于阳离子:a=价电子数-离子所带电荷数;
对于阴离子:a=价电子数+离子所带电荷数。
②x表示与中心原子结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,氢为1,
其他原子=8-该原子的价电子数,如Cl为1,S为2等。
三.价层电子对互斥模型
3.价层电子对的空间结构(即VSEPR模型)
价层电子对数 VSEPR模型(价层电子互斥模型)
2 直线形
3 平面三角形
4 (正)四面体形
这是价层电子在空间排列构型,以此延伸出分子在空间的构型,二者不完全一致。
与中心原子
孤电子对数有关
三.价层电子对互斥模型
利用VSEPR理论预测分子立体构型的思路:
σ键电子对数+孤电子对数=价层电子对数
VSEPR模型 分子的立体构型
SO2
NH3
价层电子对数 σ键电子 对数 孤电子 对数 VSEPR模型 分子的立 体构型 典例
2 2 0 直线形 直线形 CO2
3 3 0 平面三角形 平面三角形 BF3
2 1 V形 SO2
4 4 0 正四面体 正四面体 CH4
3 1 三角锥形 NH3
2 2 V形 H2O
三.价层电子对互斥模型
问题:CH4、NH3、H2O,VSEPR模型都是四面体形,键角为什么依次减小?
由于孤电子对对共用电子对的排斥作用更大,使键角变小,
孤电子对数越多排斥作用越大,键角越小。
三.价层电子对互斥模型
分子 VSEPR模型 杂化方式 键角
CH4 四面体形 sp3 109°28′
NH3 四面体形 sp3 107°
H2O 四面体形 sp3 105°
效果检测
【典例1】(2022·四川资阳·高二期末)下列微粒的VSEPR模型与空间立体构型一致的是
A.BF3 B.SO2 C.H2O D.SO32-
【答案】A
【典例2】(2021·四川·成都外国语学校高二期中)用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.SO2的分子构型为V形
B.SO3是三角锥形分子
C.BF3的键角为60°
D.PCl3是平面三角形分子
【答案】A
【典例3】(2021·北京市第十三中学高二期中)下列粒子的VSEPR模型为四面体,且空间构型结构为V型的是
A.H2O B.NF3 C.H3O+ D.SO2
【答案】A
【典例4】(2021·浙江·诸暨中学高二期中)下列关于价层电子对互斥模型(VSEPR 模型)的叙述中不正确的是
A.VSEPR 模型可用预测分子的立体构型
B.VSEPR 模型不能用于预测以过渡金属为中心原子的分子
C.中心原子上的孤电子对也要占据中心原子周围的空间并参与互相排斥
D.分子中键角越大,价层电子对相互排斥力越大,分子越稳定
【答案】D
【典例5】(2021·河北·河间市第十四中学高二期中)用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.PCl3为平面三角形 B.SO3与CO32-为平面三角形
C.SO2键角大于120o D.BF3是三角锥形分子
【答案】B
【典例6】(2021·四川省蒲江县蒲江中学高二阶段练习)下列对应关系不正确的是
【答案】A
选项 代表物 分子类型 有无孤电子对 空间构型
A SO2 AB2 无 直线形
B CH2O AB3 无 平面三角形
C H2O AB2 有 V形
D NH3 AB3 有 三角锥形
本课结束
