化学人教版(2019)必修第一册1.3氧化还原反应(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3氧化还原反应(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 13.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 09:57:43 | ||
图片预览











文档简介
(共39张PPT)
1.3.1 氧化还原反应
[环节1]创设情境,引入新课
空气中久置
[环节1]创设情境,引入新课
煤气燃烧
电池放电
金属的冶炼与锈蚀
[环节2]问题驱动,宏观辨识
CaO + H2O = Ca(OH)2
2KClO3 == 2KCl + 3O2↑
Fe + CuSO4 = Cu + FeSO4
HCl + NaOH = NaCl + H2O
(化合反应)
(置换反应)
(分解反应)
(复分解反应)
△
Fe2O3 + 3CO == 2Fe + 3CO2
高温
1 认识氧化还原反应
(1) 从得失氧的角度认识
CuO + H2 = Cu + H2O
△
H2 得到氧,被氧化,发生氧化反应
CuO 失去氧,被还原,发生还原反应
有氧得失的反应就是氧化还原反应
1 认识氧化还原反应
(2) 从化合价的角度认识
CuO + H2 = Cu + H2O
△
+2 0 0 +1
0 0 +1 -1
0 0 +1 -1
2Na + Cl2 == 2NaCl
H2 + Cl2 == 2HCl
点燃
点燃
1 认识氧化还原反应
(2) 从化合价的角度认识
CuO + H2 = Cu + H2O
△
+2 0 0 +1
化合价升高,被氧化,发生氧化反应
化合价降低,被还原,发生还原反应
有化合价变化的反应就是氧化还原反应
1 认识氧化还原反应
(2) 从化合价的角度认识
Fe + CuSO4 = FeSO4 + Cu
CaO + H2O =Ca(OH)2
有化合价变化的反应就是氧化还原反应
氧化还原反应
非氧化还原反应
(判断依据)
0 +2 +2 0
1 认识氧化还原反应
(3) 从电子转移的角度认识
有电子转移的反应就是氧化还原反应
(本质)
失去电子或共用电子对偏离
得到电子或共用电子对偏向
化合价升高
被氧化
氧化反应
化合价降低
被还原
还原反应
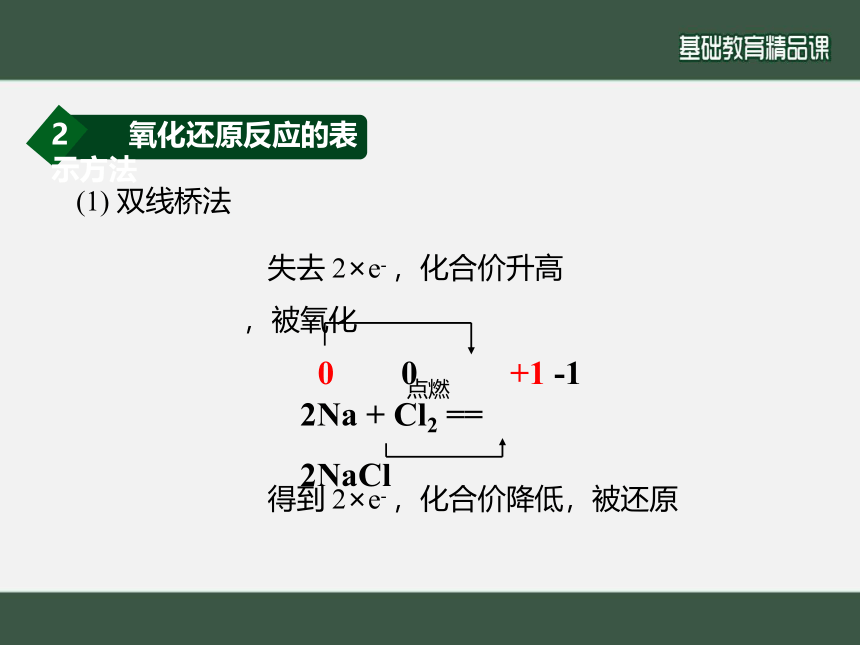
2 氧化还原反应的表示方法
(1) 双线桥法
2Na + Cl2 == 2NaCl
点燃
失去 2×e- ,化合价升高,被氧化
得到 2×e- ,化合价降低,被还原
0 0 +1 -1
2 氧化还原反应的表示方法
(2) 单线桥法
2Na + Cl2 == 2NaCl
点燃
2e-
在反应物中,画出由失去电子的元素指向得到电子的元素的线桥,
并在线桥上写出转移电子总数。
[环节4]构建模型,深化认知
Fe+CuCl2 = FeCl2+Cu
Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O
Na2O+H2O = 2NaOH
2Mg+O2 == 2MgO
NH4HCO3==NH3↑+CO2↑+H2O
2H2O2 == 2H2O+O2↑
点燃
△
置换反应,氧化还原反应
复分解反应,非氧化还原反应
化合反应,非氧化还原反应
化合反应,氧化还原反应
分解反应,非氧化还原反应
分解反应,氧化还原反应
MnO2
3 氧化还原反应和四大基本反应的关系
非氧化还原反应
氧化还原反应
复分解
反应
化合 反应
置换
反应
分解 反应
[环节5]应用新知,联系实际
S + 2KNO3 + 3C = K2S + N2↑+ 3CO2↑
[环节5]应用新知,联系实际
N2H4+O2 == N2+2H2O
点燃
CO+NO === N2+CO2
催化剂
课后作业
请同学们通过报纸、杂志、书籍或互联网等,查阅有关氧化还原反应在日常生活、工农业生产和科学技术中应用的几个具体事例,讨论并交流你对氧化还原反应的认识。
1. 完成教材P38:1、4、5、6。
2. 完成课后同步课时检测题。
3. 预习氧化剂和还原剂部分知识。
1.3.2 氧化剂和还原剂
[环节1]复习旧知,引入新课
氧化还原反应的特征:
氧化还原反应实质:
2Na + Cl2 == 2NaCl
点燃
失去 2×e- ,化合价升高,被氧化
得到 2×e- ,化合价降低,被还原
0 0 +1 -1
电子的转移(电子得失或电子对的转移)
化合价的升降
[环节2]问题驱动,建立模型
CuO + H2 == Cu + H2O
2e-
氧化剂
还原剂
还原产物
氧化产物
氧化性
还原性
1 氧化剂与还原剂
(1) 概念
氧化剂:得到电子(或电子对偏向)的物质
还原剂:失去电子(或电子对偏离)的物质
氧化产物:还原剂被氧化,对应生成氧化产物
还原产物:氧化剂被还原,对应生成还原产物
1 氧化剂与还原剂
(2) 关联
1 氧化剂与还原剂
判断下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物
2Na + Cl2 == 2NaCl
点燃
2H2O == 2H2 ↑ + O2↑
通电
Zn + H2SO4 == ZnSO4 + H2↑
2KClO3 == 2KCl+3O2↑
△
MnO2
1 氧化剂与还原剂
(3) 常见的氧化剂
① 活泼非金属单质。如 F2、Cl2、Br2、O2 等。
② 元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐。
如 MnO2、NO2、浓H2SO4、 HNO3、KMnO4、KClO3、FeCl3 等。
③ 过氧化物。如Na2O2,H2O2等。
1 氧化剂与还原剂
(4) 常见的还原剂
① 金属单质,如 Na,K,Zn,Fe 等。
② 某些非金属单质,如 H2,C,Si等。
③ 元素处于低化合价时的氧化物,如 CO,SO2 等。
④ 元素处于低化合价时的酸,如 HCl (浓),HBr,HI,H2S 等。
⑤ 元素处于低化合价时的盐,如 Na2SO3,FeSO4 等。
2 氧化性与还原性的强弱比较
(1) 根据氧化还原反应方程式比较
Zn + H2SO4 == ZnSO4 + H2↑
氧化性:Fe > Cu
还原性:CuSO4 > FeSO4
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
2 氧化性与还原性的强弱比较
(2) 根据元素的活动性顺序比较
2 氧化性与还原性的强弱比较
(3) 根据反应条件和反应的剧烈程度比较
2Na + 2H2O (冷水) = 2NaOH + H2↑
Mg + 2H2O (热水) = Mg(OH)2 + H2↑
3Fe + 4H2O (g) = Fe3O4 + 4H2
高温
还原性:Na > Mg > Fe
2 氧化性与还原性的强弱比较
(4) 根据氧化性还原反应的程度比较
相同条件下:
不同氧化剂作用于同一种还原剂,氧化产物价态高的氧化性强。
不同还原剂作用于同一种氧化剂,还原产物价态低的还原性强。
2Fe + 3Cl2 = 2FeCl3
点燃
Fe + S = FeS
研磨
[环节3]深入探究,强化认知
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
用双线桥法分析下列氧化还原反应,找出氧化剂和还原剂,氧化产物和还原产物。
3 氧化还原反应的规律
(1) 守恒规律
HCl 失电子总数 = KClO3 得电子总数
氧化还原反应中,得失电子总数相等,元素化合价升降总数相等,反应前后电荷总数相等(离子反应)。
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
3 氧化还原反应的规律
(3) 价态规律
Cl2 既有氧化性又有还原性
元素处在最高价态时只有氧化性,元素处在最低价态时只有还原性,元素处在中间价态时既有氧化性又有还原性。
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
3 氧化还原反应的规律
(4) 归中规律
同种元素不同价态之间发生氧化还原反应,元素的化合价“只向中间靠拢不出现交叉”。
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
+5 -1 0
3 氧化还原反应的规律
(4) 归中规律
正确
错误
3 氧化还原反应的规律
(5) 先后规律
同一氧化剂与多种还原剂混合,还原性强的先被氧化;
同一还原剂与多种氧化剂混合,氧化性强的先被还原。
Cl2 通入与 FeBr2 溶液中, Cl2 先与 Fe2+ 反应,再与 Br- 反应
[环节4]课堂小结,联系生活
合成氨
合成盐酸
接触法制硫酸
氨氧化法制硝酸
食盐水电解制烧碱
4NH3 + 5O2 ====== 4NO + 6H2O
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
△
催化剂
课后作业
请同学们通过报纸、杂志、书籍或互联网等,查阅有关氧化还原反应在日常生活、工农业生产和科学技术中应用的几个具体事例,讨论并交流你对氧化还原反应规律的认识。
1. 完成教材P39:8、9、10。
2. 完成课后同步课时检测题。
3. 完成单元测试题.
下课,同学们再见!
1.3.1 氧化还原反应
[环节1]创设情境,引入新课
空气中久置
[环节1]创设情境,引入新课
煤气燃烧
电池放电
金属的冶炼与锈蚀
[环节2]问题驱动,宏观辨识
CaO + H2O = Ca(OH)2
2KClO3 == 2KCl + 3O2↑
Fe + CuSO4 = Cu + FeSO4
HCl + NaOH = NaCl + H2O
(化合反应)
(置换反应)
(分解反应)
(复分解反应)
△
Fe2O3 + 3CO == 2Fe + 3CO2
高温
1 认识氧化还原反应
(1) 从得失氧的角度认识
CuO + H2 = Cu + H2O
△
H2 得到氧,被氧化,发生氧化反应
CuO 失去氧,被还原,发生还原反应
有氧得失的反应就是氧化还原反应
1 认识氧化还原反应
(2) 从化合价的角度认识
CuO + H2 = Cu + H2O
△
+2 0 0 +1
0 0 +1 -1
0 0 +1 -1
2Na + Cl2 == 2NaCl
H2 + Cl2 == 2HCl
点燃
点燃
1 认识氧化还原反应
(2) 从化合价的角度认识
CuO + H2 = Cu + H2O
△
+2 0 0 +1
化合价升高,被氧化,发生氧化反应
化合价降低,被还原,发生还原反应
有化合价变化的反应就是氧化还原反应
1 认识氧化还原反应
(2) 从化合价的角度认识
Fe + CuSO4 = FeSO4 + Cu
CaO + H2O =Ca(OH)2
有化合价变化的反应就是氧化还原反应
氧化还原反应
非氧化还原反应
(判断依据)
0 +2 +2 0
1 认识氧化还原反应
(3) 从电子转移的角度认识
有电子转移的反应就是氧化还原反应
(本质)
失去电子或共用电子对偏离
得到电子或共用电子对偏向
化合价升高
被氧化
氧化反应
化合价降低
被还原
还原反应
2 氧化还原反应的表示方法
(1) 双线桥法
2Na + Cl2 == 2NaCl
点燃
失去 2×e- ,化合价升高,被氧化
得到 2×e- ,化合价降低,被还原
0 0 +1 -1
2 氧化还原反应的表示方法
(2) 单线桥法
2Na + Cl2 == 2NaCl
点燃
2e-
在反应物中,画出由失去电子的元素指向得到电子的元素的线桥,
并在线桥上写出转移电子总数。
[环节4]构建模型,深化认知
Fe+CuCl2 = FeCl2+Cu
Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O
Na2O+H2O = 2NaOH
2Mg+O2 == 2MgO
NH4HCO3==NH3↑+CO2↑+H2O
2H2O2 == 2H2O+O2↑
点燃
△
置换反应,氧化还原反应
复分解反应,非氧化还原反应
化合反应,非氧化还原反应
化合反应,氧化还原反应
分解反应,非氧化还原反应
分解反应,氧化还原反应
MnO2
3 氧化还原反应和四大基本反应的关系
非氧化还原反应
氧化还原反应
复分解
反应
化合 反应
置换
反应
分解 反应
[环节5]应用新知,联系实际
S + 2KNO3 + 3C = K2S + N2↑+ 3CO2↑
[环节5]应用新知,联系实际
N2H4+O2 == N2+2H2O
点燃
CO+NO === N2+CO2
催化剂
课后作业
请同学们通过报纸、杂志、书籍或互联网等,查阅有关氧化还原反应在日常生活、工农业生产和科学技术中应用的几个具体事例,讨论并交流你对氧化还原反应的认识。
1. 完成教材P38:1、4、5、6。
2. 完成课后同步课时检测题。
3. 预习氧化剂和还原剂部分知识。
1.3.2 氧化剂和还原剂
[环节1]复习旧知,引入新课
氧化还原反应的特征:
氧化还原反应实质:
2Na + Cl2 == 2NaCl
点燃
失去 2×e- ,化合价升高,被氧化
得到 2×e- ,化合价降低,被还原
0 0 +1 -1
电子的转移(电子得失或电子对的转移)
化合价的升降
[环节2]问题驱动,建立模型
CuO + H2 == Cu + H2O
2e-
氧化剂
还原剂
还原产物
氧化产物
氧化性
还原性
1 氧化剂与还原剂
(1) 概念
氧化剂:得到电子(或电子对偏向)的物质
还原剂:失去电子(或电子对偏离)的物质
氧化产物:还原剂被氧化,对应生成氧化产物
还原产物:氧化剂被还原,对应生成还原产物
1 氧化剂与还原剂
(2) 关联
1 氧化剂与还原剂
判断下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物
2Na + Cl2 == 2NaCl
点燃
2H2O == 2H2 ↑ + O2↑
通电
Zn + H2SO4 == ZnSO4 + H2↑
2KClO3 == 2KCl+3O2↑
△
MnO2
1 氧化剂与还原剂
(3) 常见的氧化剂
① 活泼非金属单质。如 F2、Cl2、Br2、O2 等。
② 元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐。
如 MnO2、NO2、浓H2SO4、 HNO3、KMnO4、KClO3、FeCl3 等。
③ 过氧化物。如Na2O2,H2O2等。
1 氧化剂与还原剂
(4) 常见的还原剂
① 金属单质,如 Na,K,Zn,Fe 等。
② 某些非金属单质,如 H2,C,Si等。
③ 元素处于低化合价时的氧化物,如 CO,SO2 等。
④ 元素处于低化合价时的酸,如 HCl (浓),HBr,HI,H2S 等。
⑤ 元素处于低化合价时的盐,如 Na2SO3,FeSO4 等。
2 氧化性与还原性的强弱比较
(1) 根据氧化还原反应方程式比较
Zn + H2SO4 == ZnSO4 + H2↑
氧化性:Fe > Cu
还原性:CuSO4 > FeSO4
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
2 氧化性与还原性的强弱比较
(2) 根据元素的活动性顺序比较
2 氧化性与还原性的强弱比较
(3) 根据反应条件和反应的剧烈程度比较
2Na + 2H2O (冷水) = 2NaOH + H2↑
Mg + 2H2O (热水) = Mg(OH)2 + H2↑
3Fe + 4H2O (g) = Fe3O4 + 4H2
高温
还原性:Na > Mg > Fe
2 氧化性与还原性的强弱比较
(4) 根据氧化性还原反应的程度比较
相同条件下:
不同氧化剂作用于同一种还原剂,氧化产物价态高的氧化性强。
不同还原剂作用于同一种氧化剂,还原产物价态低的还原性强。
2Fe + 3Cl2 = 2FeCl3
点燃
Fe + S = FeS
研磨
[环节3]深入探究,强化认知
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
用双线桥法分析下列氧化还原反应,找出氧化剂和还原剂,氧化产物和还原产物。
3 氧化还原反应的规律
(1) 守恒规律
HCl 失电子总数 = KClO3 得电子总数
氧化还原反应中,得失电子总数相等,元素化合价升降总数相等,反应前后电荷总数相等(离子反应)。
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
3 氧化还原反应的规律
(3) 价态规律
Cl2 既有氧化性又有还原性
元素处在最高价态时只有氧化性,元素处在最低价态时只有还原性,元素处在中间价态时既有氧化性又有还原性。
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
3 氧化还原反应的规律
(4) 归中规律
同种元素不同价态之间发生氧化还原反应,元素的化合价“只向中间靠拢不出现交叉”。
KClO3 + 6HCl(浓) == 3Cl2↑+ KCl + 3H2O
△
+5 -1 0
3 氧化还原反应的规律
(4) 归中规律
正确
错误
3 氧化还原反应的规律
(5) 先后规律
同一氧化剂与多种还原剂混合,还原性强的先被氧化;
同一还原剂与多种氧化剂混合,氧化性强的先被还原。
Cl2 通入与 FeBr2 溶液中, Cl2 先与 Fe2+ 反应,再与 Br- 反应
[环节4]课堂小结,联系生活
合成氨
合成盐酸
接触法制硫酸
氨氧化法制硝酸
食盐水电解制烧碱
4NH3 + 5O2 ====== 4NO + 6H2O
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
△
催化剂
课后作业
请同学们通过报纸、杂志、书籍或互联网等,查阅有关氧化还原反应在日常生活、工农业生产和科学技术中应用的几个具体事例,讨论并交流你对氧化还原反应规律的认识。
1. 完成教材P39:8、9、10。
2. 完成课后同步课时检测题。
3. 完成单元测试题.
下课,同学们再见!
