2022-2023学年鲁科版(2019)高中化学 必修二 2.1.1化学键与离子键 (共27张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版(2019)高中化学 必修二 2.1.1化学键与离子键 (共27张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 15:46:45 | ||
图片预览








文档简介
(共27张PPT)
思考:
1.视频中出现碳纤维图片碳原子与碳原子之间的“连接线”表示什么?
2.选择氢能源作为冬奥会火炬燃料,在H2燃烧的过程中为什么会发光发热?
鲁科版高中化学 必修2
第二单元
1.1 化学键与离子键
学习目标
问题1:加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
任务一:化学键
【 交流·研讨1】
(课本P41)请同学们独立思考回答以下问题。
水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
问题2:加热至2200℃以上时,水会部分分解。在这一过程中,外界提供的能量的作用是什么?
问题3:为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
水分子内H和O之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
水分子内氢氧原子之间存在相互作用比水分子间作用力更强
任务一:化学键
【 交流·研讨2】
水分子内氢氧原子之间存在比水分子间作用力“更强的相互作用”
这种“更强的相互作用”到底有多强?
怎样操作水分子才能最大限度分解为氢气和氧气?
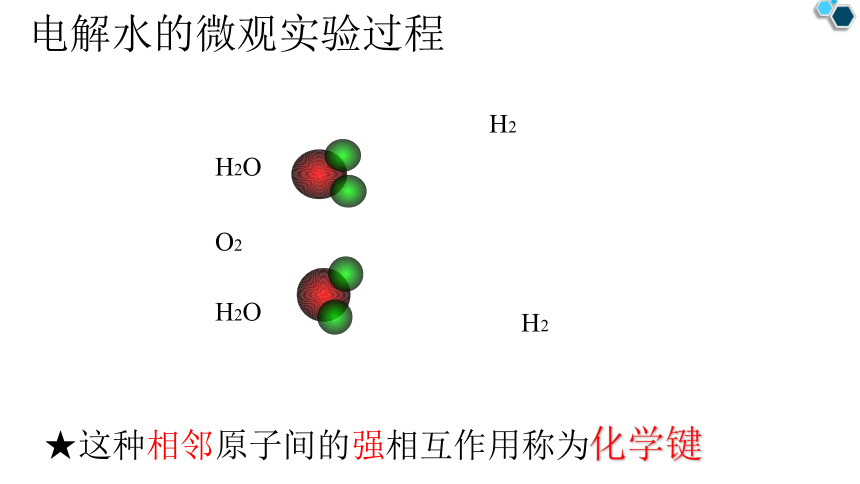
通电
H2O
H2O
H2
H2
O2
★这种相邻原子间的强相互作用称为化学键
电解水的微观实验过程
定义:
相邻原子之间的强相互作用称为化学键
注意:
(1)首先必须是直接相邻的原子(广义原子)
(2)强烈的相互作用
(3)相互作用既包括静电吸引也包括静电排斥
H2O
H2O
H2
O2
通 电
任务一:化学键
Na+
Cl-
评价1:
例1 下列关于化学键的说法中正确的是
①相邻原子间的相互作用叫做化学键
②化学键既存在于相邻原子间,又存在于相邻分子间,所有物质均有化学键
③在水中氢、氧原子间均以化学键相结合
④相邻原子之间强烈的相互吸引作用叫做化学键
⑤化学键是指相邻原子间的强相互作用
A.②③④ B.③④⑤ C.①②③ D.只有⑤
√
易错警示
(1)形成化学键的原子必须相邻,但相邻的原子间不一定存在化学键。
(2)“强相互作用”不能只理解为相互吸引。
(3)并非所有的物质中都有化学键,如稀有气体是单原子分子,无化学键。
化学反应 断裂的化学键 形成的化学键
2H2+02 2H2O
H2+Cl2 2HCl
N2+3H2 2NH3
点燃
点燃
高温,高压
催化剂
评价2:
断裂:氢氧键
形成:氢氢键
形成:氧氧键
2H2O 2H2 + 02
通电
氢氢键
氧氧键
氢氧键
氢氢键
氯氯键
氢氯键
氮氮键
氢氢键
氮氢键
思考:根据分析化学反应的实质是什么?
【小结1】:
化学反应的实质:
宏观上:有新物质生成
微观上:
吸收能量
释放能量
旧化学键的断裂和新化学键的形成。
例2:下列过程中化学键被破坏,但不属于化学变化的是
A.NaOH受热熔化 B.Na2O溶解于水
C.葡萄糖溶于水 D.O2在放电的条件下转化为O3
E.干冰升华 F.食盐溶液提取氯化钠晶体
√
拓展提升:
1.视频中出现碳纤维图片碳原子与碳原子之间的“连接线”表示什么?
2.选择氢能源作为冬奥会火炬燃料,在H2燃烧的过程中为什么会发光发热?
化学键
旧化学键的断裂吸收能量
新化学键的形成释放能量
释放大于吸收,以光能和热能表现出来
丰富多彩的物质
118种元素
化学键
固态氯化钠含有阴阳离子它导电吗?为什么?
不能,有离子不自由移动,因为化学键的束缚!
那么氯化钠中的化学键是怎么形成的?
问题1:在元素周期变中找出钠和氯元素位置?
问题2:画出钠和氯的原子结构并通过得失电子角度分析NaCl的形成。
任务二:离子键
【 交流·研讨1】
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失 e-
得 e-
Na+
Cl-
电子式
11
2
1
+
8
17
2
7
+
8
×
Na
Cl
··
··
··
·
Na
Cl
电子式
一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
电子式表示形成过程
NaCl的形成过程:
+
→
得失电子
Na×
··
··
··
·
Cl
Na+
Cl
··
··
··
·
×
[ ]-
任务二:离子键
1.定义:
阴、阳离子通过静电作用而形成的化学键。
2.成键三要素
①成键微粒:_______________。
②成键本质:静电作用(包括静电引力和静电斥力)。
③成键元素:一般是_________元素与___________元素。特例:铵盐
阳离子和阴离子
活泼金属
活泼非金属
3、用电子式表示形成过程
【拓展提升】--电子式
在元素符号周围用小黑点 · (或×)来表示原子的最外层电子的式子
(1)原子的电子式
H
O
Cl
Mg
Na
(2)简单离子的电子式
一般用 表示
R
n-
直接用离子符号
简单阳离子
简单阴离子
Cl
Na
在元素符号四个方向逐一放置电子
O
2
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
(3)含有离子键化合物
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
AB型
A2B型
AB2型
Mg
2
O
2-
请尝试用电子式
表示MgCl2形成过程
(4)用电子式表示由原子形成离子化合物的过程
Mg
2
Br
Br
S
K
K
Br
Mg
Br
S
2-
K
K
书写要点
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
当堂达标
1.下列过程不会破坏化学键的是( )
A. 乙醇溶于水 B. 氯化氢溶于水
C. 氧化钾熔化 D. 氯化钠熔化
2.某物质的水溶液能导电,且该物质属于非电解质,则溶于水时化学键被破坏的是( )
A. 乙醇 B. 干冰
C. 蔗糖 D. 硫酸钠
√
√
能力提升
下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后形成离子键
D
课堂小结
今天你收获了什么?
电化二元学说
离子键
甲烷的四面体假说
共价键电子对理论
人类对于化学键的探索
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(美国)
课后作业
枣庄八中东校 高一化学
基础必做 :笔记整理+同步练习册
预习作业 :共价键
思考:
1.视频中出现碳纤维图片碳原子与碳原子之间的“连接线”表示什么?
2.选择氢能源作为冬奥会火炬燃料,在H2燃烧的过程中为什么会发光发热?
鲁科版高中化学 必修2
第二单元
1.1 化学键与离子键
学习目标
问题1:加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
任务一:化学键
【 交流·研讨1】
(课本P41)请同学们独立思考回答以下问题。
水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
问题2:加热至2200℃以上时,水会部分分解。在这一过程中,外界提供的能量的作用是什么?
问题3:为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
水分子内H和O之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
水分子内氢氧原子之间存在相互作用比水分子间作用力更强
任务一:化学键
【 交流·研讨2】
水分子内氢氧原子之间存在比水分子间作用力“更强的相互作用”
这种“更强的相互作用”到底有多强?
怎样操作水分子才能最大限度分解为氢气和氧气?
通电
H2O
H2O
H2
H2
O2
★这种相邻原子间的强相互作用称为化学键
电解水的微观实验过程
定义:
相邻原子之间的强相互作用称为化学键
注意:
(1)首先必须是直接相邻的原子(广义原子)
(2)强烈的相互作用
(3)相互作用既包括静电吸引也包括静电排斥
H2O
H2O
H2
O2
通 电
任务一:化学键
Na+
Cl-
评价1:
例1 下列关于化学键的说法中正确的是
①相邻原子间的相互作用叫做化学键
②化学键既存在于相邻原子间,又存在于相邻分子间,所有物质均有化学键
③在水中氢、氧原子间均以化学键相结合
④相邻原子之间强烈的相互吸引作用叫做化学键
⑤化学键是指相邻原子间的强相互作用
A.②③④ B.③④⑤ C.①②③ D.只有⑤
√
易错警示
(1)形成化学键的原子必须相邻,但相邻的原子间不一定存在化学键。
(2)“强相互作用”不能只理解为相互吸引。
(3)并非所有的物质中都有化学键,如稀有气体是单原子分子,无化学键。
化学反应 断裂的化学键 形成的化学键
2H2+02 2H2O
H2+Cl2 2HCl
N2+3H2 2NH3
点燃
点燃
高温,高压
催化剂
评价2:
断裂:氢氧键
形成:氢氢键
形成:氧氧键
2H2O 2H2 + 02
通电
氢氢键
氧氧键
氢氧键
氢氢键
氯氯键
氢氯键
氮氮键
氢氢键
氮氢键
思考:根据分析化学反应的实质是什么?
【小结1】:
化学反应的实质:
宏观上:有新物质生成
微观上:
吸收能量
释放能量
旧化学键的断裂和新化学键的形成。
例2:下列过程中化学键被破坏,但不属于化学变化的是
A.NaOH受热熔化 B.Na2O溶解于水
C.葡萄糖溶于水 D.O2在放电的条件下转化为O3
E.干冰升华 F.食盐溶液提取氯化钠晶体
√
拓展提升:
1.视频中出现碳纤维图片碳原子与碳原子之间的“连接线”表示什么?
2.选择氢能源作为冬奥会火炬燃料,在H2燃烧的过程中为什么会发光发热?
化学键
旧化学键的断裂吸收能量
新化学键的形成释放能量
释放大于吸收,以光能和热能表现出来
丰富多彩的物质
118种元素
化学键
固态氯化钠含有阴阳离子它导电吗?为什么?
不能,有离子不自由移动,因为化学键的束缚!
那么氯化钠中的化学键是怎么形成的?
问题1:在元素周期变中找出钠和氯元素位置?
问题2:画出钠和氯的原子结构并通过得失电子角度分析NaCl的形成。
任务二:离子键
【 交流·研讨1】
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失 e-
得 e-
Na+
Cl-
电子式
11
2
1
+
8
17
2
7
+
8
×
Na
Cl
··
··
··
·
Na
Cl
电子式
一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
电子式表示形成过程
NaCl的形成过程:
+
→
得失电子
Na×
··
··
··
·
Cl
Na+
Cl
··
··
··
·
×
[ ]-
任务二:离子键
1.定义:
阴、阳离子通过静电作用而形成的化学键。
2.成键三要素
①成键微粒:_______________。
②成键本质:静电作用(包括静电引力和静电斥力)。
③成键元素:一般是_________元素与___________元素。特例:铵盐
阳离子和阴离子
活泼金属
活泼非金属
3、用电子式表示形成过程
【拓展提升】--电子式
在元素符号周围用小黑点 · (或×)来表示原子的最外层电子的式子
(1)原子的电子式
H
O
Cl
Mg
Na
(2)简单离子的电子式
一般用 表示
R
n-
直接用离子符号
简单阳离子
简单阴离子
Cl
Na
在元素符号四个方向逐一放置电子
O
2
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
(3)含有离子键化合物
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
AB型
A2B型
AB2型
Mg
2
O
2-
请尝试用电子式
表示MgCl2形成过程
(4)用电子式表示由原子形成离子化合物的过程
Mg
2
Br
Br
S
K
K
Br
Mg
Br
S
2-
K
K
书写要点
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
当堂达标
1.下列过程不会破坏化学键的是( )
A. 乙醇溶于水 B. 氯化氢溶于水
C. 氧化钾熔化 D. 氯化钠熔化
2.某物质的水溶液能导电,且该物质属于非电解质,则溶于水时化学键被破坏的是( )
A. 乙醇 B. 干冰
C. 蔗糖 D. 硫酸钠
√
√
能力提升
下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后形成离子键
D
课堂小结
今天你收获了什么?
电化二元学说
离子键
甲烷的四面体假说
共价键电子对理论
人类对于化学键的探索
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(美国)
课后作业
枣庄八中东校 高一化学
基础必做 :笔记整理+同步练习册
预习作业 :共价键
