2022-2023学年人教版(2019)高中化学 选择性必修一 4.2.1 电解池(共26张PPT)
文档属性
| 名称 | 2022-2023学年人教版(2019)高中化学 选择性必修一 4.2.1 电解池(共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-01 16:08:21 | ||
图片预览







文档简介
(共26张PPT)
第1课时 电解的原理
电解池
1.通过实验探究知道电解池装置的基本构造,能够从电极名称、电极反应、能量转化等方面理解电解池的原理,会正确书写电解池的电极反应式和总反应式;
2.通过实验探究建构电解池模型,培养学生观察、分析、推理、归纳等能力,学会运用“宏观-微观-符号”三重表征来解决问题;
3.通过实验探究和化学家戴维的介绍,培养学生对化学的学习热情和求知欲,感受科学家的精神品质,培养科学精神与社会责任意识。
学习目标
前置作业
下图是水的电解实验,回答下列问题:
1. 在右图的方框内标出电源的正、负极,并书写该反应化学方程式。
2.书写水的电离方程式,并思考未通电前纯水中有哪些离子?如何运动?
3.在接通电源时,纯水中的离子如何运动?为什么会发生这样的运动?通电后水的电离平衡是否被破坏?
4. 根据氧化还原反应的知识,H2是怎么产生的?O2又是如何产生的?H2与O2的电极上分别发生了什么反应?
5.用能量转化的观点思考,电解水这一过程中存在哪种能量转化?
-
+
概括归理一:通电可以使水电离出的H+和OH-定向移动两极,发生还原反应和氧化反应,将电能转化为化学能。
每课一题
下图中哪一个是原电池装置?图A装置与图B装置有何区别?
A
B
原电池
图B中存在外加直流电源
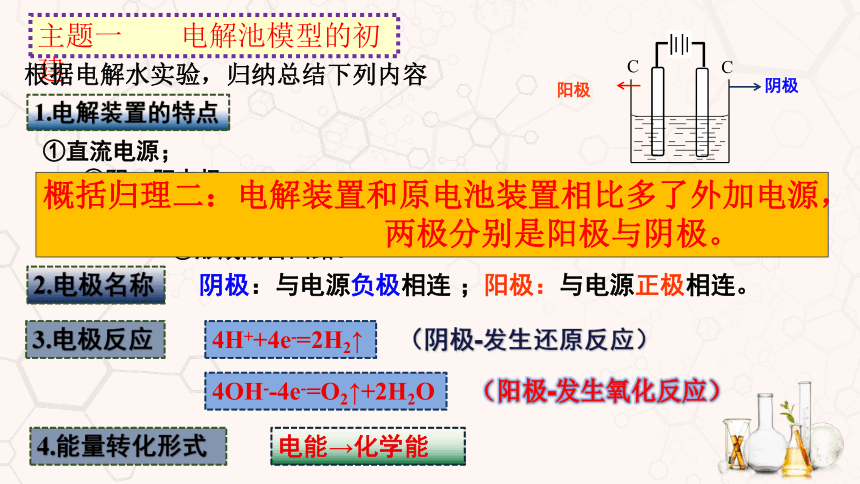
主题一 电解池模型的初建
根据电解水实验,归纳总结下列内容
1.电解装置的特点
①直流电源;
②阴、阳电极;
C
C
阳极
阴极
③电极插入电解质溶液;
④形成闭合回路。
2.电极名称
阴极:与电源负极相连 ;阳极:与电源正极相连。
3.电极反应
4H++4e-=2H2↑
(阴极-发生还原反应)
4OH--4e-=O2↑+2H2O
(阳极-发生氧化反应)
4.能量转化形式
电能→化学能
概括归理二:电解装置和原电池装置相比多了外加电源,
两极分别是阳极与阴极。
主题二 电解池模型的完善
英国化学家戴维最初想法是水通电可以分解为氢气和氧气,那物质的水溶液通电又会怎样呢?
提出问题
英国化学家戴维
【思考与交流】
问题4 CuCl2溶液通电后的产物该如何检验?
问题3 类比迁移电解水的实验现象,预测CuCl2溶液通电后在两极有什么物质生成?分别发生了什么反应?写出电极反应式。
问题1 书写氯化铜的电离方程式,思考未通电前CuCl2溶液中含有哪些离子 运动情况如何?
问题2 在接通电源时,CuCl2溶液中含有的离子如何运动?
CuCl2=Cu2++Cl-
Cu2+、H+移向阴极,Cl-、OH-移向阳极。
阴极:Cu2+ + 2e = Cu
(还原反应)
阳极:2Cl--2e =Cl2↑
(氧化反应)
产物氯气用湿润淀粉KI试纸检验
【实验探究】
以CuCl2溶液为例,探究电解对CuCl2溶液的作用。
实验步骤:
1.用一次性滴管吸取一定量的氯化铜溶液;
2.将滴管倒置,沿氯化铜溶液面用大头针扎一个小孔,插入石墨电极,同样办法在另一侧插入另一个石墨电极,两根铅笔芯上下距离 约5mm;
3.将两根石墨棒分别跟电池的正极和负极连接;
4.观察现象,用镊子夹住湿润淀粉KI试纸放在滴管尖嘴处,检验生成气体。
实验装置微型化、操作简便、药品用量少,体现绿色化学思想
科学探究与创新意识
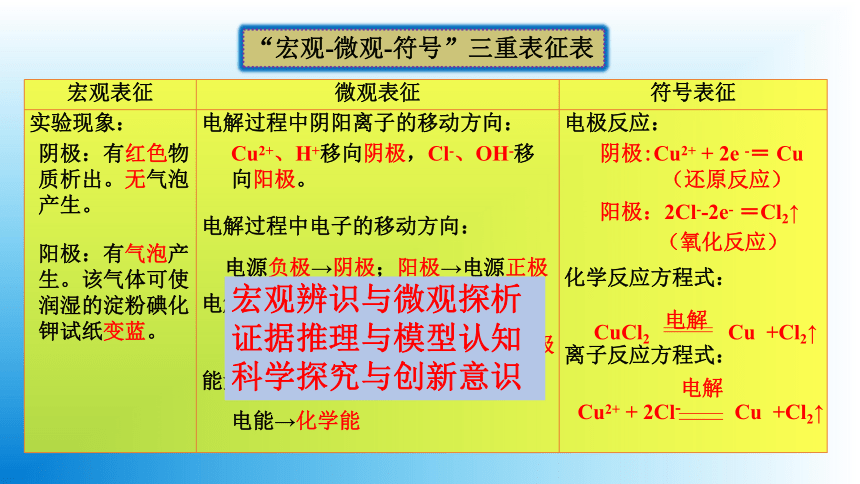
宏观表征 微观表征 符号表征
实验现象: 电解过程中阴阳离子的移动方向: 电解过程中电子的移动方向: 电解过程中电流的流动方向: 能量转化关系: 电极反应:
化学反应方程式:
离子反应方程式:
“宏观-微观-符号”三重表征表
阴极:有红色物质析出。无气泡产生。
阳极:有气泡产生。该气体可使润湿的淀粉碘化钾试纸变蓝。
Cu2+、H+移向阴极,Cl-、OH-移向阳极。
电源负极→阴极;阳极→电源正极
电源正极→阳极;阴极→电源负极
电能→化学能
阴极:Cu2+ + 2e -= Cu
(还原反应)
阳极:2Cl--2e- =Cl2↑
(氧化反应)
CuCl2
电解
Cu +Cl2↑
Cu2+ + 2Cl-
电解
Cu +Cl2↑
宏观辨识与微观探析
证据推理与模型认知
科学探究与创新意识
【归纳总结】
1.电解:
使直流电通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
2.电解池:
电能转变为化学能的装置。
3.电解池装置图:
概括归理三:电解是将电能转化化学能,通过阴阳两极发生的氧化还原反应实现物质转化的重要途径之一。
能量观
转化观
归纳总结:构建电解的原理模型
e-
e-
阴极
阳极
化合升高
阳极氧化
阴极还原
氧化产物
阳离子(氧化性)
阴离子(还原性)
还原剂
失电子
还原产物
氧化剂
得电子
化合降低
装置要素
失电子场所
(阳极材料)
离子导体
(电解质)
电子导体
(导线)
得电子场所
(阴极材料)
反应微粒
生成微粒
电子流向
得失电子
微粒后续反应
原理要素
e-
e-
宏观辨识
微观探析
证据推理
模型认知
主题三 应用电解池模型解决电解问题
【科学史话】戴维时代人们认为从草木灰中提取出来的碳酸钾是一种元素,但戴维不迷信前人的结论,他想通过电解法使其分解。戴维实验了几十次,结果在两极得到了两种气体,经分析是水电解产生的氢气和氧气,而碳酸钾本身并没有变化。到底如何能得到金属钾呢?
【思考与交流】
问题5 电解CuCl2水溶液时,阳极为什么不产生O2,阴极为什么不产生H2?
说明:得失电子的能力不同
放电
能力
失电子能力:
得电子能力:
Cl->OH-
Cu2+>H+
放电
次序
阴离子失去电子,阳离子得到电子的过程叫放电。
问题6 按照电解CuCl2水溶液的现象进行猜测推理,电解碳酸钾溶液阴极应该产生金属钾,但事实却是相当于电解水呢,为什么呢?
问题7 联系金属活动性顺序表,金属单质的还原性越强,对应金属阳离子的氧化性有何规律?非金属单质的氧化性越强,对应阴离子的还原性有何规律?
概括归理四:用“氧化还原理论”突破电解池的阴、阳离子放电规律
失电子能力:OH->CO32-
得电子能力:H+>K+
金属单质的还原性越强,对应金属阳离子的氧化性越弱
非金属单质的氧化性越强,对应阴离子的还原性越弱
【归纳总结】
离子放电顺序规律:
阴极:氧化性强的离子先得电子
Ag+>Hg2+>Fe3+>Cu2+>H+
>Pb2+ > Sn2+ +>Fe2+>Zn2+ 浓度大时先于 H+放电
>H+ > Al3+>Mg2+>Na+>Ca2+>K+ 水中H+先放电
阳极:还原性强的离子先失电子
活性阳极先放电,离子后放电。
S2->I->Br->Cl->OH->含氧酸根>F-
活性金属电极(除Pt、Au外)>
概括归理五:离子放电顺序遵循“谁强谁放电”
问题8 预测电解NaCl水溶液的产物是什么?如何检测这些电解产物?写出电极反应式和总反应式。
预测电解NaCl水溶液阳极产物为Cl2,阴极产物为H2和NaOH。
Cl用湿润的淀粉KI试纸检验,淀粉KI试纸变蓝证明产生Cl2,NaOH用酚酞试液检验,试液变红证明产生NaOH。
电极反应:阴极:2H2O+ 2e- =H2↑+2OH-(还原反应)
阳极:2Cl--2e- =Cl2↑ (氧化反应)
化学反应方程式:2NaCl+2H2O==2NaOH+H2↑+Cl2
电解
概括归理六:电极反应式书写遵循“原子守恒、电荷守恒、电子守恒”
【实验探究】
以NaCl溶液为例,探究电解对NaCl溶液的作用。
实验步骤:
1.在表面皿中放一片滤纸,用NaCl溶液润湿滤纸;
2.将两根石墨电极分别用导线连在电源的正负极上,并按图所示树立在滤纸上;
3.大约30秒后,在阴极附近滤纸上滴加2~3滴酚酞试液,观察现象,在阳极附近放湿润的淀粉碘化钾试纸,观察现象。
2~3滴酚酞试液
石墨
石墨
用饱和氯化钠浸湿的滤纸
湿润的淀粉KI试纸
实验操作简便、药品用量少,体现绿色化学思想
宏观表征 微观表征 符号表征
实验现象: 电解过程中阴阳离子的移动方向: 电解过程中电子的移动方向: 电解过程中电流的流动方向: 能量转化关系: 电极反应:
化学反应方程式:
离子反应方程式:
“宏观-微观-符号”三重表征表
阳极:产生可使湿润淀粉KI试纸变蓝的刺激性气味气体。
阴极:阴极附近的滤纸滴加2~3酚酞试液,滤纸变红。
Na+、H+移向阴极,Cl-、OH-移向阳极。
电源正极→阳极;
阴极→电源负极
电能→化学能
阴极:2H2O+ 2e- =H2↑+2OH-
(还原反应)
阳极:2Cl--2e- =Cl2↑
(氧化反应)
2NaCl+2H2O==2NaOH+H2↑+Cl2↑
电解
电源负极→阴极;阳极→电源正极
2Cl-+2H2O==H2↑+Cl2↑+2OH-
电解
宏观辨识与微观探析
证据推理与模型认知
科学探究与创新意识
分析电解反应的一般思路
明确阳极材料
根据阳极氧化,阴极还原分析得出产物
阴阳两极附近各有哪些离子
由阴阳两电极反应式,分析溶液中微粒的变化
(弱电解质须保持分子形式)
【归纳总结】
证据推理
模型认知
问题9 利用电解CuCl 2溶液的装置电解氯化钠溶液得不到金属 Na,那么戴维应该如何从 NaCl中成功制取了Na?
制取金属钠
电解熔融状态的氯化钠
阳极:
2Cl - -2e- == Cl2↑
阴极:
2Na+ + 2e- == 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
电解:使直流电通过电解质溶液(或熔融电解质)而在阴、阳两极引起氧化还原反应的过程叫做电解。
完善电解概念
【科学史话】戴维最后通过电解熔融的氢氧化钾得到了金属钾。他创立的最强大的氧化还原手段——电解法,使数千年都没有被发现的活泼金属从其熔融液中还原出来,受戴维的启发,在电解法出现后的44年间科学家发现了31种 新元素。电解的方法到今天依然具有重要的应用价值。
概括归理七:冶炼钾、钙、钠、镁、铝等活泼的金属时,需要使用电解法这种最强有力的氧化还原手段!
我的那些最重要的发现是受到失败的启示而作出的。
——无机化学之父戴维
电解池的应用
污水处理
电镀
粗铜精炼
氯碱工业
2019年大连化学物理研究所韩洪宪研究员和李灿院士团队研发出廉价电催化剂,能用8千小时,并有望在大规模可再生能源制氢技术中应用。
科技兴则民族兴,科技强则国家强
科技是国家强盛之基,创新是民族进步之魂
H2O的电解
CuCl2(aq)的电解
电解是外加电源下的非自发氧化还原反应
个别
一般
阳离子
阴极(还原反应)
阴离子
阳极(氧化反应)
电能→化学能
转化观
微粒观
能量观
推理与验证
思维方法
认识层面
认识角度
认识水平
微粒转化
物质转化
能量转化
化学观念
类比与迁移
分析与归纳
宏观辨识
微观探析
证据推理
模型认知
科学探究
创新意识
科学态度社会责任
课堂小结
“宏观-微观-符号“三重表征
【课后作业】
1.查阅关于电解水制氢的科普文献,写一篇科普小论文。
2.完成学案的巩固练习。
谢谢!
1.关于原电池、电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
【当堂检测】
第1课时 电解的原理
电解池
1.通过实验探究知道电解池装置的基本构造,能够从电极名称、电极反应、能量转化等方面理解电解池的原理,会正确书写电解池的电极反应式和总反应式;
2.通过实验探究建构电解池模型,培养学生观察、分析、推理、归纳等能力,学会运用“宏观-微观-符号”三重表征来解决问题;
3.通过实验探究和化学家戴维的介绍,培养学生对化学的学习热情和求知欲,感受科学家的精神品质,培养科学精神与社会责任意识。
学习目标
前置作业
下图是水的电解实验,回答下列问题:
1. 在右图的方框内标出电源的正、负极,并书写该反应化学方程式。
2.书写水的电离方程式,并思考未通电前纯水中有哪些离子?如何运动?
3.在接通电源时,纯水中的离子如何运动?为什么会发生这样的运动?通电后水的电离平衡是否被破坏?
4. 根据氧化还原反应的知识,H2是怎么产生的?O2又是如何产生的?H2与O2的电极上分别发生了什么反应?
5.用能量转化的观点思考,电解水这一过程中存在哪种能量转化?
-
+
概括归理一:通电可以使水电离出的H+和OH-定向移动两极,发生还原反应和氧化反应,将电能转化为化学能。
每课一题
下图中哪一个是原电池装置?图A装置与图B装置有何区别?
A
B
原电池
图B中存在外加直流电源
主题一 电解池模型的初建
根据电解水实验,归纳总结下列内容
1.电解装置的特点
①直流电源;
②阴、阳电极;
C
C
阳极
阴极
③电极插入电解质溶液;
④形成闭合回路。
2.电极名称
阴极:与电源负极相连 ;阳极:与电源正极相连。
3.电极反应
4H++4e-=2H2↑
(阴极-发生还原反应)
4OH--4e-=O2↑+2H2O
(阳极-发生氧化反应)
4.能量转化形式
电能→化学能
概括归理二:电解装置和原电池装置相比多了外加电源,
两极分别是阳极与阴极。
主题二 电解池模型的完善
英国化学家戴维最初想法是水通电可以分解为氢气和氧气,那物质的水溶液通电又会怎样呢?
提出问题
英国化学家戴维
【思考与交流】
问题4 CuCl2溶液通电后的产物该如何检验?
问题3 类比迁移电解水的实验现象,预测CuCl2溶液通电后在两极有什么物质生成?分别发生了什么反应?写出电极反应式。
问题1 书写氯化铜的电离方程式,思考未通电前CuCl2溶液中含有哪些离子 运动情况如何?
问题2 在接通电源时,CuCl2溶液中含有的离子如何运动?
CuCl2=Cu2++Cl-
Cu2+、H+移向阴极,Cl-、OH-移向阳极。
阴极:Cu2+ + 2e = Cu
(还原反应)
阳极:2Cl--2e =Cl2↑
(氧化反应)
产物氯气用湿润淀粉KI试纸检验
【实验探究】
以CuCl2溶液为例,探究电解对CuCl2溶液的作用。
实验步骤:
1.用一次性滴管吸取一定量的氯化铜溶液;
2.将滴管倒置,沿氯化铜溶液面用大头针扎一个小孔,插入石墨电极,同样办法在另一侧插入另一个石墨电极,两根铅笔芯上下距离 约5mm;
3.将两根石墨棒分别跟电池的正极和负极连接;
4.观察现象,用镊子夹住湿润淀粉KI试纸放在滴管尖嘴处,检验生成气体。
实验装置微型化、操作简便、药品用量少,体现绿色化学思想
科学探究与创新意识
宏观表征 微观表征 符号表征
实验现象: 电解过程中阴阳离子的移动方向: 电解过程中电子的移动方向: 电解过程中电流的流动方向: 能量转化关系: 电极反应:
化学反应方程式:
离子反应方程式:
“宏观-微观-符号”三重表征表
阴极:有红色物质析出。无气泡产生。
阳极:有气泡产生。该气体可使润湿的淀粉碘化钾试纸变蓝。
Cu2+、H+移向阴极,Cl-、OH-移向阳极。
电源负极→阴极;阳极→电源正极
电源正极→阳极;阴极→电源负极
电能→化学能
阴极:Cu2+ + 2e -= Cu
(还原反应)
阳极:2Cl--2e- =Cl2↑
(氧化反应)
CuCl2
电解
Cu +Cl2↑
Cu2+ + 2Cl-
电解
Cu +Cl2↑
宏观辨识与微观探析
证据推理与模型认知
科学探究与创新意识
【归纳总结】
1.电解:
使直流电通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
2.电解池:
电能转变为化学能的装置。
3.电解池装置图:
概括归理三:电解是将电能转化化学能,通过阴阳两极发生的氧化还原反应实现物质转化的重要途径之一。
能量观
转化观
归纳总结:构建电解的原理模型
e-
e-
阴极
阳极
化合升高
阳极氧化
阴极还原
氧化产物
阳离子(氧化性)
阴离子(还原性)
还原剂
失电子
还原产物
氧化剂
得电子
化合降低
装置要素
失电子场所
(阳极材料)
离子导体
(电解质)
电子导体
(导线)
得电子场所
(阴极材料)
反应微粒
生成微粒
电子流向
得失电子
微粒后续反应
原理要素
e-
e-
宏观辨识
微观探析
证据推理
模型认知
主题三 应用电解池模型解决电解问题
【科学史话】戴维时代人们认为从草木灰中提取出来的碳酸钾是一种元素,但戴维不迷信前人的结论,他想通过电解法使其分解。戴维实验了几十次,结果在两极得到了两种气体,经分析是水电解产生的氢气和氧气,而碳酸钾本身并没有变化。到底如何能得到金属钾呢?
【思考与交流】
问题5 电解CuCl2水溶液时,阳极为什么不产生O2,阴极为什么不产生H2?
说明:得失电子的能力不同
放电
能力
失电子能力:
得电子能力:
Cl->OH-
Cu2+>H+
放电
次序
阴离子失去电子,阳离子得到电子的过程叫放电。
问题6 按照电解CuCl2水溶液的现象进行猜测推理,电解碳酸钾溶液阴极应该产生金属钾,但事实却是相当于电解水呢,为什么呢?
问题7 联系金属活动性顺序表,金属单质的还原性越强,对应金属阳离子的氧化性有何规律?非金属单质的氧化性越强,对应阴离子的还原性有何规律?
概括归理四:用“氧化还原理论”突破电解池的阴、阳离子放电规律
失电子能力:OH->CO32-
得电子能力:H+>K+
金属单质的还原性越强,对应金属阳离子的氧化性越弱
非金属单质的氧化性越强,对应阴离子的还原性越弱
【归纳总结】
离子放电顺序规律:
阴极:氧化性强的离子先得电子
Ag+>Hg2+>Fe3+>Cu2+>H+
>Pb2+ > Sn2+ +>Fe2+>Zn2+ 浓度大时先于 H+放电
>H+ > Al3+>Mg2+>Na+>Ca2+>K+ 水中H+先放电
阳极:还原性强的离子先失电子
活性阳极先放电,离子后放电。
S2->I->Br->Cl->OH->含氧酸根>F-
活性金属电极(除Pt、Au外)>
概括归理五:离子放电顺序遵循“谁强谁放电”
问题8 预测电解NaCl水溶液的产物是什么?如何检测这些电解产物?写出电极反应式和总反应式。
预测电解NaCl水溶液阳极产物为Cl2,阴极产物为H2和NaOH。
Cl用湿润的淀粉KI试纸检验,淀粉KI试纸变蓝证明产生Cl2,NaOH用酚酞试液检验,试液变红证明产生NaOH。
电极反应:阴极:2H2O+ 2e- =H2↑+2OH-(还原反应)
阳极:2Cl--2e- =Cl2↑ (氧化反应)
化学反应方程式:2NaCl+2H2O==2NaOH+H2↑+Cl2
电解
概括归理六:电极反应式书写遵循“原子守恒、电荷守恒、电子守恒”
【实验探究】
以NaCl溶液为例,探究电解对NaCl溶液的作用。
实验步骤:
1.在表面皿中放一片滤纸,用NaCl溶液润湿滤纸;
2.将两根石墨电极分别用导线连在电源的正负极上,并按图所示树立在滤纸上;
3.大约30秒后,在阴极附近滤纸上滴加2~3滴酚酞试液,观察现象,在阳极附近放湿润的淀粉碘化钾试纸,观察现象。
2~3滴酚酞试液
石墨
石墨
用饱和氯化钠浸湿的滤纸
湿润的淀粉KI试纸
实验操作简便、药品用量少,体现绿色化学思想
宏观表征 微观表征 符号表征
实验现象: 电解过程中阴阳离子的移动方向: 电解过程中电子的移动方向: 电解过程中电流的流动方向: 能量转化关系: 电极反应:
化学反应方程式:
离子反应方程式:
“宏观-微观-符号”三重表征表
阳极:产生可使湿润淀粉KI试纸变蓝的刺激性气味气体。
阴极:阴极附近的滤纸滴加2~3酚酞试液,滤纸变红。
Na+、H+移向阴极,Cl-、OH-移向阳极。
电源正极→阳极;
阴极→电源负极
电能→化学能
阴极:2H2O+ 2e- =H2↑+2OH-
(还原反应)
阳极:2Cl--2e- =Cl2↑
(氧化反应)
2NaCl+2H2O==2NaOH+H2↑+Cl2↑
电解
电源负极→阴极;阳极→电源正极
2Cl-+2H2O==H2↑+Cl2↑+2OH-
电解
宏观辨识与微观探析
证据推理与模型认知
科学探究与创新意识
分析电解反应的一般思路
明确阳极材料
根据阳极氧化,阴极还原分析得出产物
阴阳两极附近各有哪些离子
由阴阳两电极反应式,分析溶液中微粒的变化
(弱电解质须保持分子形式)
【归纳总结】
证据推理
模型认知
问题9 利用电解CuCl 2溶液的装置电解氯化钠溶液得不到金属 Na,那么戴维应该如何从 NaCl中成功制取了Na?
制取金属钠
电解熔融状态的氯化钠
阳极:
2Cl - -2e- == Cl2↑
阴极:
2Na+ + 2e- == 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
电解:使直流电通过电解质溶液(或熔融电解质)而在阴、阳两极引起氧化还原反应的过程叫做电解。
完善电解概念
【科学史话】戴维最后通过电解熔融的氢氧化钾得到了金属钾。他创立的最强大的氧化还原手段——电解法,使数千年都没有被发现的活泼金属从其熔融液中还原出来,受戴维的启发,在电解法出现后的44年间科学家发现了31种 新元素。电解的方法到今天依然具有重要的应用价值。
概括归理七:冶炼钾、钙、钠、镁、铝等活泼的金属时,需要使用电解法这种最强有力的氧化还原手段!
我的那些最重要的发现是受到失败的启示而作出的。
——无机化学之父戴维
电解池的应用
污水处理
电镀
粗铜精炼
氯碱工业
2019年大连化学物理研究所韩洪宪研究员和李灿院士团队研发出廉价电催化剂,能用8千小时,并有望在大规模可再生能源制氢技术中应用。
科技兴则民族兴,科技强则国家强
科技是国家强盛之基,创新是民族进步之魂
H2O的电解
CuCl2(aq)的电解
电解是外加电源下的非自发氧化还原反应
个别
一般
阳离子
阴极(还原反应)
阴离子
阳极(氧化反应)
电能→化学能
转化观
微粒观
能量观
推理与验证
思维方法
认识层面
认识角度
认识水平
微粒转化
物质转化
能量转化
化学观念
类比与迁移
分析与归纳
宏观辨识
微观探析
证据推理
模型认知
科学探究
创新意识
科学态度社会责任
课堂小结
“宏观-微观-符号“三重表征
【课后作业】
1.查阅关于电解水制氢的科普文献,写一篇科普小论文。
2.完成学案的巩固练习。
谢谢!
1.关于原电池、电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
【当堂检测】
