化学人教版(2019)选择性必修3 3.2.1醇的结构与性质(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.2.1醇的结构与性质(共30张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 08:45:55 | ||
图片预览






文档简介
(共30张PPT)
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第二节 醇 酚
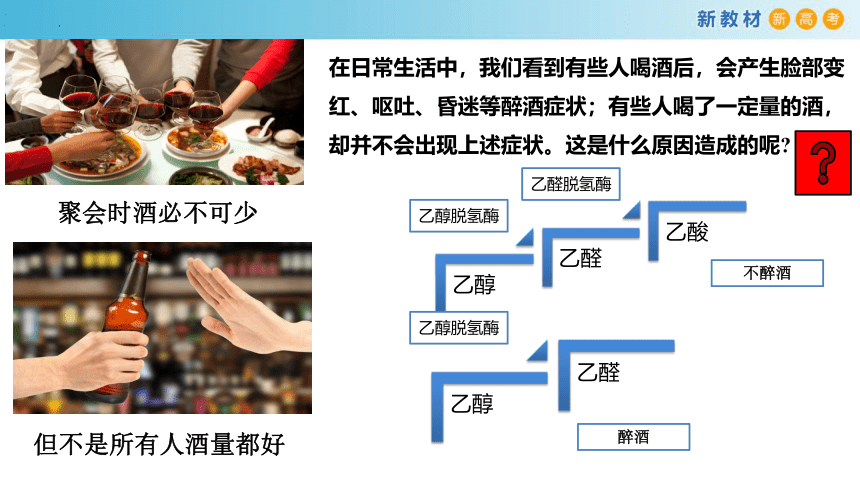
聚会时酒必不可少
但不是所有人酒量都好
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
乙醇脱氢酶
乙醛脱氢酶
不醉酒
乙醇脱氢酶
醉酒
学习
目标
第1课时
醇的结构与性质
PART
01
PART
02
结合醇的代表物了解醇的分类、组成和结构,理解醇的性质,培养“宏观辨别与微观探析”的核心素养
以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。培养“变化观念与证据推理”的核心素养
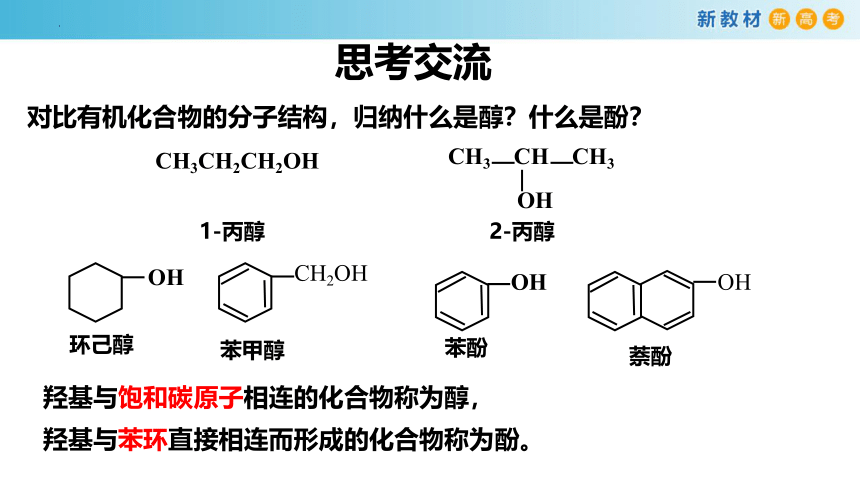
对比有机化合物的分子结构,归纳什么是醇?什么是酚?
1-丙醇 2-丙醇
苯甲醇
CH3CH2CH2OH
CH3 CH CH3
CH2OH
OH
环己醇
OH
OH
苯酚
OH
萘酚
思考交流
羟基与饱和碳原子相连的化合物称为醇,
羟基与苯环直接相连而形成的化合物称为酚。
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
(2)官能团:羟基(—OH)
(3)结构: (R1、R2、R3为H或烃基)
(4)饱和一元醇通式:CnH2n+1OH 或 CnH2n+2O (n≥1),可简写为R—OH。
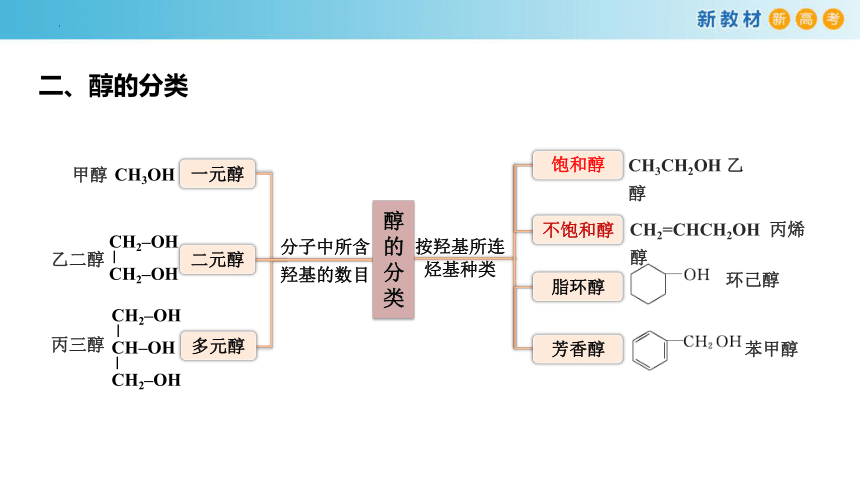
一、醇的结构特点
学习任务一:认识醇
饱和x元醇的通式为:CnH2n+2Ox
注意:羟基如果连在双键碳或三键碳上不稳定,两个羟基不能连在同一个碳上。
按羟基所连
烃基种类
饱和醇
不饱和醇
脂环醇
芳香醇
CH3CH2OH 乙醇
CH2=CHCH2OH 丙烯醇
苯甲醇
环己醇
乙二醇
分子中所含羟基的数目
一元醇
二元醇
多元醇
CH3OH
CH2–OH
CH2–OH
CH2–OH
CH–OH
CH2–OH
甲醇
丙三醇
醇的
分类
二、醇的分类
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
二元醇
CH2CH CH2
OH OHOH
丙三醇(甘油)
吸湿性,护肤
三元醇
一元醇
CH3OH
甲醇
(木精、木醇)
剧毒
用于能源领域如汽车燃料
乙二醇、丙三醇都是无色、粘稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
工业酒精有毒!
汽车防冻剂
配制化妆品
生活中的化学
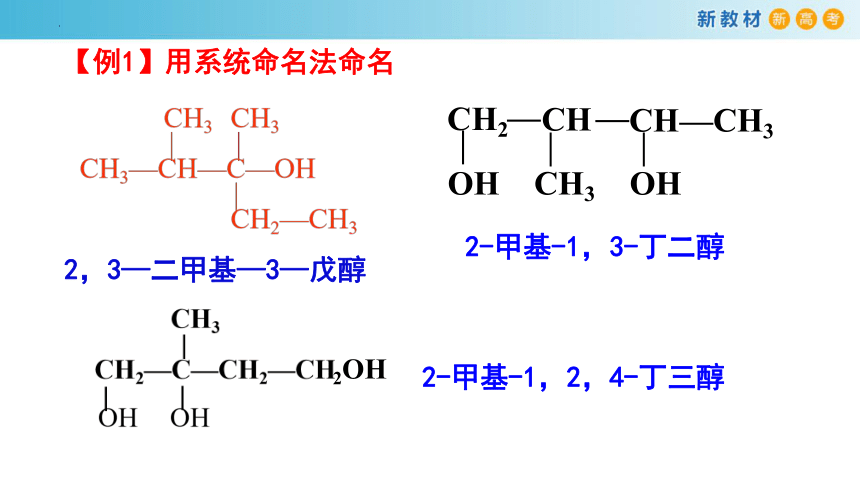
(1)选主链——选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇;
(2)编位次——从距离羟基最近的一端给主链碳原子依次编号;
(3)写名称——用阿拉伯数字标出羟基位次,羟基的个数用“二”“三”等表示。
三、醇的命名
“取代基位号-个数+名称-羟基位号-某醇”
2-甲基-1,3-丁二醇
【例1】用系统命名法命名
2,3—二甲基—3—戊醇
CH2
CH
CH—CH3
OH
OH
CH3
2-甲基-1,2,4-丁三醇
2OH
【思考】对比分析表格中的数据,你能得出什么结论?为什么?
表3-1 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
思考交流
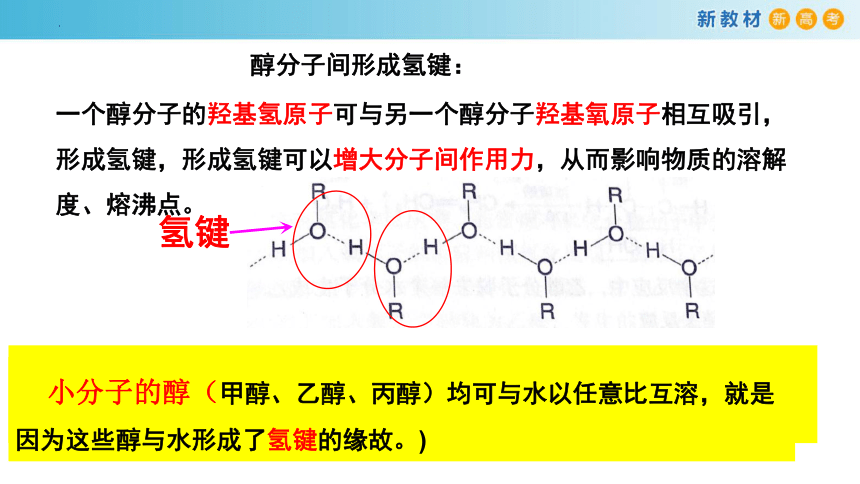
醇分子间形成氢键:
一个醇分子的羟基氢原子可与另一个醇分子羟基氧原子相互吸引,形成氢键,形成氢键可以增大分子间作用力,从而影响物质的溶解度、熔沸点。
结论:相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。)
氢键
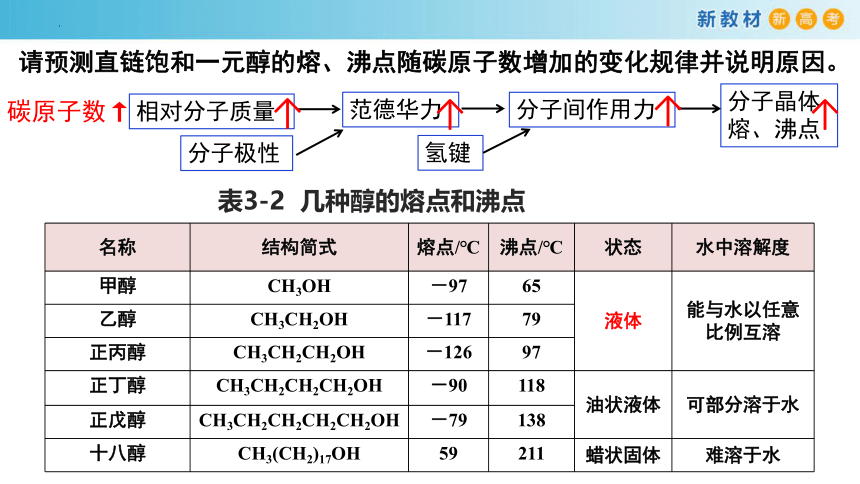
请预测直链饱和一元醇的熔、沸点随碳原子数增加的变化规律并说明原因。
分子晶体
熔、沸点
分子间作用力
范德华力
氢键
相对分子质量
分子极性
↑
↑
↑
↑
碳原子数↑
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
表3-3 含相同碳原子数不同羟基数的醇的沸点比较
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
结论:相同碳原子数羟基数目越多沸点越高
原因:
由于羟基数目增多,使得分子间形成的氢键增多增强,沸点升高。
四、醇的物理性质
1.沸点
①相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。
②饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
③碳原子数相同时,羟基个数越多,醇的沸点越高。
2.溶解性
①甲醇、乙醇和丙醇均可与水互溶,因为醇分子与水分子间形成了氢键。
②醇在水中的溶解度一般随碳原子数的增加而减小。
③碳原子数相同时,羟基个数越多,醇的水溶性越好。
醇中羟基形成氢键使沸点升高!
羟基越多,氢键越多,沸点越高!
H—C—C—O—H
H
H
H
H
δ+
δ+
δ-
①中的O—H键容易断裂,使羟基氢原子被取代;
羟基氧原子吸引电子能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。
②中的C—O键也易断裂,脱去羟基,发生取代反应或消去反应;
α-C的氧化数小于+4,可发生氧化反应。①③键断开。
①
②
③
④
β α
思考交流
分析醇分子结构,并预测反应类型
碳氧键:脱掉羟基
取代反应、消去反应
氢氧键:脱掉氢原子
取代反应、氧化反应
一.羟基中氢的反应
1.与活泼金属的反应
学习任务二:醇的化学性质
2CH3CH2OH+2Na →2CH3CH2ONa+H2↑
断键位置:
CH3CH2—O—H
羟基O—H键
写出乙二醇、丙三醇与钠反应化学方程式:
2mol—OH ~ 2mol Na ~ 1molH2
2.与羧酸的反应--酯化反应
O
CH3 C O H
H O CH2CH3
+
CH3 C O C2H5
+
H2O
浓H2SO4
△
18
18
O
同位素示踪法
酯化反应的实质是:
酸脱羟基,醇脱羟基上的氢,酯化反应能进行
反应时,乙醇分子断裂H—O键
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
反应机理:
卤原子取代了羟基,羟基和氢结合生成水
二.羟基的反应
1.与氢卤酸反应─取代反应
应用:
可用于制备卤代烃
卤代烷
醇
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
2.醇分子间的取代反应:
乙醇在浓硫酸作用下加热至140 ℃时,两个乙醇分子间会脱去一个水分子而生成乙醚:
C2H5—OH + H—OC2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
乙醚:无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用 ;乙醚微溶于水,易溶于有机溶剂
乙醚本身是一种优良溶剂,能溶解多种有机物
【醚类物质】
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
【实验3-2】在圆底烧瓶中加入乙醇与浓硫酸按体积比1∶3的混合液20 mL,并加入碎瓷片防止暴沸。加热混合溶液,迅速升温到170 ℃,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
KMnO4酸性溶液、溴的四氯化碳溶液褪色。
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
实验现象:
实验结论:
3.醇的消去反应:
醇的消去反应的规律
2.若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3或CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
1.醇发生消去反应(分子内脱水)的断键位置:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
规律小结
写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ H2O
等不能发生消除反应。
[思考:]下列醇在浓硫酸作催化剂的条件下能发生消去反应吗
溴乙烷与乙醇都能发生消去反应,它们有什么异同?
【思考】
CH3CH2Br CH3CH2OH
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液、加热
浓硫酸、加热到170℃
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、 NaBr、H2O
CH2=CH2、H2O
制乙烯实验装置
酒精与浓硫酸体积比为1∶3怎么混合?
浓硫酸的作用是什么?
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
用排水集气法收集
防止暴沸
催化剂和脱水剂
液面以下
防止在140℃时生成乙醚。
逐渐变黑。浓硫酸能将无水酒精氧化生成碳单质等多种物质。
有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
4.醇的氧化反应:
2CO2 + 3H2O
C2H5OH +3 O2
点燃
①燃烧:
②与强氧化剂反应:
C2H5OH
KMnO4(H+)
CH3COOH
酸性高锰酸钾紫红色褪去
②与强氧化剂反应:
K2Cr2O7(H+)
C2H5OH
还原
橙色
2
Cr2O7
Cr
3+
灰绿色
+6
+3
可用重铬酸钾的颜色变化来检验酒驾
CH3COOH
继续氧化
CH3CHO
拓展:酒精检测仪
把红色的H2SO4酸化的CrO3载带在硅胶上,人呼出的酒精可以将其还原为灰绿色的Cr2(SO4)3。
③醇的催化氧化:
醇在Cu或Ag作催化剂条件下可与氧气反应生成醛。
C
C
H
H
H
H
O
C
C
O
H
H
H
H
H
H
断键:断开O—H 和 α位C—H键
结构条件:本C有H
醇的催化氧化反应的规律
醇发生催化氧化的断键位置:
—C—C—H
O—H
+ Cu+H2O
α
+ Cu O
—C—C
O
1.醇发生催化氧化的必备条件:α–C原子上必须连有氢原子。
2.醇发生催化氧化的产物的类别,取决于α–C原子上的氢原子的个数 。
规律小结
分析结构 (官能团、化学键)
预测性质 与反应类型
官能团转化
决定
引起
有机合成
醇
羟基的反应
烯烃
卤代烃
醚
醇钠
醛酮
酯
羟基氢的反应
归纳与提升
研究有机化合物化学性质的一般方法
走进奇妙的化学世界
选择性必修3
第三章 烃的衍生物
第二节 醇 酚
聚会时酒必不可少
但不是所有人酒量都好
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
乙醇脱氢酶
乙醛脱氢酶
不醉酒
乙醇脱氢酶
醉酒
学习
目标
第1课时
醇的结构与性质
PART
01
PART
02
结合醇的代表物了解醇的分类、组成和结构,理解醇的性质,培养“宏观辨别与微观探析”的核心素养
以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。培养“变化观念与证据推理”的核心素养
对比有机化合物的分子结构,归纳什么是醇?什么是酚?
1-丙醇 2-丙醇
苯甲醇
CH3CH2CH2OH
CH3 CH CH3
CH2OH
OH
环己醇
OH
OH
苯酚
OH
萘酚
思考交流
羟基与饱和碳原子相连的化合物称为醇,
羟基与苯环直接相连而形成的化合物称为酚。
(1)定义:羟基与饱和碳原子相连的化合物称为醇。
(2)官能团:羟基(—OH)
(3)结构: (R1、R2、R3为H或烃基)
(4)饱和一元醇通式:CnH2n+1OH 或 CnH2n+2O (n≥1),可简写为R—OH。
一、醇的结构特点
学习任务一:认识醇
饱和x元醇的通式为:CnH2n+2Ox
注意:羟基如果连在双键碳或三键碳上不稳定,两个羟基不能连在同一个碳上。
按羟基所连
烃基种类
饱和醇
不饱和醇
脂环醇
芳香醇
CH3CH2OH 乙醇
CH2=CHCH2OH 丙烯醇
苯甲醇
环己醇
乙二醇
分子中所含羟基的数目
一元醇
二元醇
多元醇
CH3OH
CH2–OH
CH2–OH
CH2–OH
CH–OH
CH2–OH
甲醇
丙三醇
醇的
分类
二、醇的分类
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
二元醇
CH2CH CH2
OH OHOH
丙三醇(甘油)
吸湿性,护肤
三元醇
一元醇
CH3OH
甲醇
(木精、木醇)
剧毒
用于能源领域如汽车燃料
乙二醇、丙三醇都是无色、粘稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
工业酒精有毒!
汽车防冻剂
配制化妆品
生活中的化学
(1)选主链——选择含有与羟基相连的碳原子的最长碳链为主链,根据碳原子数目称为某醇;
(2)编位次——从距离羟基最近的一端给主链碳原子依次编号;
(3)写名称——用阿拉伯数字标出羟基位次,羟基的个数用“二”“三”等表示。
三、醇的命名
“取代基位号-个数+名称-羟基位号-某醇”
2-甲基-1,3-丁二醇
【例1】用系统命名法命名
2,3—二甲基—3—戊醇
CH2
CH
CH—CH3
OH
OH
CH3
2-甲基-1,2,4-丁三醇
2OH
【思考】对比分析表格中的数据,你能得出什么结论?为什么?
表3-1 相对分子质量相近的醇与烷烃的沸点比较
名称 结构简式 相对分子量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 78
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
思考交流
醇分子间形成氢键:
一个醇分子的羟基氢原子可与另一个醇分子羟基氧原子相互吸引,形成氢键,形成氢键可以增大分子间作用力,从而影响物质的溶解度、熔沸点。
结论:相对分子质量相近的醇比烷烃的沸点高得多。因为醇分子间可以形成氢键。且C数越多沸点越高
小分子的醇(甲醇、乙醇、丙醇)均可与水以任意比互溶,就是因为这些醇与水形成了氢键的缘故。)
氢键
请预测直链饱和一元醇的熔、沸点随碳原子数增加的变化规律并说明原因。
分子晶体
熔、沸点
分子间作用力
范德华力
氢键
相对分子质量
分子极性
↑
↑
↑
↑
碳原子数↑
表3-2 几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃ 状态 水中溶解度
甲醇 CH3OH -97 65 液体 能与水以任意比例互溶
乙醇 CH3CH2OH -117 79 正丙醇 CH3CH2CH2OH -126 97 正丁醇 CH3CH2CH2CH2OH -90 118 油状液体 可部分溶于水
正戊醇 CH3CH2CH2CH2CH2OH -79 138 十八醇 CH3(CH2)17OH 59 211 蜡状固体 难溶于水
表3-3 含相同碳原子数不同羟基数的醇的沸点比较
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
结论:相同碳原子数羟基数目越多沸点越高
原因:
由于羟基数目增多,使得分子间形成的氢键增多增强,沸点升高。
四、醇的物理性质
1.沸点
①相对分子质量相近的低级醇和烷烃相比,低级醇的沸点远远高于烷烃。
②饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
③碳原子数相同时,羟基个数越多,醇的沸点越高。
2.溶解性
①甲醇、乙醇和丙醇均可与水互溶,因为醇分子与水分子间形成了氢键。
②醇在水中的溶解度一般随碳原子数的增加而减小。
③碳原子数相同时,羟基个数越多,醇的水溶性越好。
醇中羟基形成氢键使沸点升高!
羟基越多,氢键越多,沸点越高!
H—C—C—O—H
H
H
H
H
δ+
δ+
δ-
①中的O—H键容易断裂,使羟基氢原子被取代;
羟基氧原子吸引电子能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。
②中的C—O键也易断裂,脱去羟基,发生取代反应或消去反应;
α-C的氧化数小于+4,可发生氧化反应。①③键断开。
①
②
③
④
β α
思考交流
分析醇分子结构,并预测反应类型
碳氧键:脱掉羟基
取代反应、消去反应
氢氧键:脱掉氢原子
取代反应、氧化反应
一.羟基中氢的反应
1.与活泼金属的反应
学习任务二:醇的化学性质
2CH3CH2OH+2Na →2CH3CH2ONa+H2↑
断键位置:
CH3CH2—O—H
羟基O—H键
写出乙二醇、丙三醇与钠反应化学方程式:
2mol—OH ~ 2mol Na ~ 1molH2
2.与羧酸的反应--酯化反应
O
CH3 C O H
H O CH2CH3
+
CH3 C O C2H5
+
H2O
浓H2SO4
△
18
18
O
同位素示踪法
酯化反应的实质是:
酸脱羟基,醇脱羟基上的氢,酯化反应能进行
反应时,乙醇分子断裂H—O键
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
反应机理:
卤原子取代了羟基,羟基和氢结合生成水
二.羟基的反应
1.与氢卤酸反应─取代反应
应用:
可用于制备卤代烃
卤代烷
醇
强碱水溶液,加热
—X被—OH取代
氢卤酸,加热
—OH被—X取代
2.醇分子间的取代反应:
乙醇在浓硫酸作用下加热至140 ℃时,两个乙醇分子间会脱去一个水分子而生成乙醚:
C2H5—OH + H—OC2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
乙醚:无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用 ;乙醚微溶于水,易溶于有机溶剂
乙醚本身是一种优良溶剂,能溶解多种有机物
【醚类物质】
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。
醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
饱和一元醚的通式:CnH2n+2O (n≥2)
【实验3-2】在圆底烧瓶中加入乙醇与浓硫酸按体积比1∶3的混合液20 mL,并加入碎瓷片防止暴沸。加热混合溶液,迅速升温到170 ℃,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
KMnO4酸性溶液、溴的四氯化碳溶液褪色。
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
实验现象:
实验结论:
3.醇的消去反应:
醇的消去反应的规律
2.若醇分子中α–C原子连接两个或三个β–C,且β–C原子上均有氢原子时,发生消去反应可能生成不同的产物。例如:
发生消去反应产物为CH3CH=CHCH3或CH3CH2CH=CH2
CH3—CH2—CH—CH3
OH
1.醇发生消去反应(分子内脱水)的断键位置:
—C—C—
H OH
浓H2SO4
+H2O
—C==C—
α
β
规律小结
写出下列化学反应方程式
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+ H2O
CH2=CH-CH=CH2
+ H2O
等不能发生消除反应。
[思考:]下列醇在浓硫酸作催化剂的条件下能发生消去反应吗
溴乙烷与乙醇都能发生消去反应,它们有什么异同?
【思考】
CH3CH2Br CH3CH2OH
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液、加热
浓硫酸、加热到170℃
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、 NaBr、H2O
CH2=CH2、H2O
制乙烯实验装置
酒精与浓硫酸体积比为1∶3怎么混合?
浓硫酸的作用是什么?
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃?
温度计的位置?
混合液颜色如何变化?为什么?
有何杂质气体?如何除去?
用排水集气法收集
防止暴沸
催化剂和脱水剂
液面以下
防止在140℃时生成乙醚。
逐渐变黑。浓硫酸能将无水酒精氧化生成碳单质等多种物质。
有H2O、CO2、SO2等气体。可将气体通过碱石灰或NaOH溶液。
4.醇的氧化反应:
2CO2 + 3H2O
C2H5OH +3 O2
点燃
①燃烧:
②与强氧化剂反应:
C2H5OH
KMnO4(H+)
CH3COOH
酸性高锰酸钾紫红色褪去
②与强氧化剂反应:
K2Cr2O7(H+)
C2H5OH
还原
橙色
2
Cr2O7
Cr
3+
灰绿色
+6
+3
可用重铬酸钾的颜色变化来检验酒驾
CH3COOH
继续氧化
CH3CHO
拓展:酒精检测仪
把红色的H2SO4酸化的CrO3载带在硅胶上,人呼出的酒精可以将其还原为灰绿色的Cr2(SO4)3。
③醇的催化氧化:
醇在Cu或Ag作催化剂条件下可与氧气反应生成醛。
C
C
H
H
H
H
O
C
C
O
H
H
H
H
H
H
断键:断开O—H 和 α位C—H键
结构条件:本C有H
醇的催化氧化反应的规律
醇发生催化氧化的断键位置:
—C—C—H
O—H
+ Cu+H2O
α
+ Cu O
—C—C
O
1.醇发生催化氧化的必备条件:α–C原子上必须连有氢原子。
2.醇发生催化氧化的产物的类别,取决于α–C原子上的氢原子的个数 。
规律小结
分析结构 (官能团、化学键)
预测性质 与反应类型
官能团转化
决定
引起
有机合成
醇
羟基的反应
烯烃
卤代烃
醚
醇钠
醛酮
酯
羟基氢的反应
归纳与提升
研究有机化合物化学性质的一般方法
