人教版高中化学第6章化学反应与能量第1节化学反应与能量变化第2课时化学反应与电能课件(63张ppt)
文档属性
| 名称 | 人教版高中化学第6章化学反应与能量第1节化学反应与能量变化第2课时化学反应与电能课件(63张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 08:49:53 | ||
图片预览









文档简介
(共63张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第2课时 化学反应与电能
学习目标 核心素养
1.通过实验探究,认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。 2.通过对原电池的学习,体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。 宏观辨识与微观探析:
能从宏观(能量变化)和微观(电子转移)相结合的视角分析原电池的组成和工作原理。
科学探究与创新意识:
能根据教材中原电池原理的实验探究方案,完成实验操作,观察物质及其变化的现象,客观地进行记录,对实验现象作出解释。
学习目标 核心素养
3.通过原电池的学习,能举出化学能转化为电能的实例,能辨识简单原电池的构成要素,并能分析简单原电池的工作原理。 科学态度与社会责任:
通过对原电池的学习,体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。主动关心与资源开发等有关的社会热点问题。
课前素能奠基
课堂素能探究
课堂达标验收
新课情景呈现
名师博客呈现
新课情景呈现
从前在伦敦上流社会,有一位贵族夫人格林太太,幼年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又因为车祸掉了一颗牙,为了显示她的富有,她装了一颗黄金假牙。自此以后,她就经常出现头痛、失眠、心情烦躁等症状。更奇怪的是,众多的医学专家为她检查后,都找不到病因,这位夫人整日感到精神萎靡,找遍各大医院会诊也不见效果。格林太太的病因到底是什么呢?
原来这种病态与车祸有关:“车祸—假牙—病症”。两颗假牙为活泼性不同的金属,与唾液中的电解质接触,会产生电流从而刺激神经,使格林太太头痛。那么,为何会产生电流呢?让我们走进教材学习化学反应与电能
课前素能奠基
新 知 预 习
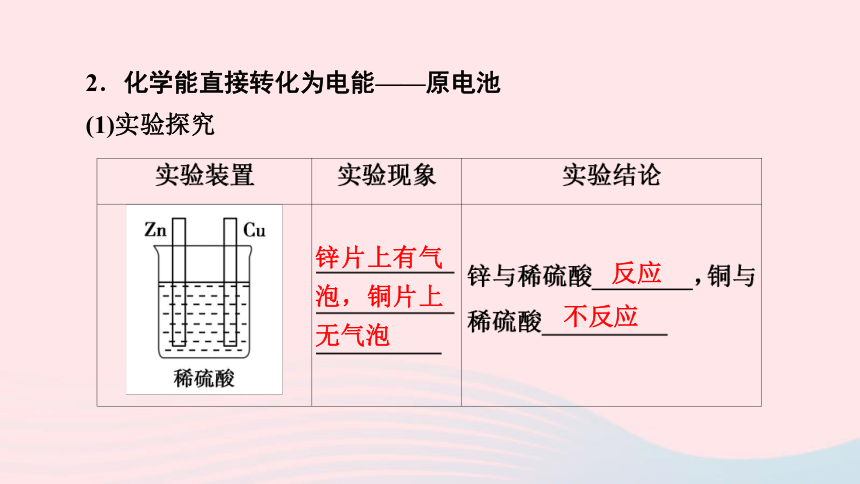
2.化学能直接转化为电能——原电池
(1)实验探究
锌片上有气泡,铜片上无气泡
反应
不反应
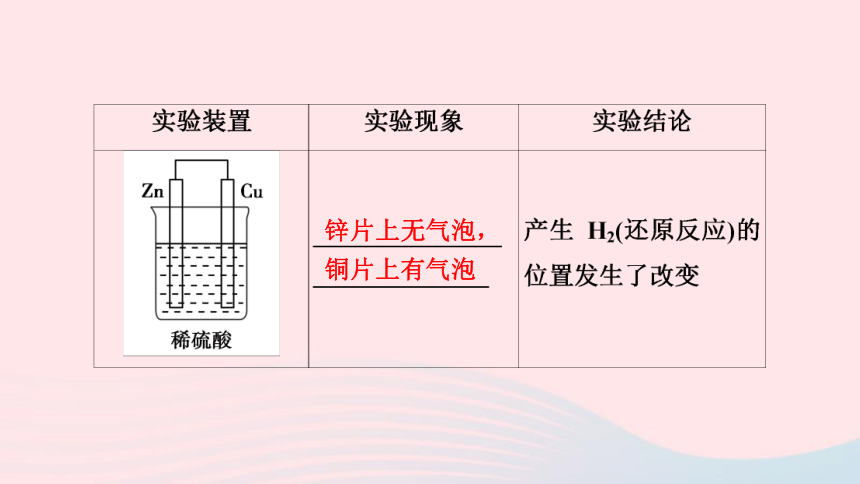
锌片上无气泡,铜片上有气泡
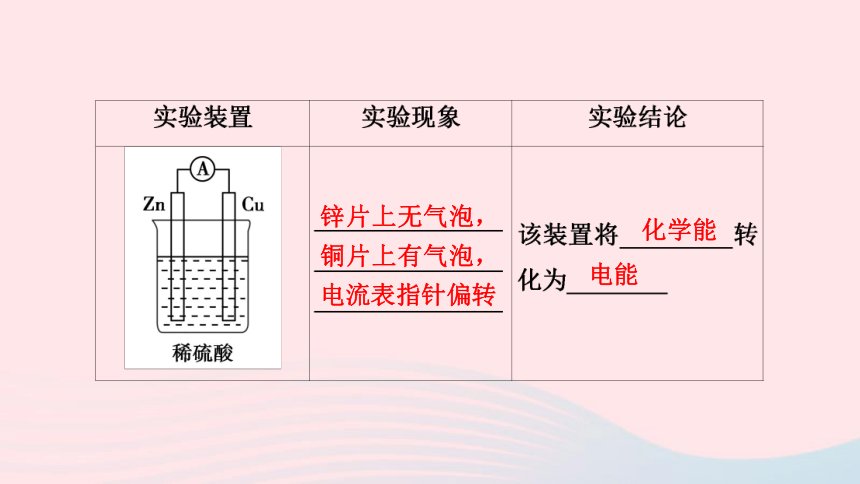
锌片上无气泡,铜片上有气泡,电流表指针偏转
化学能
电能
(2)原理分析
(3)原电池
①定义:把__________________的装置叫原电池。
②工作原理(以铜 锌 稀硫酸原电池为例)
电极材料 电极名称 电子转移 电极反应式 反应类型
锌 负极 _______ _________________ __________
铜 正极 _______ _________________ __________
电池反应的 离子方程式 _____________________ 失电子
Zn-2e-===Zn2+
氧化反应
得电子
2H++2e-===H2↑
还原反应
Zn+2H+===Zn2++H2↑
化学能转化为电能
二、化学电池——新能源和可再生能源的重要组成部分
1.一次电池——锌锰干电池
工作原理 负极 ______ 锌被氧化,逐渐消耗
电解质 氯化铵糊 正极 _________ __________被还原
特点 放电后______充电 便于携带,价格低 锌筒
石墨棒
二氧化锰
不能
2.二次电池
3.发展中的燃料电池
应 用 体 验
C
解析:只有氧化还原反应才能设计成原电池,A、B、D都属于氧化还原反应,均可设计成原电池;C项中反应不是氧化还原反应,不能设计成原电池,故选C。
2.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为 ( )
A.铝 B.铜
C.锡 D.硅
解析:仅铝与锡可与盐酸反应生成氢气,且活泼性Al>Zn>Sn,锌为原电池反应的负极,故选C。
C
3.下列关于化学电池的说法不正确的是 ( )
A.一次电池内部的氧化还原反应无法逆向进行,如锌锰干电池
B.铅酸蓄电池属于二次电池,充电时化学能转化为电能
C.充电电池放电时所进行的氧化还原反应,在充电时可逆向进行
D.锂离子电池和燃料电池都是高效、安全、环保的新型化学电池
解析:一次电池内部氧化还原反应是无法逆向进行的,锌锰电池是一次电池,A项正确;铅酸蓄电池是二次电池,充电时电能转化为化学能,B项错误;充电电池内部的氧化还原反应可以逆向进行,C项正确;锂电池和燃料电池都是高效、安全、环保的新型化学电源,D项正确。
B
要 点 归 纳
课堂素能探究
知识点一
原电池的工作原理
问题探究
1.原电池内部阴、阳离子如何移动?移动的原因是什么?
提示:阴离子要移向负极,阳离子要移向正极。这是因为负极失电子,生成大量阳离子积聚在负极附近,致使该极附近有大量正电荷,所以溶液中的阴离子要移向负极;正极得电子,该极附近的阳离子因得电子生成电中性的物质而使该极附近带负电荷,所以溶液中的阳离子要移向正极。
2.两个活泼性不同的金属电极用导线连接,共同通入电解质溶液中就能构成原电池吗?
提示:不一定。构成原电池除具备①两种活泼性不同的金属,②电解质溶液,③形成闭合回路外,还必须有一个能自发进行的氧化还原反应,如图由于Cu、Ag都不能与稀硫酸反应,故不能构成原电池。
知识归纳总结
1.原电池的构成条件——“两极一液一线一反应”
(1)两极——两种活泼性不同的金属(或一种为能导电的非金属)。
(2)一液——电解质溶液。
(3)一线——形成闭合回路。
(4)一反应——能自发进行的氧化还原反应。
2.原电池工作原理
(1)装置示意图
(2)工作原理(以铜、锌、稀硫酸原电池为例)
知识要点 实例
电极构成 负极:还原性相对较强的金属 正极:还原性相对较弱的金属或导电非金属 锌板——负极
铜板——正极
电极反应 负极:失去电子,氧化反应 正极:得到电子,还原反应 负极:Zn-2e-===Zn2+
正极:2H++2e-===H2↑
3.原电池正负极的判断方法
点拨:(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,例如石墨。两极材料可能参与反应,也可能不参与反应。
(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,必须有一个能自发进行的氧化还原反应。
(3)在判断原电池正负极时,既要考虑金属活泼性的强弱也要考虑电解质溶液的性质。如Mg—Al—HCl溶液构成的原电池中,负极为Mg;但是Mg—Al—NaOH溶液构成的原电池中,负极为Al,正极为Mg。
典例1
典例剖析
如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是 ( )
C
选项 M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
解析:本题通过电极质量变化来确定电极,N棒变细,N极上发生氧化反应,N棒金属较活泼,A、D错误,由M棒变粗,可知B错误。
1.某兴趣小组设计的简易原电池装置如右图所示。该电池工作时,下列说法正确的是 ( )
A.锌片作正极
B.铜片上有气泡产生
C.将电能转化为化学能
D.电子由铜片经导线流向锌片
素养应用
B
解析:A项,根据原电池的工作原理,活泼金属作负极,锌比铜活泼,锌作负极,故错误;B项,铜作正极,电极反应式为2H++2e-===H2↑,铜片上有气泡冒出,故正确;C项,此装置为原电池装置,是化学能转化为电能,故错误;D项,根据原电池的工作原理,电子从负极经外电路流向正极,即从锌片经外电路流向铜片,故错误。
知识点二
原电池原理的应用
问题探究
1.在原电池中,负极材料的金属性一定大于正极材料吗?
一般原电池中负极材料的金属性大于正极材料,在特殊情况下也有特例,如Al-Mg-NaOH原电池中,Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极。
2.如何利用Cu+2AgNO3===Cu(NO3)2+2Ag设计原电池?
该氧化还原反应可拆分为如下两个半反应:氧化反应(负极反应):Cu-2e-===Cu2+;还原反应(正极反应):2Ag++2e-===2Ag。故Cu作负极,活泼性比Cu差的材料作正极,如Ag、C等,AgNO3溶液作电解质溶液。如图。
知识归纳总结
1.加快化学反应速率
一个自发进行的氧化还原反应,设计成原电池可以加快反应速率。
2.比较金属活泼性强弱
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
3.用于金属保护
将被保护的金属与比其活泼的金属连接。
4.设计原电池
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂为电解质溶液中的阳离子(或在正极上被还原)。
(2)步骤:以Fe+CuSO4===FeSO4+Cu为例。
步骤 实例
将反应拆分为电极反应 负极反应 Fe-2e-===Fe2+
正极反应 Cu2++2e-===Cu
选择电 极材料 负极:较活泼金属,一般为发生氧化反应的金属 Fe
正极:活泼性弱于负极材料的金属或石墨 Cu或C
选择电解质 一般为与负极反应的电解质 CuSO4溶液
典例2
典例剖析
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:___________________________。
(2)若将(1)中的反应设计成原电池,
请在方框内画出原电池的装置图,标出正、
负极,并写出电极反应式。
2Fe3++Cu===2Fe2++Cu2+
正极反应式:___________________
负极反应式:_________________
2Fe3++2e-===2Fe2+
Cu-2e-===Cu2+
2.现有如下两个反应:
A.NaOH+HCl===NaCl+H2O,
B.Cu+2Ag+===2Ag+Cu2+。
(1)根据上述两反应的本质,_____(填字母)反应能设计成原电池,其原因是________________________________________________________ __________。
(2)将上述反应中能设计成原电池的反应设计成原电池。
①写出电极反应式及反应类型:
负极:___________________,__________;
正极:____________________,__________。
素养应用
B
A为非氧化还原反应,没有电子转移,B为氧化还原反应,有电
子转移
Cu-2e-===Cu2+
氧化反应
2Ag++2e-===2Ag
还原反应
②画出装置图并标明电极材料与名称、电解质溶液、电子流向。
③若导线上通过电子1 mol,则正极质量增加_______g。
108
解析:(1)只有自发进行的氧化还原反应才能设计成原电池,B是自发进行的氧化还原反应。(2)根据电池反应式Cu+2Ag+===2Ag+Cu2+可知,Cu失电子作负极,负极材料是Cu,正极材料应是比铜不活泼的金属或导电的非金属;Ag+得电子,所以此电解质溶液只能为 AgNO3溶液。由2Ag++2e-===2Ag知导线上通过1 mol电子生成1 mol Ag。
名师博客呈现
设计原电池的一般思路
(1)将已知氧化还原反应拆分成两个半反应
氧化反应:还原剂-ne-===氧化产物
还原反应:氧化剂+ne-===还原产物
正极反应式+负极反应式―→电池总反应式
(2)根据总反应式并结合两个半反应,找出正、负极材料及电解质溶液。
①电极材料的选择:选活泼性较强的金属作负极,活泼性较弱的金属或能导电的惰性材料作正极。
②电解质溶液的选择:电解质溶液一般要能与负极发生反应,可参照总反应式选择电解质溶液。
D
〔即时训练〕
如图为锌、铜水果电池装置示意图,下列说法正确的是 ( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子由负极经导线传递到正极,所以溶液中的阳离子向正极移动,在正极上得到电子,发生还原反应。锌的金属性强于铜,锌是负极,铜是正极,A错误;锌片是负极,发生氧化反应:Zn-2e-===Zn2+,B错误;该装置是原电池,将化学能转变为电能,C错误;电子由负极锌片沿导线流向正极铜极,D正确。
课堂达标验收
1.某化学兴趣小组利用反应Zn+2FeCl3===ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是 ( )
A.Zn为负极,发生还原反应
B.b电极反应式为2Fe3++2e-===2Fe2+
C.电子流动方向是a电极→FeCl3溶液→b电极
D.电极的正极材料可以选用石墨、铂电极,
也可以用铜电极
D
解析:根据Cl-的移动方向可知,b电极为负极,a电极为正极,根据电池反应式可知,Zn发生失电子的氧化反应,即b电极反应式为Zn-2e-===Zn2+,A、B错误;电子流动方向是b电极→导线→a电极,C错误;正极材料的活泼性应比负极材料弱,D正确。
2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为 ( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
解析:根据原电池原理,负极的金属比正极活泼,可知Y>X,根据金属活动性顺序和置换反应原理,可知X>Z,故有Y>X>Z。
C
3.某同学为了探究原电池产生电流的过程,设计了如图实验。
(1)打开K,观察到的现象为_______________________。
(2)关闭K,观察到的现象是_______________________。
此电池的负极的电极反应式为__________________。
总反应式为_________________________。
(3)关闭K,溶液中阳离子向_____(填“Zn”或“C”)极运动,外电路中,电子流动方向是_________________________。
锌棒上附着有红色固体
碳棒上附着有红色固体
Zn-2e-===Zn2+
Zn+Cu2+===Zn2++Cu
C
Zn→C(或负极→正极)
4.近年来野外生存的真人秀节目在各大卫视频繁播放。某节目中野外生存达人用一个柠檬、一排铜钉和一排锌钉制作的水果电池用于野外生火。某同学感到好奇自己制作了一个这样的“超级柠檬电池”。
(1)该电池的电池反应是什么?
(2)若用铁片代替锌片LED灯能不能亮?若用铁片代替铜片呢?
(3)若用银片代替锌片LED灯能不能亮?
(4)由上面分析可知构成原电池的条件有哪些?
答案:(1)该电池利用了金属锌与酸的反应,离子方程式为Zn+2H+===Zn2++H2↑。
(2)若用铁片代替锌片,由于铁能与酸反应,LED灯仍然能亮;若用铁片代替铜片,由于锌比铁活泼,仍然发生反应Zn+2H+===Zn2++H2↑,LED灯仍然能亮。
(3)不能。银片代替锌片,银和铜都不能与酸反应,无电流产生,LED灯不亮。
(4)①两个活泼性不同的金属电极或金属与石墨;②电解质溶液;③闭合回路;④自发进行的氧化还原反应。
第六章 化学反应与能量
第一节 化学反应与能量变化
第2课时 化学反应与电能
学习目标 核心素养
1.通过实验探究,认识化学能可以转化为电能,从氧化还原反应的角度初步认识原电池的工作原理。 2.通过对原电池的学习,体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。 宏观辨识与微观探析:
能从宏观(能量变化)和微观(电子转移)相结合的视角分析原电池的组成和工作原理。
科学探究与创新意识:
能根据教材中原电池原理的实验探究方案,完成实验操作,观察物质及其变化的现象,客观地进行记录,对实验现象作出解释。
学习目标 核心素养
3.通过原电池的学习,能举出化学能转化为电能的实例,能辨识简单原电池的构成要素,并能分析简单原电池的工作原理。 科学态度与社会责任:
通过对原电池的学习,体会提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。主动关心与资源开发等有关的社会热点问题。
课前素能奠基
课堂素能探究
课堂达标验收
新课情景呈现
名师博客呈现
新课情景呈现
从前在伦敦上流社会,有一位贵族夫人格林太太,幼年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又因为车祸掉了一颗牙,为了显示她的富有,她装了一颗黄金假牙。自此以后,她就经常出现头痛、失眠、心情烦躁等症状。更奇怪的是,众多的医学专家为她检查后,都找不到病因,这位夫人整日感到精神萎靡,找遍各大医院会诊也不见效果。格林太太的病因到底是什么呢?
原来这种病态与车祸有关:“车祸—假牙—病症”。两颗假牙为活泼性不同的金属,与唾液中的电解质接触,会产生电流从而刺激神经,使格林太太头痛。那么,为何会产生电流呢?让我们走进教材学习化学反应与电能
课前素能奠基
新 知 预 习
2.化学能直接转化为电能——原电池
(1)实验探究
锌片上有气泡,铜片上无气泡
反应
不反应
锌片上无气泡,铜片上有气泡
锌片上无气泡,铜片上有气泡,电流表指针偏转
化学能
电能
(2)原理分析
(3)原电池
①定义:把__________________的装置叫原电池。
②工作原理(以铜 锌 稀硫酸原电池为例)
电极材料 电极名称 电子转移 电极反应式 反应类型
锌 负极 _______ _________________ __________
铜 正极 _______ _________________ __________
电池反应的 离子方程式 _____________________ 失电子
Zn-2e-===Zn2+
氧化反应
得电子
2H++2e-===H2↑
还原反应
Zn+2H+===Zn2++H2↑
化学能转化为电能
二、化学电池——新能源和可再生能源的重要组成部分
1.一次电池——锌锰干电池
工作原理 负极 ______ 锌被氧化,逐渐消耗
电解质 氯化铵糊 正极 _________ __________被还原
特点 放电后______充电 便于携带,价格低 锌筒
石墨棒
二氧化锰
不能
2.二次电池
3.发展中的燃料电池
应 用 体 验
C
解析:只有氧化还原反应才能设计成原电池,A、B、D都属于氧化还原反应,均可设计成原电池;C项中反应不是氧化还原反应,不能设计成原电池,故选C。
2.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为 ( )
A.铝 B.铜
C.锡 D.硅
解析:仅铝与锡可与盐酸反应生成氢气,且活泼性Al>Zn>Sn,锌为原电池反应的负极,故选C。
C
3.下列关于化学电池的说法不正确的是 ( )
A.一次电池内部的氧化还原反应无法逆向进行,如锌锰干电池
B.铅酸蓄电池属于二次电池,充电时化学能转化为电能
C.充电电池放电时所进行的氧化还原反应,在充电时可逆向进行
D.锂离子电池和燃料电池都是高效、安全、环保的新型化学电池
解析:一次电池内部氧化还原反应是无法逆向进行的,锌锰电池是一次电池,A项正确;铅酸蓄电池是二次电池,充电时电能转化为化学能,B项错误;充电电池内部的氧化还原反应可以逆向进行,C项正确;锂电池和燃料电池都是高效、安全、环保的新型化学电源,D项正确。
B
要 点 归 纳
课堂素能探究
知识点一
原电池的工作原理
问题探究
1.原电池内部阴、阳离子如何移动?移动的原因是什么?
提示:阴离子要移向负极,阳离子要移向正极。这是因为负极失电子,生成大量阳离子积聚在负极附近,致使该极附近有大量正电荷,所以溶液中的阴离子要移向负极;正极得电子,该极附近的阳离子因得电子生成电中性的物质而使该极附近带负电荷,所以溶液中的阳离子要移向正极。
2.两个活泼性不同的金属电极用导线连接,共同通入电解质溶液中就能构成原电池吗?
提示:不一定。构成原电池除具备①两种活泼性不同的金属,②电解质溶液,③形成闭合回路外,还必须有一个能自发进行的氧化还原反应,如图由于Cu、Ag都不能与稀硫酸反应,故不能构成原电池。
知识归纳总结
1.原电池的构成条件——“两极一液一线一反应”
(1)两极——两种活泼性不同的金属(或一种为能导电的非金属)。
(2)一液——电解质溶液。
(3)一线——形成闭合回路。
(4)一反应——能自发进行的氧化还原反应。
2.原电池工作原理
(1)装置示意图
(2)工作原理(以铜、锌、稀硫酸原电池为例)
知识要点 实例
电极构成 负极:还原性相对较强的金属 正极:还原性相对较弱的金属或导电非金属 锌板——负极
铜板——正极
电极反应 负极:失去电子,氧化反应 正极:得到电子,还原反应 负极:Zn-2e-===Zn2+
正极:2H++2e-===H2↑
3.原电池正负极的判断方法
点拨:(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,例如石墨。两极材料可能参与反应,也可能不参与反应。
(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,必须有一个能自发进行的氧化还原反应。
(3)在判断原电池正负极时,既要考虑金属活泼性的强弱也要考虑电解质溶液的性质。如Mg—Al—HCl溶液构成的原电池中,负极为Mg;但是Mg—Al—NaOH溶液构成的原电池中,负极为Al,正极为Mg。
典例1
典例剖析
如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是 ( )
C
选项 M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
解析:本题通过电极质量变化来确定电极,N棒变细,N极上发生氧化反应,N棒金属较活泼,A、D错误,由M棒变粗,可知B错误。
1.某兴趣小组设计的简易原电池装置如右图所示。该电池工作时,下列说法正确的是 ( )
A.锌片作正极
B.铜片上有气泡产生
C.将电能转化为化学能
D.电子由铜片经导线流向锌片
素养应用
B
解析:A项,根据原电池的工作原理,活泼金属作负极,锌比铜活泼,锌作负极,故错误;B项,铜作正极,电极反应式为2H++2e-===H2↑,铜片上有气泡冒出,故正确;C项,此装置为原电池装置,是化学能转化为电能,故错误;D项,根据原电池的工作原理,电子从负极经外电路流向正极,即从锌片经外电路流向铜片,故错误。
知识点二
原电池原理的应用
问题探究
1.在原电池中,负极材料的金属性一定大于正极材料吗?
一般原电池中负极材料的金属性大于正极材料,在特殊情况下也有特例,如Al-Mg-NaOH原电池中,Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极。
2.如何利用Cu+2AgNO3===Cu(NO3)2+2Ag设计原电池?
该氧化还原反应可拆分为如下两个半反应:氧化反应(负极反应):Cu-2e-===Cu2+;还原反应(正极反应):2Ag++2e-===2Ag。故Cu作负极,活泼性比Cu差的材料作正极,如Ag、C等,AgNO3溶液作电解质溶液。如图。
知识归纳总结
1.加快化学反应速率
一个自发进行的氧化还原反应,设计成原电池可以加快反应速率。
2.比较金属活泼性强弱
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
3.用于金属保护
将被保护的金属与比其活泼的金属连接。
4.设计原电池
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂为电解质溶液中的阳离子(或在正极上被还原)。
(2)步骤:以Fe+CuSO4===FeSO4+Cu为例。
步骤 实例
将反应拆分为电极反应 负极反应 Fe-2e-===Fe2+
正极反应 Cu2++2e-===Cu
选择电 极材料 负极:较活泼金属,一般为发生氧化反应的金属 Fe
正极:活泼性弱于负极材料的金属或石墨 Cu或C
选择电解质 一般为与负极反应的电解质 CuSO4溶液
典例2
典例剖析
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:___________________________。
(2)若将(1)中的反应设计成原电池,
请在方框内画出原电池的装置图,标出正、
负极,并写出电极反应式。
2Fe3++Cu===2Fe2++Cu2+
正极反应式:___________________
负极反应式:_________________
2Fe3++2e-===2Fe2+
Cu-2e-===Cu2+
2.现有如下两个反应:
A.NaOH+HCl===NaCl+H2O,
B.Cu+2Ag+===2Ag+Cu2+。
(1)根据上述两反应的本质,_____(填字母)反应能设计成原电池,其原因是________________________________________________________ __________。
(2)将上述反应中能设计成原电池的反应设计成原电池。
①写出电极反应式及反应类型:
负极:___________________,__________;
正极:____________________,__________。
素养应用
B
A为非氧化还原反应,没有电子转移,B为氧化还原反应,有电
子转移
Cu-2e-===Cu2+
氧化反应
2Ag++2e-===2Ag
还原反应
②画出装置图并标明电极材料与名称、电解质溶液、电子流向。
③若导线上通过电子1 mol,则正极质量增加_______g。
108
解析:(1)只有自发进行的氧化还原反应才能设计成原电池,B是自发进行的氧化还原反应。(2)根据电池反应式Cu+2Ag+===2Ag+Cu2+可知,Cu失电子作负极,负极材料是Cu,正极材料应是比铜不活泼的金属或导电的非金属;Ag+得电子,所以此电解质溶液只能为 AgNO3溶液。由2Ag++2e-===2Ag知导线上通过1 mol电子生成1 mol Ag。
名师博客呈现
设计原电池的一般思路
(1)将已知氧化还原反应拆分成两个半反应
氧化反应:还原剂-ne-===氧化产物
还原反应:氧化剂+ne-===还原产物
正极反应式+负极反应式―→电池总反应式
(2)根据总反应式并结合两个半反应,找出正、负极材料及电解质溶液。
①电极材料的选择:选活泼性较强的金属作负极,活泼性较弱的金属或能导电的惰性材料作正极。
②电解质溶液的选择:电解质溶液一般要能与负极发生反应,可参照总反应式选择电解质溶液。
D
〔即时训练〕
如图为锌、铜水果电池装置示意图,下列说法正确的是 ( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子由负极经导线传递到正极,所以溶液中的阳离子向正极移动,在正极上得到电子,发生还原反应。锌的金属性强于铜,锌是负极,铜是正极,A错误;锌片是负极,发生氧化反应:Zn-2e-===Zn2+,B错误;该装置是原电池,将化学能转变为电能,C错误;电子由负极锌片沿导线流向正极铜极,D正确。
课堂达标验收
1.某化学兴趣小组利用反应Zn+2FeCl3===ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是 ( )
A.Zn为负极,发生还原反应
B.b电极反应式为2Fe3++2e-===2Fe2+
C.电子流动方向是a电极→FeCl3溶液→b电极
D.电极的正极材料可以选用石墨、铂电极,
也可以用铜电极
D
解析:根据Cl-的移动方向可知,b电极为负极,a电极为正极,根据电池反应式可知,Zn发生失电子的氧化反应,即b电极反应式为Zn-2e-===Zn2+,A、B错误;电子流动方向是b电极→导线→a电极,C错误;正极材料的活泼性应比负极材料弱,D正确。
2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为 ( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
解析:根据原电池原理,负极的金属比正极活泼,可知Y>X,根据金属活动性顺序和置换反应原理,可知X>Z,故有Y>X>Z。
C
3.某同学为了探究原电池产生电流的过程,设计了如图实验。
(1)打开K,观察到的现象为_______________________。
(2)关闭K,观察到的现象是_______________________。
此电池的负极的电极反应式为__________________。
总反应式为_________________________。
(3)关闭K,溶液中阳离子向_____(填“Zn”或“C”)极运动,外电路中,电子流动方向是_________________________。
锌棒上附着有红色固体
碳棒上附着有红色固体
Zn-2e-===Zn2+
Zn+Cu2+===Zn2++Cu
C
Zn→C(或负极→正极)
4.近年来野外生存的真人秀节目在各大卫视频繁播放。某节目中野外生存达人用一个柠檬、一排铜钉和一排锌钉制作的水果电池用于野外生火。某同学感到好奇自己制作了一个这样的“超级柠檬电池”。
(1)该电池的电池反应是什么?
(2)若用铁片代替锌片LED灯能不能亮?若用铁片代替铜片呢?
(3)若用银片代替锌片LED灯能不能亮?
(4)由上面分析可知构成原电池的条件有哪些?
答案:(1)该电池利用了金属锌与酸的反应,离子方程式为Zn+2H+===Zn2++H2↑。
(2)若用铁片代替锌片,由于铁能与酸反应,LED灯仍然能亮;若用铁片代替铜片,由于锌比铁活泼,仍然发生反应Zn+2H+===Zn2++H2↑,LED灯仍然能亮。
(3)不能。银片代替锌片,银和铜都不能与酸反应,无电流产生,LED灯不亮。
(4)①两个活泼性不同的金属电极或金属与石墨;②电解质溶液;③闭合回路;④自发进行的氧化还原反应。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
