不同类型的晶体(32PPT)
图片预览








文档简介
课件32张PPT。重203克拉的“千年星”钻石
天然紫红钻石
中国第一钻 常林钻石 (约158克拉)
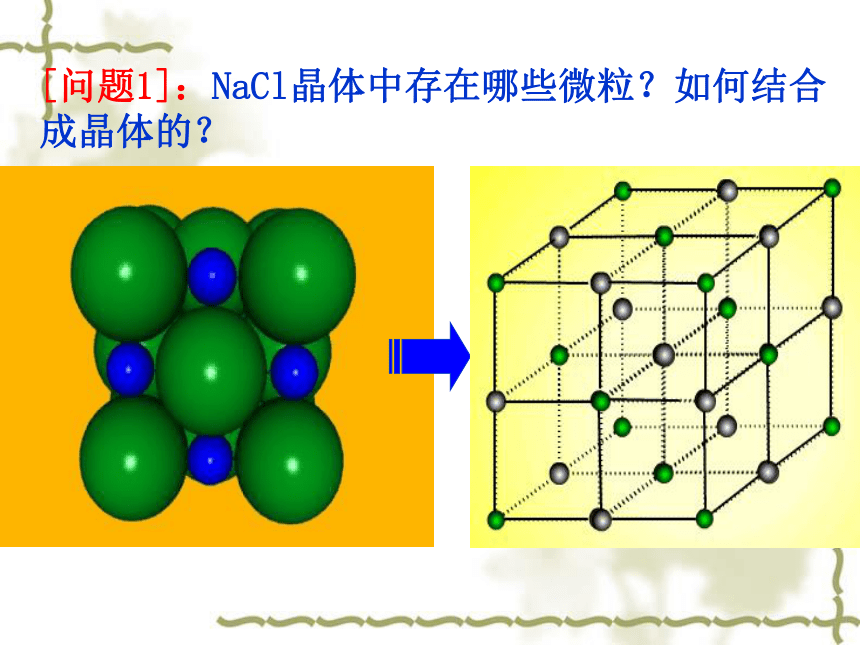
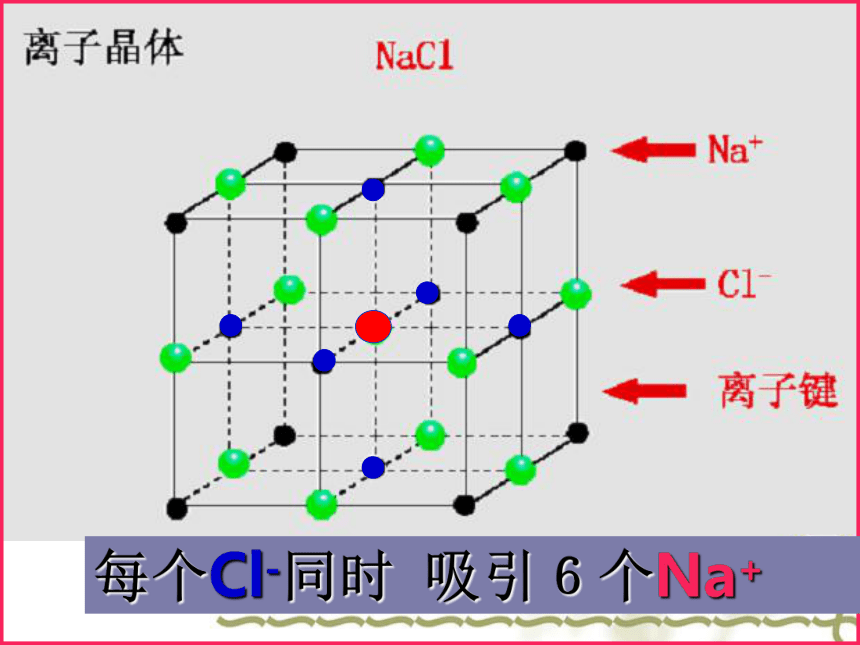
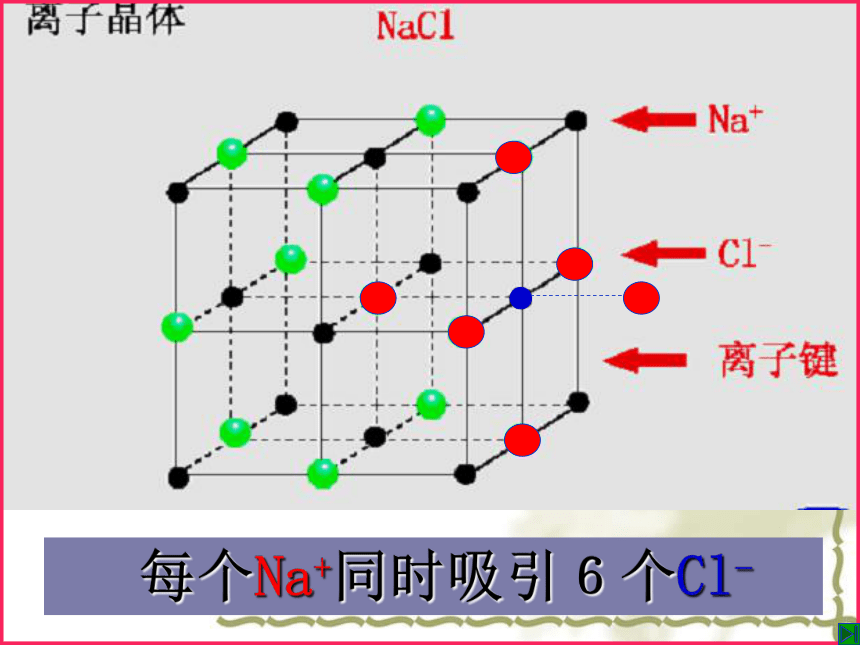
金 刚 石天然紫水晶水 晶食盐晶体雪花金刚石---像上述这些有规则的几何外形的固体物质,称为晶体。不同类型的晶体[问题1]:NaCl晶体中存在哪些微粒?如何结合成晶体的?每个Cl-同时 吸引6个Na+ 每个Na+同时吸引6个Cl-[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。 不存在Na+Cl-离子1:1晶体中钠离子与氯离子个数比为1:1一、离子晶体1、概念:由阴阳离子通过离子键结合而成的晶体。 4、物质类别:
大部分的盐、可溶性强碱、某些金属氧化物都形成离子晶体(离子化合物)。3、共同的物理性质:具有较高的熔点和沸点,晶体熔融后能导电(共价键没有被破坏),质地略硬而脆。2、结构特点
(1)阴阳离子有规则的排列
(2)在晶体中,不存在单个分子(3)阴阳离子有确定的个数比
离子所带电荷数越多,阴、阳离子半径越小 , 离子键越强,熔沸点越高 。
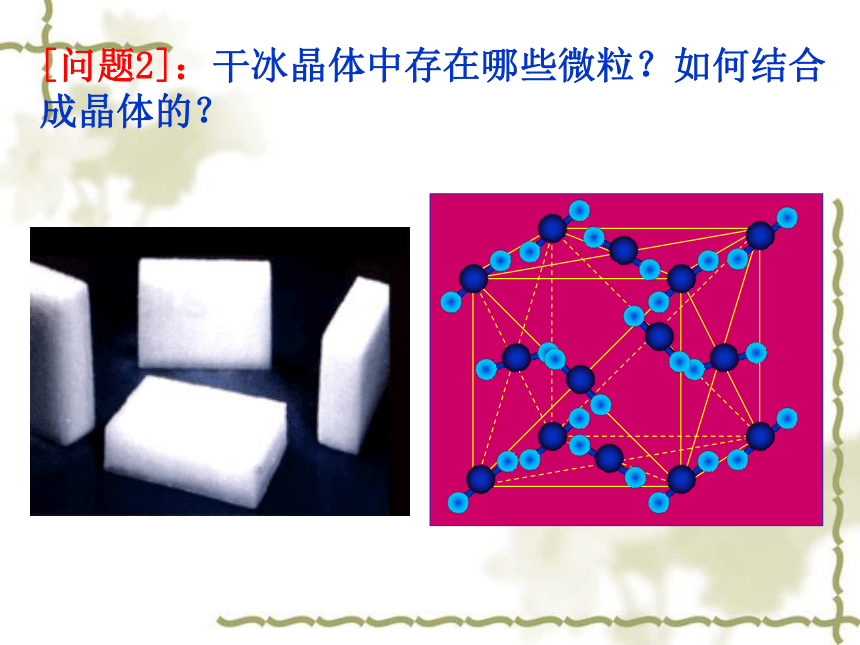
[问题2]:干冰晶体中存在哪些微粒?如何结合成晶体的?[小结]:在CO2晶体中, (填存在或不存在)分子, 存在许多 ,
以 相结合, CO2表示的含义
是 。存在 CO2分子分子间作用力一个二氧化碳分子由一个碳原子和两个氧原子构成。1、概念:
分子间以分子间作用力相结合的晶体。2、结构特点:
二、分子晶体(1)在晶体中存在单个分子(2)分子有规则地排列(3)分子间作用力较弱4、物质类别:
大多数共价型的非金属单质和化合物分子,可形成分子晶体。(室温下所有的气态物质、易挥发的液体,在一定条件下,都可形成分子晶体。此外,易熔化、易升华的固体也都是分子晶体。) 3、共同的物理性质: 一般都是绝缘体,熔融状态也不导电。一般硬度较小,具有较低的熔点和沸点,并有较大的挥发性。 组成结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。 讨论:CO2和SiO2的一些物理性质(如下表)有很大差异,为什么?熔 点沸 点干 冰(CO2)-56.2℃-78.4℃SiO21723℃2230℃109o28′Sio二氧化硅的晶体结构示意图共价键[问题3]:碳和硅同属第ⅣA族, CO2是分子晶体,SiO2是分子晶体吗?[小结]:在SiO2晶体中, (填存在或不存在)分子, 存在许多 和 ,
以 键相结合, SiO2表示的含义是 。不存在硅原子氧原子共价键SiO2晶体中硅原子与氧原子个数比为1:2三、原子晶体
1、概念:相邻原子间以共价键结合而形成空间网状结构的晶体。
2、结构特点(1)在晶体中,不存在单个分子
(2)原子通过共价键形成空间网状结构4、物质类别:
一些特殊的单质(金刚石、硅等)和化合物(二氧化硅和碳化硅等)都是原子晶体。 3、共同的物理性质: 很高的熔、沸点 ,不导电 ,硬度大 ,难溶于常见溶剂 。原子半径越小→键长越短→键能越大熔沸点越高 ☆你会比较金刚石、硅和碳化硅的 熔、沸点 高低吗?109o28′金刚石的晶体结构示意图共价键返回晶
体
硅石墨晶体——过渡型晶体或混合型晶体石墨晶体属于过渡型(混合型)晶体,每一个C原子与3个C原子以共价键相连,但分子间又存在分子间作用力。四、石墨石墨为什么很软?
石墨为层状结构,各层之间是分子间作用力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。—混合型晶体◆石墨的熔沸点为什么很高?五、金属晶体1、概念:通过金属阳离子与自由电子之间的较强的相互作用形成的晶体。 4、物质类别:金属单质都是金属晶体。 3、共同的物理性质:导电性、导热性、延展性 。2、结构特点:
(1)在晶体中,不存在单个分子
(2)金属阳离子被自由电子所包围 金属键:金属阳离子和自由电子之间的较强的相互作用。金属阳离子半径越小,电荷数越大,金属键越强,该金属的熔点越高。
金属晶体金属阳离子自由电子金属的延展性金属阳离子自由电子阴阳离子 分子 原子 金属阳离子
和自由电子 离子键 分子间作用力或氢键 共价键 金属键 破坏
离子键 只削弱分子间作用力或氢键,不破坏分子内的化学键破坏
共价键 破坏金属键 六、晶体类型的判断从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:化合物就是离子晶体)
从组成上判断:(仅限于中学一般情况):
∝金属单质:金属晶体
化合物中有无金属阳离子或者铵根离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。晶体的导电性:离子晶体固态时不导电,水溶液中或熔融状态下导电;
分子晶体不导电,但有些分子晶体溶于水后导电;
原子晶体不导电;金属晶体任何状态都导电。稀有气体是单原子分子,构成分子晶体,晶体中不存在化学键,只存在分子间作用力。稀有气体的特殊性:小结2:晶体熔沸点高低的判断 ⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外) ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 组成相似的离子晶体阴、阳离子半径和越小熔沸点越高 ②原子晶体: 原子半径越小→键长越短→键能越大熔沸点越高 ③分子晶体: 相对分子质量越大熔沸点越高 组成和结构相似的分子晶体 ④金属晶体: 金属阳离子半径越小,电荷数越高熔沸点越高 2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 KOH、 金刚石、
醋酸、 尿素、 水晶、 Na2OC课 堂 练 习4.下列物质性质的变化规律,与共价键的键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的稳定性依次减弱C.金刚石的硬度、熔沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次 降低 BC
天然紫红钻石
中国第一钻 常林钻石 (约158克拉)
金 刚 石天然紫水晶水 晶食盐晶体雪花金刚石---像上述这些有规则的几何外形的固体物质,称为晶体。不同类型的晶体[问题1]:NaCl晶体中存在哪些微粒?如何结合成晶体的?每个Cl-同时 吸引6个Na+ 每个Na+同时吸引6个Cl-[小结]:在NaCl晶体中, (填存在或不存在)分子,存在许多 离子和 离子,以 键相结合,阴阳离子的个数比为 ,因此NaCl表示的含义是 。 不存在Na+Cl-离子1:1晶体中钠离子与氯离子个数比为1:1一、离子晶体1、概念:由阴阳离子通过离子键结合而成的晶体。 4、物质类别:
大部分的盐、可溶性强碱、某些金属氧化物都形成离子晶体(离子化合物)。3、共同的物理性质:具有较高的熔点和沸点,晶体熔融后能导电(共价键没有被破坏),质地略硬而脆。2、结构特点
(1)阴阳离子有规则的排列
(2)在晶体中,不存在单个分子(3)阴阳离子有确定的个数比
离子所带电荷数越多,阴、阳离子半径越小 , 离子键越强,熔沸点越高 。
[问题2]:干冰晶体中存在哪些微粒?如何结合成晶体的?[小结]:在CO2晶体中, (填存在或不存在)分子, 存在许多 ,
以 相结合, CO2表示的含义
是 。存在 CO2分子分子间作用力一个二氧化碳分子由一个碳原子和两个氧原子构成。1、概念:
分子间以分子间作用力相结合的晶体。2、结构特点:
二、分子晶体(1)在晶体中存在单个分子(2)分子有规则地排列(3)分子间作用力较弱4、物质类别:
大多数共价型的非金属单质和化合物分子,可形成分子晶体。(室温下所有的气态物质、易挥发的液体,在一定条件下,都可形成分子晶体。此外,易熔化、易升华的固体也都是分子晶体。) 3、共同的物理性质: 一般都是绝缘体,熔融状态也不导电。一般硬度较小,具有较低的熔点和沸点,并有较大的挥发性。 组成结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。 讨论:CO2和SiO2的一些物理性质(如下表)有很大差异,为什么?熔 点沸 点干 冰(CO2)-56.2℃-78.4℃SiO21723℃2230℃109o28′Sio二氧化硅的晶体结构示意图共价键[问题3]:碳和硅同属第ⅣA族, CO2是分子晶体,SiO2是分子晶体吗?[小结]:在SiO2晶体中, (填存在或不存在)分子, 存在许多 和 ,
以 键相结合, SiO2表示的含义是 。不存在硅原子氧原子共价键SiO2晶体中硅原子与氧原子个数比为1:2三、原子晶体
1、概念:相邻原子间以共价键结合而形成空间网状结构的晶体。
2、结构特点(1)在晶体中,不存在单个分子
(2)原子通过共价键形成空间网状结构4、物质类别:
一些特殊的单质(金刚石、硅等)和化合物(二氧化硅和碳化硅等)都是原子晶体。 3、共同的物理性质: 很高的熔、沸点 ,不导电 ,硬度大 ,难溶于常见溶剂 。原子半径越小→键长越短→键能越大熔沸点越高 ☆你会比较金刚石、硅和碳化硅的 熔、沸点 高低吗?109o28′金刚石的晶体结构示意图共价键返回晶
体
硅石墨晶体——过渡型晶体或混合型晶体石墨晶体属于过渡型(混合型)晶体,每一个C原子与3个C原子以共价键相连,但分子间又存在分子间作用力。四、石墨石墨为什么很软?
石墨为层状结构,各层之间是分子间作用力结合,容易滑动,所以石墨很软。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。—混合型晶体◆石墨的熔沸点为什么很高?五、金属晶体1、概念:通过金属阳离子与自由电子之间的较强的相互作用形成的晶体。 4、物质类别:金属单质都是金属晶体。 3、共同的物理性质:导电性、导热性、延展性 。2、结构特点:
(1)在晶体中,不存在单个分子
(2)金属阳离子被自由电子所包围 金属键:金属阳离子和自由电子之间的较强的相互作用。金属阳离子半径越小,电荷数越大,金属键越强,该金属的熔点越高。
金属晶体金属阳离子自由电子金属的延展性金属阳离子自由电子阴阳离子 分子 原子 金属阳离子
和自由电子 离子键 分子间作用力或氢键 共价键 金属键 破坏
离子键 只削弱分子间作用力或氢键,不破坏分子内的化学键破坏
共价键 破坏金属键 六、晶体类型的判断从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:化合物就是离子晶体)
从组成上判断:(仅限于中学一般情况):
∝金属单质:金属晶体
化合物中有无金属阳离子或者铵根离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。晶体的导电性:离子晶体固态时不导电,水溶液中或熔融状态下导电;
分子晶体不导电,但有些分子晶体溶于水后导电;
原子晶体不导电;金属晶体任何状态都导电。稀有气体是单原子分子,构成分子晶体,晶体中不存在化学键,只存在分子间作用力。稀有气体的特殊性:小结2:晶体熔沸点高低的判断 ⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外) ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 组成相似的离子晶体阴、阳离子半径和越小熔沸点越高 ②原子晶体: 原子半径越小→键长越短→键能越大熔沸点越高 ③分子晶体: 相对分子质量越大熔沸点越高 组成和结构相似的分子晶体 ④金属晶体: 金属阳离子半径越小,电荷数越高熔沸点越高 2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 KOH、 金刚石、
醋酸、 尿素、 水晶、 Na2OC课 堂 练 习4.下列物质性质的变化规律,与共价键的键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.HF、HCl、HBr、HI的稳定性依次减弱C.金刚石的硬度、熔沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次 降低 BC
