5.2.3 硝酸 课件 (21张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3 硝酸 课件 (21张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 09:33:45 | ||
图片预览








文档简介
(共21张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
第三课时 硝酸 酸雨及防治
无锡某国道上,一辆运送浓硝酸的铝槽罐车发生侧翻,现场可闻到刺鼻的气味,弥漫着大量的红棕色烟雾。消防人员立即喷水稀释,并用碱水泼洒处理,以防止其扩散,污染环境。
一、物理性质
纯净的硝酸是无色、易挥发、有刺激性气味的液体,沸点为83℃,密度比水大,易溶于水,能与水以任意比互溶。
常用的浓硝酸质量分数约为69%,95%以上的浓硝酸在空气中挥发出硝酸蒸汽从而产生“发烟”现象,通常叫做“发烟硝酸”。
在空气中遇水蒸气呈“白雾”状
视频中硝酸泄漏产生的红棕色气体是什么?
为什么会产生这种气体?
思考:
二、化学性质
1. 不稳定性
思考:实验室中如何保存浓硝酸?
保存在棕色试剂瓶中,放置在阴凉处
练一练
在实验室中,不需要储存在棕色试剂瓶中的药品是( )
A.浓硝酸 B.浓盐酸 C.氯水 D.稀硝酸
B
2. 强酸性
结合酸的通性,写出下列方程式:
(1)硝酸与氧化铜反应
(2)硝酸与碳酸钙反应
(3)硝酸与氢氧化钡反应
(4)硝酸与锌反应
为什么用碱水处理现场?
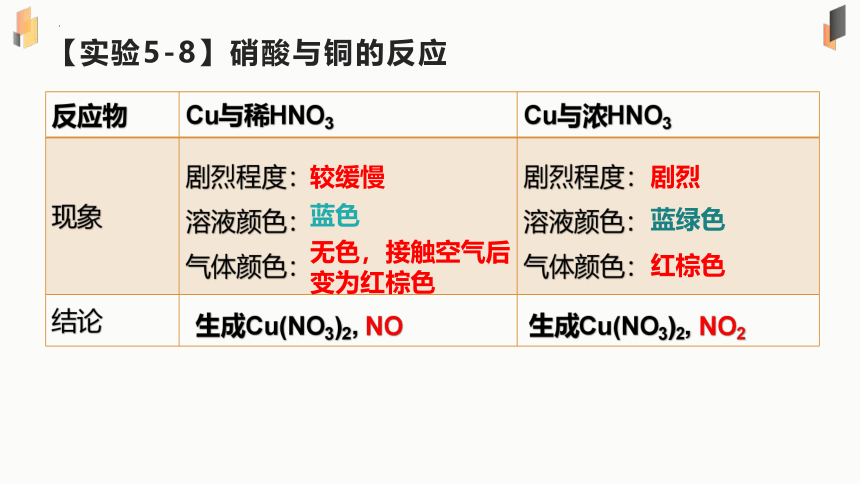
【实验5-8】硝酸与铜的反应
反应物 Cu与稀HNO3 Cu与浓HNO3
现象 剧烈程度: 溶液颜色: 气体颜色: 剧烈程度:
溶液颜色:
气体颜色:
结论
较缓慢
红棕色
剧烈
蓝绿色
无色,接触空气后变为红棕色
蓝色
生成Cu(NO3)2, NO
生成Cu(NO3)2, NO2
① 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
② Cu+4HNO3(浓) = Cu(NO3)2 +2NO2↑+2H2O
思考:
(1)以上反应中,HNO3表现了什么性质?
氧化剂与还原剂的物质的量之比分别是多少?
(2)HNO3的还原产物有什么特点?
(3)结合实验现象,想一想浓稀HNO3哪个氧化性更强?
实验操作 现象
将稀硝酸滴入紫色石蕊溶液中
将浓硝酸滴入紫色石蕊溶液中
将稀硝酸与浓硝酸分别滴到紫色石蕊试液中
溶液变为红色
溶液先变红后褪色
【小资料】工业上采用铁罐或铝罐储存或运输大量
浓硝酸或浓硫酸,这是为什么?
常温下,铁、铝的表面被浓硝酸或浓硫酸氧化,生成了一层致密的氧化薄膜从而钝化,保护内层金属不再与酸反应。
钝化是不是没发生反应?
(1)与金属反应
硝酸具有强氧化性,能与大多数金属反应(金、铂除外)
活泼金属与硝酸反应不产生H2,硝酸的浓度不同,还原产物不同。
硝酸与金属反应时,一般既表现强氧化性,又表现酸性。
常温下,浓硝酸能使铁铝发生钝化,但在加热下,可继续反应。
2. 强氧化性
波尔巧藏诺贝尔金奖章
二次世界大战中,德国法西斯占领了丹麦,下达了逮捕著名科学家诺贝尔奖获得者波尔的命令。波尔被迫离开自己的祖国,为了表示他一定要返回祖国的决心和防止诺贝尔金质奖章落入法西斯手中,他机智地将金质奖章溶解在一种特殊的液体中,在纳粹分子的眼皮底下巧妙地珍藏了好几年,直至战争结束,波尔重返家园,从溶液中还原提取出金,并重新铸成奖章。“你们知道这种能溶解金的溶液是什么吗?”
王水:
浓硝酸与浓盐酸的体积比为1:3,能溶解一些不溶于硝酸的金属如金、铂。
想一想
加热盛有浓硝酸和木炭的试管,木炭被氧化成稳定的氧化物,硝酸被还原为红棕色气体。
1.写出此反应的化学方程式。
2.分析此反应中氧化剂与还原剂物质的量之比。
C + 4HNO3(浓) = 4NO2↑ + CO2 ↑ + 2H2O
(2)与非金属反应
浓硝酸可在加热条件下与非金属反应
C + 4HNO3(浓) = 4NO2↑ + CO2 ↑ + 2H2O
(3)与还原性物质反应
硝酸可以氧化具有还原性的化合物或离子.
如:HI、 HBr、 SO2 、Fe2+ 、FeO、 I- 、S2- 、SO32-
完成课本思考与讨论
酸雨及防治
酸雨是指pH小于 的雨水,主要是二氧化硫、氮氧化物溶于水最终形成 或 造成的,二氧化碳饱和溶液的pH约等于5.6,所以二氧化碳溶于水不会形成酸雨。
5.6
硝酸
硫酸
1. 为除去镀在铝表面的铜镀层,可选用的试剂是( )
A.稀硝酸 B.浓硝酸 C.稀硫酸 D.浓盐酸
B
课后检测
硝酸被称为“国防工业之母”,它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
D
将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
B
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
第三课时 硝酸 酸雨及防治
无锡某国道上,一辆运送浓硝酸的铝槽罐车发生侧翻,现场可闻到刺鼻的气味,弥漫着大量的红棕色烟雾。消防人员立即喷水稀释,并用碱水泼洒处理,以防止其扩散,污染环境。
一、物理性质
纯净的硝酸是无色、易挥发、有刺激性气味的液体,沸点为83℃,密度比水大,易溶于水,能与水以任意比互溶。
常用的浓硝酸质量分数约为69%,95%以上的浓硝酸在空气中挥发出硝酸蒸汽从而产生“发烟”现象,通常叫做“发烟硝酸”。
在空气中遇水蒸气呈“白雾”状
视频中硝酸泄漏产生的红棕色气体是什么?
为什么会产生这种气体?
思考:
二、化学性质
1. 不稳定性
思考:实验室中如何保存浓硝酸?
保存在棕色试剂瓶中,放置在阴凉处
练一练
在实验室中,不需要储存在棕色试剂瓶中的药品是( )
A.浓硝酸 B.浓盐酸 C.氯水 D.稀硝酸
B
2. 强酸性
结合酸的通性,写出下列方程式:
(1)硝酸与氧化铜反应
(2)硝酸与碳酸钙反应
(3)硝酸与氢氧化钡反应
(4)硝酸与锌反应
为什么用碱水处理现场?
【实验5-8】硝酸与铜的反应
反应物 Cu与稀HNO3 Cu与浓HNO3
现象 剧烈程度: 溶液颜色: 气体颜色: 剧烈程度:
溶液颜色:
气体颜色:
结论
较缓慢
红棕色
剧烈
蓝绿色
无色,接触空气后变为红棕色
蓝色
生成Cu(NO3)2, NO
生成Cu(NO3)2, NO2
① 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
② Cu+4HNO3(浓) = Cu(NO3)2 +2NO2↑+2H2O
思考:
(1)以上反应中,HNO3表现了什么性质?
氧化剂与还原剂的物质的量之比分别是多少?
(2)HNO3的还原产物有什么特点?
(3)结合实验现象,想一想浓稀HNO3哪个氧化性更强?
实验操作 现象
将稀硝酸滴入紫色石蕊溶液中
将浓硝酸滴入紫色石蕊溶液中
将稀硝酸与浓硝酸分别滴到紫色石蕊试液中
溶液变为红色
溶液先变红后褪色
【小资料】工业上采用铁罐或铝罐储存或运输大量
浓硝酸或浓硫酸,这是为什么?
常温下,铁、铝的表面被浓硝酸或浓硫酸氧化,生成了一层致密的氧化薄膜从而钝化,保护内层金属不再与酸反应。
钝化是不是没发生反应?
(1)与金属反应
硝酸具有强氧化性,能与大多数金属反应(金、铂除外)
活泼金属与硝酸反应不产生H2,硝酸的浓度不同,还原产物不同。
硝酸与金属反应时,一般既表现强氧化性,又表现酸性。
常温下,浓硝酸能使铁铝发生钝化,但在加热下,可继续反应。
2. 强氧化性
波尔巧藏诺贝尔金奖章
二次世界大战中,德国法西斯占领了丹麦,下达了逮捕著名科学家诺贝尔奖获得者波尔的命令。波尔被迫离开自己的祖国,为了表示他一定要返回祖国的决心和防止诺贝尔金质奖章落入法西斯手中,他机智地将金质奖章溶解在一种特殊的液体中,在纳粹分子的眼皮底下巧妙地珍藏了好几年,直至战争结束,波尔重返家园,从溶液中还原提取出金,并重新铸成奖章。“你们知道这种能溶解金的溶液是什么吗?”
王水:
浓硝酸与浓盐酸的体积比为1:3,能溶解一些不溶于硝酸的金属如金、铂。
想一想
加热盛有浓硝酸和木炭的试管,木炭被氧化成稳定的氧化物,硝酸被还原为红棕色气体。
1.写出此反应的化学方程式。
2.分析此反应中氧化剂与还原剂物质的量之比。
C + 4HNO3(浓) = 4NO2↑ + CO2 ↑ + 2H2O
(2)与非金属反应
浓硝酸可在加热条件下与非金属反应
C + 4HNO3(浓) = 4NO2↑ + CO2 ↑ + 2H2O
(3)与还原性物质反应
硝酸可以氧化具有还原性的化合物或离子.
如:HI、 HBr、 SO2 、Fe2+ 、FeO、 I- 、S2- 、SO32-
完成课本思考与讨论
酸雨及防治
酸雨是指pH小于 的雨水,主要是二氧化硫、氮氧化物溶于水最终形成 或 造成的,二氧化碳饱和溶液的pH约等于5.6,所以二氧化碳溶于水不会形成酸雨。
5.6
硝酸
硫酸
1. 为除去镀在铝表面的铜镀层,可选用的试剂是( )
A.稀硝酸 B.浓硝酸 C.稀硫酸 D.浓盐酸
B
课后检测
硝酸被称为“国防工业之母”,它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是( )
A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性
B.不能用稀硝酸与锌反应制氢气——强氧化性
C.要用棕色瓶盛装浓硝酸——不稳定性
D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
D
将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
