5.1 硫及其化合物 第4课时 课件(29张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1 硫及其化合物 第4课时 课件(29张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
SO2、浓H2SO4的性质复习课
第4课时
第一节 硫及其化合物
1.了解SO2的制备、检验与鉴别。
2.深入探究SO2、H2SO4的综合实验。
1.SO2的制备及浓H2SO4的性质。
2.浓H2SO4的综合实验探究。
[学习目标]
[重点难点]
SO2与CO2的鉴别与除杂
1.SO2与CO2的鉴别
(1)单一气体的鉴别
①SO2的漂白性:使品红溶液褪色的是SO2,不褪色的是CO2。
②SO2的氧化性:通入H2S溶液变浑浊的是SO2,无明显现象的是CO2。
③SO2的还原性:通入酸性KMnO4溶液或溴水等有色氧化性物质中,使溶液褪色的是SO2,不褪色的是CO2。
能否使用澄清石灰水鉴别SO2与CO2
思考1
提示 不能,SO2和CO2都能使澄清石灰水变浑浊,继续通入过量的气体,沉淀都会消失,故不能用澄清石灰水鉴别。
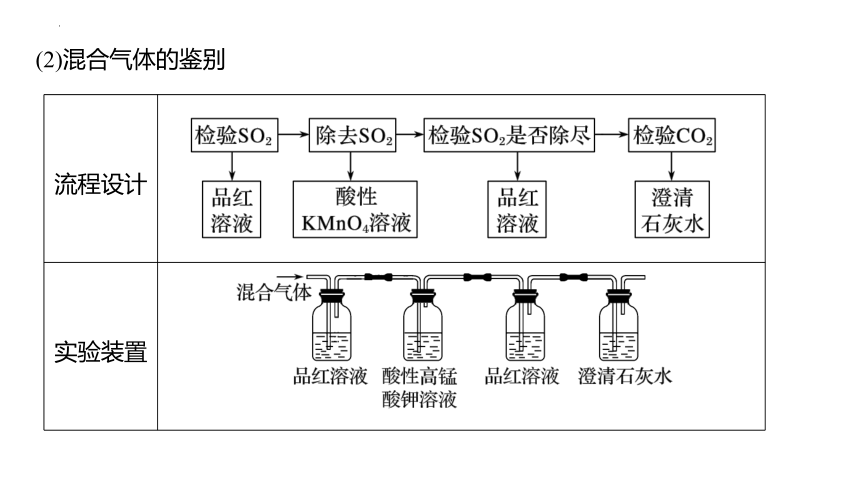
流程设计
实验装置
(2)混合气体的鉴别
上述装置中第二个盛放品红溶液的洗气瓶能否省略,若可以,有什么现象才能说明混合气体中含有CO2
思考2
提示 能省略,较浓的酸性KMnO4溶液颜色变浅,澄清的石灰水变浑浊,说明混合气体中含有CO2。
2.除去CO2中SO2的两种方法
(1)利用二氧化硫的还原性,用酸性高锰酸钾溶液、氯水、溴水等除去。
(2)利用亚硫酸的酸性比碳酸强,用饱和碳酸氢钠溶液除去。
下列溶液或用品中:①澄清石灰水;②氢硫酸;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是
A.①⑦ B.①⑤⑦
C.②③④⑤⑥ D.①⑤
练习1
√
SO2和CO2都属于酸性氧化物,与澄清石灰水反应分别生成CaSO3和CaCO3白色沉淀,均能使湿润的蓝色石蕊试纸变红,所以①⑦不能用来区别SO2和CO2;SO2具有氧化性,能将H2S氧化生成单质硫(有淡黄色沉淀生成);SO2具有还原性,能被酸性KMnO4溶液和溴水氧化(溶液褪色),能和Ba(NO3)2溶液反应生成BaSO4沉淀;SO2具有漂白性,能使品红溶液褪色,而CO2没有这些性质。
练习2
现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净、干燥的CO2气体。
(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是____(填字母,下同)。
A.dcabh B.efabg C.feabg
B
(2)本实验除去SO2的原理是利用SO2的____。
A.氧化性 B.漂白性
C.还原性 D.酸性
(3)SO2与酸性高锰酸钾溶液反应的离子方程式是_________________________
______________________。
C
根据题中所给装置,应将混有少量SO2杂质的CO2气体通过酸性高锰酸钾溶液除去二氧化硫,然后用浓硫酸干燥,最后用向上排空气法收集干燥的二氧化碳。
SO2的制备及综合实验探究
1.SO2的制备
(1)实验室可用亚硫酸钠与浓硫酸反应制取二氧化硫。
①反应原理:Na2SO3+H2SO4(浓)===SO2↑+Na2SO4+H2O。
②实验装置
(2)实验室也可用铜与浓硫酸加热制取二氧化硫。
①反应原理: 。
②制备装置、性质验证及尾气处理
2.综合实验探究
利用浓H2SO4制备SO2组成实验装置图,然后对SO2的检验和性质进行探究,侧重考查SO2的漂白性、还原性和氧化性,SO2的鉴别及探究性创新实验题。
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与结论相符的是
练习1
选项 ① ② 预测②中现象 实验结论
A 浓硫酸 浓盐酸 产生大量气体 硫酸的酸性比盐酸强
B 浓硫酸 铜片 铜片溶解,产生气泡,底部产生灰白色粉末 浓硫酸表现酸性和强氧化性
C 浓硫酸 CuSO4· 5H2O 固体由蓝色变为白色 浓硫酸具有吸水性,发生物理变化
D 浓硫酸 蔗糖 固体由白色变为黑色海绵状,并有刺激性气味气体放出 浓硫酸具有脱水性、氧化性
√
练习2
如图所示是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。
下列关于此实验的现象、解释或结论以及对应关系均正确的是
选项 现象 解释或结论
A a处黄色褪去 氧化性:SO2>Br2
B b处变为红色 二氧化硫与水反应生成酸性物质
C c处变为蓝色 二氧化硫具有一定的氧化性
D d处红色先褪去后恢复 二氧化硫具有漂白性且漂白性不稳定
√
1.要除去混在CO2气体中少量的SO2,最好让气体通过
A.Na2CO3溶液 B.溴水
C.NaOH溶液 D.饱和NaHCO3溶液
√
1
2
3
自我测试
4
碳酸钠能与二氧化碳发生反应,故A错误;
二氧化硫与溴水发生氧化还原反应,但溴在水中的溶解度较小,溴水中Br2的含量较小,不是最好的除去二氧化硫的方法,故B错误;
二氧化碳、二氧化硫都能与氢氧化钠溶液发生反应,故C错误;
二氧化硫与饱和碳酸氢钠溶液反应生成二氧化碳,二氧化碳与碳酸氢钠不反应,且在饱和碳酸氢钠溶液中溶解度不大,所以可以除去二氧化硫,故D正确。
1
2
3
自我测试
4
A.0.1 mol Cu与足量的S充分反应,生成
物的质量比铜单质的质量增加了1.6 g
B.如图是铜与浓硫酸反应的实验装置,B
中盛装的是浓硫酸,作用是干燥SO2
C.Cu投入稀硫酸中加热,没有明显变化,加入一定量的H2O2溶液,金属Cu逐
渐溶解,反应中H2O2起催化作用
D.向铜与浓硫酸反应后的混合液中加水,判断有无Cu2+生成
2.下列有关含硫物质转化判断正确的是
√
自我测试
1
2
3
4
Cu与S混合加热发生反应产生Cu2S,Cu的物质的量是0.1 mol,则反应产生0.05 mol Cu2S,消耗S的物质的量是0.05 mol,因此生成物比铜单质增加的质量为0.05 mol×32 g·mol-1=1.6 g,A正确;
自我测试
1
2
3
4
在铜与浓硫酸反应的实验装置中,B中盛装的应该是饱和NaHSO3溶液,作用是储存SO2,并可用作安全瓶防止倒吸,B错误;
H2O2溶液具有强氧化性,在酸性条件下将Cu氧化为Cu2+,反应的化学方程式为Cu+H2O2+H2SO4===CuSO4+2H2O,在该反应中H2O2的作用是氧化剂,C错误;
自我测试
1
2
3
4
反应后混合液中含有大量浓硫酸,应该待混合液冷却后,取少量混合液缓缓倒入盛有水的容器中,根据溶液是否呈现蓝色,确定其中是否含有Cu2+,D错误。
3.如图是实验室进行二氧化硫制备与性质实验探究的组合装置,部分固定装置未画出。下列有关说法正确的是
B.关闭K1,打开K2,试剂X是酸性KMnO4溶液或FeCl3溶液,均可证明SO2有还
原性
C.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
A.关闭K2,打开K1,滴加硫酸,则装
置B中每消耗1 mol Na2O2,转移电
子数为NA
√
自我测试
1
2
3
4
自我测试
1
2
3
装置B中发生的反应为SO2+Na2O2===
Na2SO4,则每消耗1 mol Na2O2,转移电子数为2NA,A项错误;
4
关闭K1,打开K2,试剂X是酸性KMnO4溶液或FeCl3溶液,产生的二氧化硫能使酸性KMnO4溶液褪色或FeCl3溶液由黄色变为浅绿色,均可证明SO2有还原性,B项正确;
为防止环境污染,装置C和E中的试剂均取用浓的氢氧化钠溶液,保证将未反应的二氧化硫吸收完全,C项错误;
实验过程中体现了硫酸的酸性、难挥发性,D项错误。
4.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
自我测试
1
2
3
4
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式为_________________________________________。
蒸馏烧瓶
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(2)实验过程中,装置B、C中发生的现象分别是______________________、
______________。
溶液由紫红色变为无色
自我测试
1
2
3
4
出现黄色浑浊
酸性KMnO4溶液为紫红色,具有氧化性,通入SO2观察到装置B中溶液由紫红色逐渐变浅直至无色。SO2通入Na2S溶液,会反应生成硫沉淀,则装置C中出现黄色浑浊。
(3)装置D的作用是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象:
______________________________________________________________________________。
(4)尾气可用________溶液吸收。
自我测试
1
2
3
4
待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复为红色
NaOH
SO2、浓H2SO4的性质复习课
第4课时
第一节 硫及其化合物
1.了解SO2的制备、检验与鉴别。
2.深入探究SO2、H2SO4的综合实验。
1.SO2的制备及浓H2SO4的性质。
2.浓H2SO4的综合实验探究。
[学习目标]
[重点难点]
SO2与CO2的鉴别与除杂
1.SO2与CO2的鉴别
(1)单一气体的鉴别
①SO2的漂白性:使品红溶液褪色的是SO2,不褪色的是CO2。
②SO2的氧化性:通入H2S溶液变浑浊的是SO2,无明显现象的是CO2。
③SO2的还原性:通入酸性KMnO4溶液或溴水等有色氧化性物质中,使溶液褪色的是SO2,不褪色的是CO2。
能否使用澄清石灰水鉴别SO2与CO2
思考1
提示 不能,SO2和CO2都能使澄清石灰水变浑浊,继续通入过量的气体,沉淀都会消失,故不能用澄清石灰水鉴别。
流程设计
实验装置
(2)混合气体的鉴别
上述装置中第二个盛放品红溶液的洗气瓶能否省略,若可以,有什么现象才能说明混合气体中含有CO2
思考2
提示 能省略,较浓的酸性KMnO4溶液颜色变浅,澄清的石灰水变浑浊,说明混合气体中含有CO2。
2.除去CO2中SO2的两种方法
(1)利用二氧化硫的还原性,用酸性高锰酸钾溶液、氯水、溴水等除去。
(2)利用亚硫酸的酸性比碳酸强,用饱和碳酸氢钠溶液除去。
下列溶液或用品中:①澄清石灰水;②氢硫酸;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是
A.①⑦ B.①⑤⑦
C.②③④⑤⑥ D.①⑤
练习1
√
SO2和CO2都属于酸性氧化物,与澄清石灰水反应分别生成CaSO3和CaCO3白色沉淀,均能使湿润的蓝色石蕊试纸变红,所以①⑦不能用来区别SO2和CO2;SO2具有氧化性,能将H2S氧化生成单质硫(有淡黄色沉淀生成);SO2具有还原性,能被酸性KMnO4溶液和溴水氧化(溶液褪色),能和Ba(NO3)2溶液反应生成BaSO4沉淀;SO2具有漂白性,能使品红溶液褪色,而CO2没有这些性质。
练习2
现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净、干燥的CO2气体。
(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是____(填字母,下同)。
A.dcabh B.efabg C.feabg
B
(2)本实验除去SO2的原理是利用SO2的____。
A.氧化性 B.漂白性
C.还原性 D.酸性
(3)SO2与酸性高锰酸钾溶液反应的离子方程式是_________________________
______________________。
C
根据题中所给装置,应将混有少量SO2杂质的CO2气体通过酸性高锰酸钾溶液除去二氧化硫,然后用浓硫酸干燥,最后用向上排空气法收集干燥的二氧化碳。
SO2的制备及综合实验探究
1.SO2的制备
(1)实验室可用亚硫酸钠与浓硫酸反应制取二氧化硫。
①反应原理:Na2SO3+H2SO4(浓)===SO2↑+Na2SO4+H2O。
②实验装置
(2)实验室也可用铜与浓硫酸加热制取二氧化硫。
①反应原理: 。
②制备装置、性质验证及尾气处理
2.综合实验探究
利用浓H2SO4制备SO2组成实验装置图,然后对SO2的检验和性质进行探究,侧重考查SO2的漂白性、还原性和氧化性,SO2的鉴别及探究性创新实验题。
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与结论相符的是
练习1
选项 ① ② 预测②中现象 实验结论
A 浓硫酸 浓盐酸 产生大量气体 硫酸的酸性比盐酸强
B 浓硫酸 铜片 铜片溶解,产生气泡,底部产生灰白色粉末 浓硫酸表现酸性和强氧化性
C 浓硫酸 CuSO4· 5H2O 固体由蓝色变为白色 浓硫酸具有吸水性,发生物理变化
D 浓硫酸 蔗糖 固体由白色变为黑色海绵状,并有刺激性气味气体放出 浓硫酸具有脱水性、氧化性
√
练习2
如图所示是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。
下列关于此实验的现象、解释或结论以及对应关系均正确的是
选项 现象 解释或结论
A a处黄色褪去 氧化性:SO2>Br2
B b处变为红色 二氧化硫与水反应生成酸性物质
C c处变为蓝色 二氧化硫具有一定的氧化性
D d处红色先褪去后恢复 二氧化硫具有漂白性且漂白性不稳定
√
1.要除去混在CO2气体中少量的SO2,最好让气体通过
A.Na2CO3溶液 B.溴水
C.NaOH溶液 D.饱和NaHCO3溶液
√
1
2
3
自我测试
4
碳酸钠能与二氧化碳发生反应,故A错误;
二氧化硫与溴水发生氧化还原反应,但溴在水中的溶解度较小,溴水中Br2的含量较小,不是最好的除去二氧化硫的方法,故B错误;
二氧化碳、二氧化硫都能与氢氧化钠溶液发生反应,故C错误;
二氧化硫与饱和碳酸氢钠溶液反应生成二氧化碳,二氧化碳与碳酸氢钠不反应,且在饱和碳酸氢钠溶液中溶解度不大,所以可以除去二氧化硫,故D正确。
1
2
3
自我测试
4
A.0.1 mol Cu与足量的S充分反应,生成
物的质量比铜单质的质量增加了1.6 g
B.如图是铜与浓硫酸反应的实验装置,B
中盛装的是浓硫酸,作用是干燥SO2
C.Cu投入稀硫酸中加热,没有明显变化,加入一定量的H2O2溶液,金属Cu逐
渐溶解,反应中H2O2起催化作用
D.向铜与浓硫酸反应后的混合液中加水,判断有无Cu2+生成
2.下列有关含硫物质转化判断正确的是
√
自我测试
1
2
3
4
Cu与S混合加热发生反应产生Cu2S,Cu的物质的量是0.1 mol,则反应产生0.05 mol Cu2S,消耗S的物质的量是0.05 mol,因此生成物比铜单质增加的质量为0.05 mol×32 g·mol-1=1.6 g,A正确;
自我测试
1
2
3
4
在铜与浓硫酸反应的实验装置中,B中盛装的应该是饱和NaHSO3溶液,作用是储存SO2,并可用作安全瓶防止倒吸,B错误;
H2O2溶液具有强氧化性,在酸性条件下将Cu氧化为Cu2+,反应的化学方程式为Cu+H2O2+H2SO4===CuSO4+2H2O,在该反应中H2O2的作用是氧化剂,C错误;
自我测试
1
2
3
4
反应后混合液中含有大量浓硫酸,应该待混合液冷却后,取少量混合液缓缓倒入盛有水的容器中,根据溶液是否呈现蓝色,确定其中是否含有Cu2+,D错误。
3.如图是实验室进行二氧化硫制备与性质实验探究的组合装置,部分固定装置未画出。下列有关说法正确的是
B.关闭K1,打开K2,试剂X是酸性KMnO4溶液或FeCl3溶液,均可证明SO2有还
原性
C.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
A.关闭K2,打开K1,滴加硫酸,则装
置B中每消耗1 mol Na2O2,转移电
子数为NA
√
自我测试
1
2
3
4
自我测试
1
2
3
装置B中发生的反应为SO2+Na2O2===
Na2SO4,则每消耗1 mol Na2O2,转移电子数为2NA,A项错误;
4
关闭K1,打开K2,试剂X是酸性KMnO4溶液或FeCl3溶液,产生的二氧化硫能使酸性KMnO4溶液褪色或FeCl3溶液由黄色变为浅绿色,均可证明SO2有还原性,B项正确;
为防止环境污染,装置C和E中的试剂均取用浓的氢氧化钠溶液,保证将未反应的二氧化硫吸收完全,C项错误;
实验过程中体现了硫酸的酸性、难挥发性,D项错误。
4.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
自我测试
1
2
3
4
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式为_________________________________________。
蒸馏烧瓶
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(2)实验过程中,装置B、C中发生的现象分别是______________________、
______________。
溶液由紫红色变为无色
自我测试
1
2
3
4
出现黄色浑浊
酸性KMnO4溶液为紫红色,具有氧化性,通入SO2观察到装置B中溶液由紫红色逐渐变浅直至无色。SO2通入Na2S溶液,会反应生成硫沉淀,则装置C中出现黄色浑浊。
(3)装置D的作用是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象:
______________________________________________________________________________。
(4)尾气可用________溶液吸收。
自我测试
1
2
3
4
待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复为红色
NaOH
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
