化学人教版(2019)选择性必修2 3.3金属和离子晶体(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3金属和离子晶体(共33张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 00:00:00 | ||
图片预览



文档简介
(共33张PPT)
§ 3.3 金属晶体与离子晶体
第三章 晶体结构与性质
一、金属的分类
1、分类依据:根据组成晶体的微粒及微粒之间的相互作用
晶体类型 构成微粒 微粒间的相互作用 实例
离子晶体 ___________ ______ NaCl
金属晶体 _________、 ________ _______ 铜
原子晶体 ____ _______ 金刚石
分子晶体 ____ ___________ 冰
注意:由原子构成的晶体不一定都是原子晶体,稀有气体是单原子分子
2、微粒间作用的强弱
熔融状态需要破坏的作用力:
原子晶体熔融需破坏共价键
离子晶体熔融需破坏离子键
金属晶体熔融需破坏金属键
分子晶体熔融需破坏氢键或范德华力
微粒之间相互作用的强弱:
化学键 > 氢键 > 范德华力
熔沸点一般规律:原子晶体 > 离子晶体 > 分子晶体
金属晶体的熔沸点差别很大,有的很高:例如钨、铂,有的熔沸点很低:例如汞、铯、镓
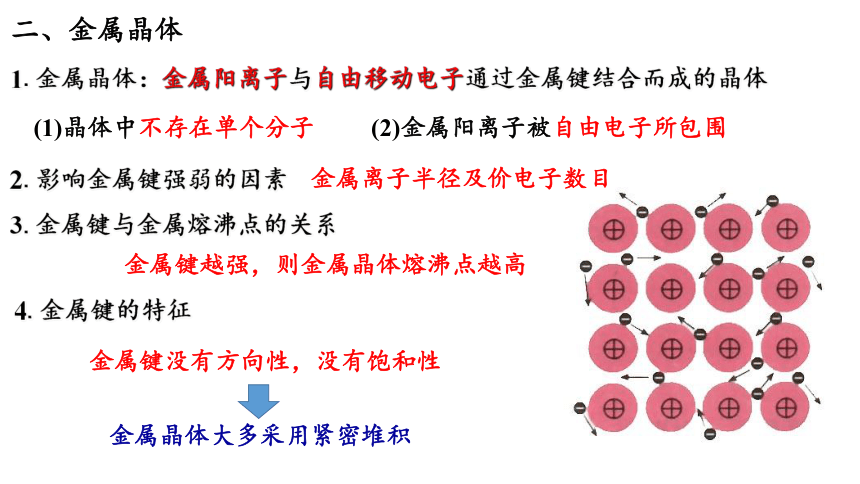
二、金属晶体
1.金属晶体:金属阳离子与自由移动电子通过金属键结合而成的晶体
(1)晶体中不存在单个分子 (2)金属阳离子被自由电子所包围
2.影响金属键强弱的因素
金属离子半径及价电子数目
3.金属键与金属熔沸点的关系
金属键越强,则金属晶体熔沸点越高
4.金属键的特征
金属键没有方向性,没有饱和性
金属晶体大多采用紧密堆积
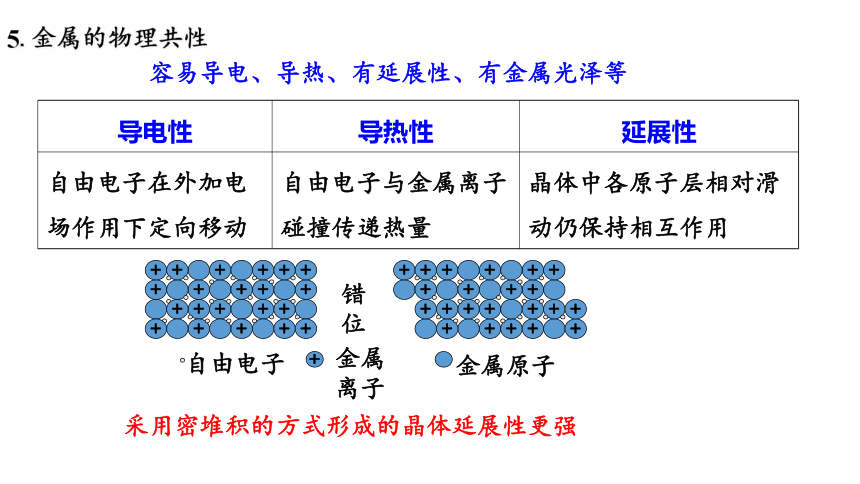
5.金属的物理共性
容易导电、导热、有延展性、有金属光泽等
导电性 导热性 延展性
自由电子在外加电场作用下定向移动 自由电子与金属离子碰撞传递热量 晶体中各原子层相对滑动仍保持相互作用
自由电子
+
金属离子
金属原子
错位
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
采用密堆积的方式形成的晶体延展性更强
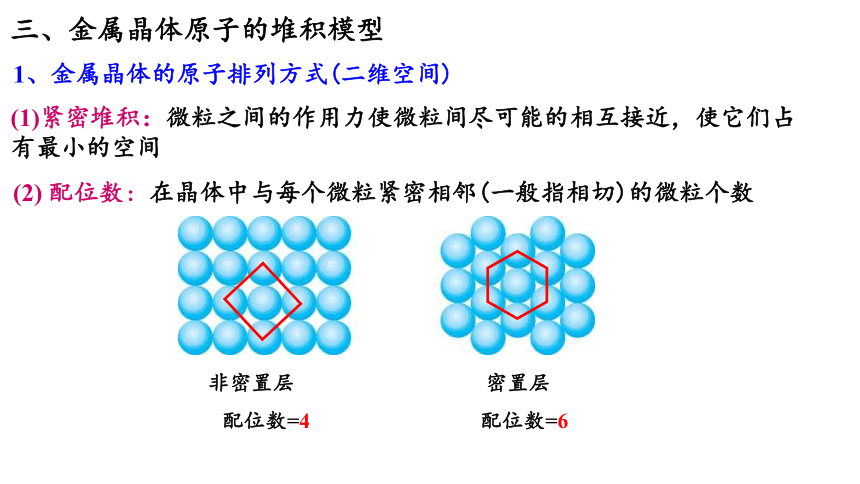
三、金属晶体原子的堆积模型
1、金属晶体的原子排列方式(二维空间)
(1)紧密堆积:微粒之间的作用力使微粒间尽可能的相互接近,使它们占有最小的空间
(2) 配位数:在晶体中与每个微粒紧密相邻(一般指相切)的微粒个数
非密置层
配位数=4
配位数=6
密置层
2. 金属晶体的原子堆积方式(三维空间)
(1) 非密置层的堆积方式:
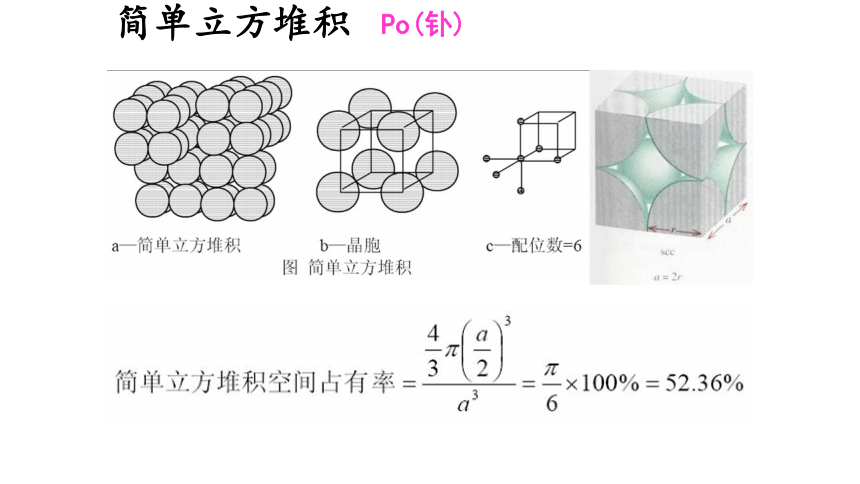
①简单立方堆积(Po型)
讨论1:该堆积方式中金属原子的配位数是多少?
空间利用率:晶体的空间被微粒占据的体积百分数,
用它来表示紧密堆积的程度。
讨论2:该堆积方式中金属原子占有晶胞体积的百分数是多少?
配位数
空间利用率
6
52%
简单立方堆积
Po(钋)
(1) 非密置层的堆积方式:
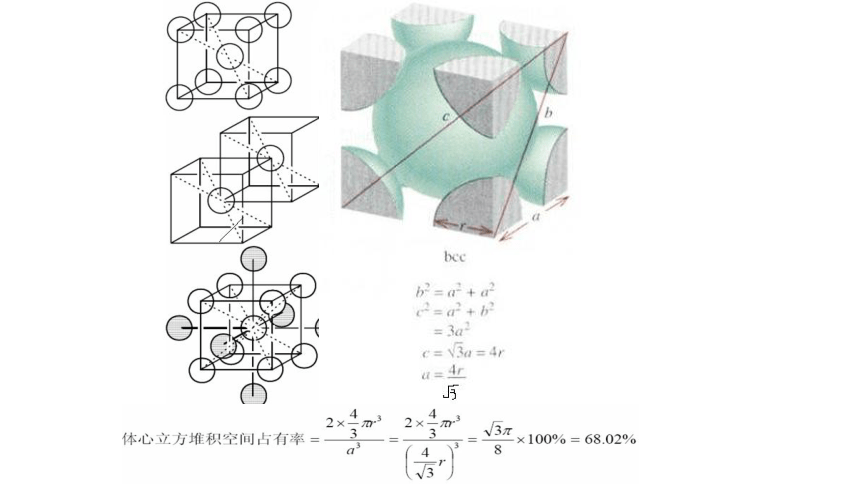
②体心立方堆积 (K型)
配位数
空间利用率
8
68%
a
b
a
采用体心立方堆积的金属有:Li 、Na 、K 、Ba 、W 、Fe
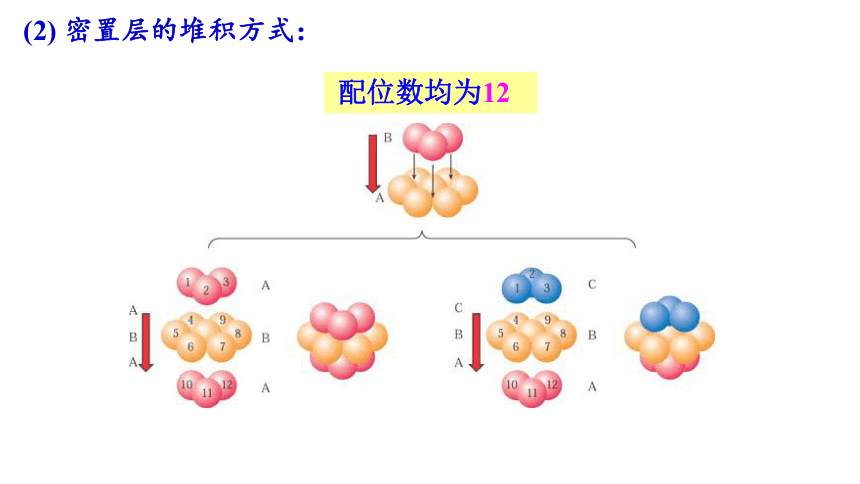
(2) 密置层的堆积方式:
配位数均为12
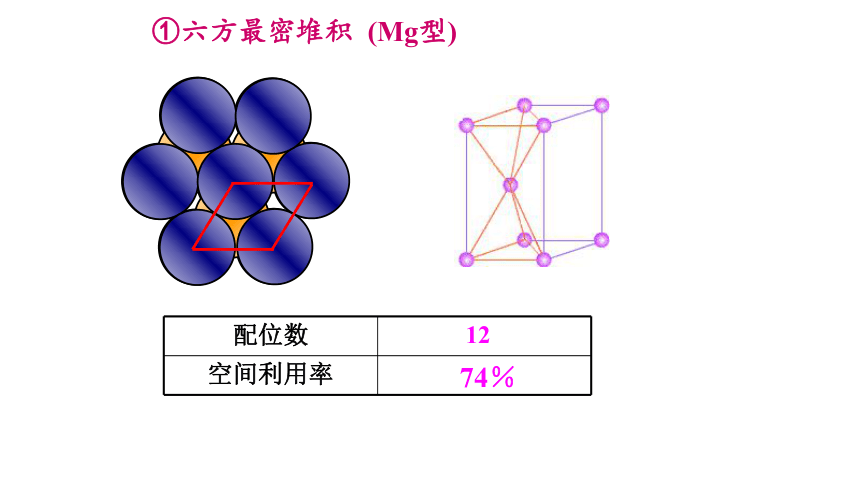
①六方最密堆积 (Mg型)
配位数 12
空间利用率
74%
六方最密堆积
(Mg、Zn、Ti)
配位数=12
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
a
a
a
3
4
2
3
球
r
V
p
=
②面心立方最密堆积(Cu型)
配位数 12
空间利用率
74%
B
C
A
Cu
Ag
Au
Ca
Al
Pd
Pt
金属晶体的4种堆积方式比较
堆积 类型 代表 物质 层类型 晶胞 每个晶胞所含原子数 配位数 空间
利用率
简单 立方
体心 立方
六方 最密
面心 最密
Po(钋)
非密置层
1
6
K Na Fe
非密置层
2
8
Mg Zn Ti
密置层
2
12
Cu Ag Au
密置层
4
12
52%
68%
74%
74%
3、合金
①定义:由一种金属和另一种或几种金属或某些非金属所组成的,具有金属特性的物质。
②特点:
a.合金的熔点比其成分中各金属的熔点要低。
b.硬度、强度比各成分金属高。
性质:熔点高(高于金刚石),硬度小,可导电 。
石墨晶体
石墨晶体是层状结构:
层内C原子以共价键结合成平面网状结构,
层间以范德华力结合。
----混合型晶体(过渡型晶体)
每个C与3个C形成C—C键,构成正六边形,
键长相等,键角相等(均为120°);
C原子个数与C—C键数之比为:
每个正六边形平均只占有6×(1/3)=2个C
1﹕3×(1/2)=2﹕3
1、定义:
由阳离子和阴离子通过离子键结合而成的晶体
2、成键微粒:
阴、阳离子
3、微粒间相互作用力:
离子键
4、常见的离子晶体:
强碱、活泼金属氧化物、大部分的盐类
四、离子晶体
5、离子晶体没有分子,化学式表示晶胞中阴阳离子数目比
1. 配位数:离子晶体中离子配位数指离子周围最邻近的异电性离子的数目
r+/r- 0.225~0.414 0.414~0.732 0.732~1.000
配位数 4 6 8
离子 Na+ Cs+ Cl-
离子半径/pm 95 169 181
A
B
五、离子晶体晶胞类型
配位数 4 6 8
半径比 0.2-0.4 0.4-0.7 0.7-1.0
空间构型 ZnS NaCl CsCl
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
CsCl
6
6
8
8
你认为是什么因素决定了离子晶体中离子的配位数?
2. 决定离子晶体结构的因素
①几何因素
——晶体中正负离子的半径比
——晶体中正负离子的电荷比
②电荷因素
③键性因素——离子键的纯粹程度
配位数:离子晶体中离子配位数指离子周围最邻近的异电性离子的数目。
3. NaCl晶胞
哪个是NaCl晶胞?
不能重合!
能重合!
为什么大的是晶胞呢?
① 钠离子和氯离子的位置:
钠离子:体心和棱中点;氯离子:面心和顶点。或者反之。
③ Na+ 与Cl- 的配位数:
② 每个晶胞含钠离子、氯离子的个数:
均为4
均为6
无单个分子存在;NaCl不表示分子式。
④在氯化钠晶体中,若钠离子与周围最近的氯离子距离为a,那么每个钠离子周围最近且等距离的钠离子有 个,其距离为 。
2
a
12
在氯化钠晶胞中,距钠离子最近且等距的氯离子形成 构型。
八面体
【思考】
3. 氯化铯型晶胞
---Cs+
---Cl-
①铯离子和氯离子的位置:
铯离子:体心;氯离子:顶点。或反之。
②每个晶胞含铯离子、氯离子的个数:
均为1
③Cs+ 与Cl- 的配位数:
均为8
④在氯化铯晶体中,每个铯离子周围最近且等距离的铯离子有 ____个,每个氯离子周围最近且等距离的氯离子有____个。
6
6
②Zn2+、S2-的配位数:
① 每个ZnS晶胞中含阴、阳离子:
4. ZnS型晶胞
均为4
均为4
5. CaF2型晶胞
Ca2+
F-
4
8
②Ca2+的配位数:
① 每个CaF2晶胞中含阴、阳离子:
Ca2+为4、
F-为8
F- 的配位数:
各类型离子晶体晶胞的比较
晶体类型 晶胞类型 晶胞结构示意图 配位数 距离最近且相等的相反离子 每个晶胞含有离子数
实例
NaCl型
AB CsCl型
ZnS型
AB2 CaF2型
Na+:
6
Cl-:
6
Cs+:
Cl-:
8
8
Zn2+:
S2-:
4
4
Ca2+:
F-:
4
8
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
6
6
8
8
4
4
4
8
4
4
1
1
4
4
8
4
KBr AgCl、MgO、CaS、BaSe
ZnS、AgI、
BeO
CsCl、CsBr、CsI、TlCl
碱土金属卤化物、碱金属氧化物。
小 结
1、定义:拆开1mol 离子晶体,形成完全气态阴阳离子所吸收的能量。
氟化物 晶格能
/kJ·mol-1
NaF 923
MgF2 2957
AlF3 5492
符号 U
2、晶格能的大小的影响因素
离子半径、所带电荷
所带电荷越多,离子半径越小,离子间的距离越小,晶格能越大
六、晶格能
晶格能随离子间距的减小而增大,因此随着阳离子或阴离子半径的减小,晶格能增大;晶格能愈大,晶体的熔点就愈高。
晶格能∝ q1. q2 /r
晶格能与阴、阳离子所带电荷的乘积成正比;与阴、阳离子间的距离成反比 。
晶格能的大小还与离子晶体的结构型式有关。带异性电荷的离子之间存在相互吸引,带同性电荷的离子之间却存在相互排斥作用。
3、晶格能的作用:
岩浆晶出规则与晶格能
矿物 晶格能KJ/mol 晶出次序
ZnS 771.41 先
PbS 670.0 后
橄榄石 4400 最先
晶体析出次序与晶格能
形成的晶体越稳定
熔点越高硬度越大
离子键越强
晶格能越大
§ 3.3 金属晶体与离子晶体
第三章 晶体结构与性质
一、金属的分类
1、分类依据:根据组成晶体的微粒及微粒之间的相互作用
晶体类型 构成微粒 微粒间的相互作用 实例
离子晶体 ___________ ______ NaCl
金属晶体 _________、 ________ _______ 铜
原子晶体 ____ _______ 金刚石
分子晶体 ____ ___________ 冰
注意:由原子构成的晶体不一定都是原子晶体,稀有气体是单原子分子
2、微粒间作用的强弱
熔融状态需要破坏的作用力:
原子晶体熔融需破坏共价键
离子晶体熔融需破坏离子键
金属晶体熔融需破坏金属键
分子晶体熔融需破坏氢键或范德华力
微粒之间相互作用的强弱:
化学键 > 氢键 > 范德华力
熔沸点一般规律:原子晶体 > 离子晶体 > 分子晶体
金属晶体的熔沸点差别很大,有的很高:例如钨、铂,有的熔沸点很低:例如汞、铯、镓
二、金属晶体
1.金属晶体:金属阳离子与自由移动电子通过金属键结合而成的晶体
(1)晶体中不存在单个分子 (2)金属阳离子被自由电子所包围
2.影响金属键强弱的因素
金属离子半径及价电子数目
3.金属键与金属熔沸点的关系
金属键越强,则金属晶体熔沸点越高
4.金属键的特征
金属键没有方向性,没有饱和性
金属晶体大多采用紧密堆积
5.金属的物理共性
容易导电、导热、有延展性、有金属光泽等
导电性 导热性 延展性
自由电子在外加电场作用下定向移动 自由电子与金属离子碰撞传递热量 晶体中各原子层相对滑动仍保持相互作用
自由电子
+
金属离子
金属原子
错位
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
采用密堆积的方式形成的晶体延展性更强
三、金属晶体原子的堆积模型
1、金属晶体的原子排列方式(二维空间)
(1)紧密堆积:微粒之间的作用力使微粒间尽可能的相互接近,使它们占有最小的空间
(2) 配位数:在晶体中与每个微粒紧密相邻(一般指相切)的微粒个数
非密置层
配位数=4
配位数=6
密置层
2. 金属晶体的原子堆积方式(三维空间)
(1) 非密置层的堆积方式:
①简单立方堆积(Po型)
讨论1:该堆积方式中金属原子的配位数是多少?
空间利用率:晶体的空间被微粒占据的体积百分数,
用它来表示紧密堆积的程度。
讨论2:该堆积方式中金属原子占有晶胞体积的百分数是多少?
配位数
空间利用率
6
52%
简单立方堆积
Po(钋)
(1) 非密置层的堆积方式:
②体心立方堆积 (K型)
配位数
空间利用率
8
68%
a
b
a
采用体心立方堆积的金属有:Li 、Na 、K 、Ba 、W 、Fe
(2) 密置层的堆积方式:
配位数均为12
①六方最密堆积 (Mg型)
配位数 12
空间利用率
74%
六方最密堆积
(Mg、Zn、Ti)
配位数=12
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
a
a
a
3
4
2
3
球
r
V
p
=
②面心立方最密堆积(Cu型)
配位数 12
空间利用率
74%
B
C
A
Cu
Ag
Au
Ca
Al
Pd
Pt
金属晶体的4种堆积方式比较
堆积 类型 代表 物质 层类型 晶胞 每个晶胞所含原子数 配位数 空间
利用率
简单 立方
体心 立方
六方 最密
面心 最密
Po(钋)
非密置层
1
6
K Na Fe
非密置层
2
8
Mg Zn Ti
密置层
2
12
Cu Ag Au
密置层
4
12
52%
68%
74%
74%
3、合金
①定义:由一种金属和另一种或几种金属或某些非金属所组成的,具有金属特性的物质。
②特点:
a.合金的熔点比其成分中各金属的熔点要低。
b.硬度、强度比各成分金属高。
性质:熔点高(高于金刚石),硬度小,可导电 。
石墨晶体
石墨晶体是层状结构:
层内C原子以共价键结合成平面网状结构,
层间以范德华力结合。
----混合型晶体(过渡型晶体)
每个C与3个C形成C—C键,构成正六边形,
键长相等,键角相等(均为120°);
C原子个数与C—C键数之比为:
每个正六边形平均只占有6×(1/3)=2个C
1﹕3×(1/2)=2﹕3
1、定义:
由阳离子和阴离子通过离子键结合而成的晶体
2、成键微粒:
阴、阳离子
3、微粒间相互作用力:
离子键
4、常见的离子晶体:
强碱、活泼金属氧化物、大部分的盐类
四、离子晶体
5、离子晶体没有分子,化学式表示晶胞中阴阳离子数目比
1. 配位数:离子晶体中离子配位数指离子周围最邻近的异电性离子的数目
r+/r- 0.225~0.414 0.414~0.732 0.732~1.000
配位数 4 6 8
离子 Na+ Cs+ Cl-
离子半径/pm 95 169 181
A
B
五、离子晶体晶胞类型
配位数 4 6 8
半径比 0.2-0.4 0.4-0.7 0.7-1.0
空间构型 ZnS NaCl CsCl
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
CsCl
6
6
8
8
你认为是什么因素决定了离子晶体中离子的配位数?
2. 决定离子晶体结构的因素
①几何因素
——晶体中正负离子的半径比
——晶体中正负离子的电荷比
②电荷因素
③键性因素——离子键的纯粹程度
配位数:离子晶体中离子配位数指离子周围最邻近的异电性离子的数目。
3. NaCl晶胞
哪个是NaCl晶胞?
不能重合!
能重合!
为什么大的是晶胞呢?
① 钠离子和氯离子的位置:
钠离子:体心和棱中点;氯离子:面心和顶点。或者反之。
③ Na+ 与Cl- 的配位数:
② 每个晶胞含钠离子、氯离子的个数:
均为4
均为6
无单个分子存在;NaCl不表示分子式。
④在氯化钠晶体中,若钠离子与周围最近的氯离子距离为a,那么每个钠离子周围最近且等距离的钠离子有 个,其距离为 。
2
a
12
在氯化钠晶胞中,距钠离子最近且等距的氯离子形成 构型。
八面体
【思考】
3. 氯化铯型晶胞
---Cs+
---Cl-
①铯离子和氯离子的位置:
铯离子:体心;氯离子:顶点。或反之。
②每个晶胞含铯离子、氯离子的个数:
均为1
③Cs+ 与Cl- 的配位数:
均为8
④在氯化铯晶体中,每个铯离子周围最近且等距离的铯离子有 ____个,每个氯离子周围最近且等距离的氯离子有____个。
6
6
②Zn2+、S2-的配位数:
① 每个ZnS晶胞中含阴、阳离子:
4. ZnS型晶胞
均为4
均为4
5. CaF2型晶胞
Ca2+
F-
4
8
②Ca2+的配位数:
① 每个CaF2晶胞中含阴、阳离子:
Ca2+为4、
F-为8
F- 的配位数:
各类型离子晶体晶胞的比较
晶体类型 晶胞类型 晶胞结构示意图 配位数 距离最近且相等的相反离子 每个晶胞含有离子数
实例
NaCl型
AB CsCl型
ZnS型
AB2 CaF2型
Na+:
6
Cl-:
6
Cs+:
Cl-:
8
8
Zn2+:
S2-:
4
4
Ca2+:
F-:
4
8
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
6
6
8
8
4
4
4
8
4
4
1
1
4
4
8
4
KBr AgCl、MgO、CaS、BaSe
ZnS、AgI、
BeO
CsCl、CsBr、CsI、TlCl
碱土金属卤化物、碱金属氧化物。
小 结
1、定义:拆开1mol 离子晶体,形成完全气态阴阳离子所吸收的能量。
氟化物 晶格能
/kJ·mol-1
NaF 923
MgF2 2957
AlF3 5492
符号 U
2、晶格能的大小的影响因素
离子半径、所带电荷
所带电荷越多,离子半径越小,离子间的距离越小,晶格能越大
六、晶格能
晶格能随离子间距的减小而增大,因此随着阳离子或阴离子半径的减小,晶格能增大;晶格能愈大,晶体的熔点就愈高。
晶格能∝ q1. q2 /r
晶格能与阴、阳离子所带电荷的乘积成正比;与阴、阳离子间的距离成反比 。
晶格能的大小还与离子晶体的结构型式有关。带异性电荷的离子之间存在相互吸引,带同性电荷的离子之间却存在相互排斥作用。
3、晶格能的作用:
岩浆晶出规则与晶格能
矿物 晶格能KJ/mol 晶出次序
ZnS 771.41 先
PbS 670.0 后
橄榄石 4400 最先
晶体析出次序与晶格能
形成的晶体越稳定
熔点越高硬度越大
离子键越强
晶格能越大
