2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(一)(含答案)
文档属性
| 名称 | 2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(一)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 311.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 10:20:07 | ||
图片预览



文档简介
2023年广东省普通高中学业水平合格性考试化学科模拟测试卷(一)
(时间60分钟,总分100分)
第一部分 选择题
一、选择题(本大题包括20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意)
1.科学家为人类社会的进步做了巨大的贡献。下列研究成果与科学家对应关系不符合事实的是( )
A.屠呦呦因提取抗疟药青蒿素而获得诺贝尔奖
B.侯德榜发明的侯氏制碱法推动了我国制碱工业的发展
C.道尔顿发现的元素周期律推动了人们对物质世界的认识
D.拉瓦锡建立的氧化学说使近代化学取得了革命性的进展
2.朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是( )
A.空气中的小水滴颗粒直径介于1~100 nm B.空气中的小水滴颗粒的布朗运动
C.雾是一种胶体,胶粒带相同电荷 D.发生丁达尔效应
3.下列关于物质分类的说法正确的是( )
A.聚乙烯、聚氯乙烯、纤维素都属于合成高分子化合物
B.SO2、SiO2、CO均为酸性氧化物
C.盐酸、漂白粉、水玻璃都是混合物
D.C2H4Cl2、C6H6和CH4O表示的物质都是纯净物
4.化学与生活密切相关,下列说法错误的是( )
A.工业上用氯气与澄清石灰水生产漂白粉 B.“84”消毒液能杀灭病毒,可用于环境消毒
C.疫苗一般应冷藏存放,以避免蛋白质变性 D.误服重金属盐中毒,可立即饮用牛奶解毒
5.下列离子在溶液中能大量共存的一组是( )
A.H+、Na+、Cl- B.Ag+、Cl-、NO
C.Fe3+、Na+、OH- D.Ba2+、NO、SO
6.下列变化中,需要加入合适的氧化剂才能实现的是 ( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
7.CO2、CH4、N2O等气体都是“温室气体”。下列有关说法正确的是( )
A.CO2是一种酸 B.CH4是一种无机物
C.N2O是由N2与O2组成的混合物 D.CO2属于非金属氧化物
8.下列说法中不正确的是( )
A.摩尔是基本物理量之一 B.0.012 kg C 12含有阿伏加德罗常数个碳原子
C.摩尔是物质的量的单位 D.使用摩尔这一单位时必须指明微粒的种类
9.下列物质存在同分异构体的是( )
A.CH3CH3 B.CH4
C.CH3CH2CH2CH3 D.CH3CH2CH3
10.古典诗词源远流长,包罗万象,是中华文化的瑰宝。下列诗句隐含化学变化的是( )
A.荷风送香气,竹露滴清响 B.遥见寻沙岸,春风动草衣
C.绿蚁新醅酒,红泥小火炉 D.日落山水静,为君起松声
11.含离子键的氧化物是( )
A.Na2O B.HClO C.NO D.KOH
12.实验室对下列药品的保存方法错误的是( )
A.少量碳酸钙固体放在广口瓶中 B.少量浓硝酸放在棕色细口瓶中
C.少量金属钠保存在煤油中 D.少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中
13.对危险化学品要在包装标签上印上警示性标志。下列的化学药品名称与警示标志名称对应正确的是( )
A.酒精——剧毒品 B.浓硫酸——爆炸品
C.汽油——易燃品 D.烧碱——剧毒品
14.下列物质分类的正确组合是( )
选项 碱 酸 盐 酸性氧化物
A 纯碱 盐酸 烧碱 二氧化硫
B 烧碱 硫酸 食盐 一氧化碳
C 苛性钠 醋酸 石灰石 水
D 苛性钾 碳酸 苏打 三氧化硫
15.已知:CH4+Cl2―→CH3Cl+HCl,下列有关化学用语表示正确的是( )
A.CH4的球棍模型:
B.CH3Cl的电子式:
C.Cl-的结构示意图:
D.HCl在水溶液中的电离方程式:HCl===H++Cl-
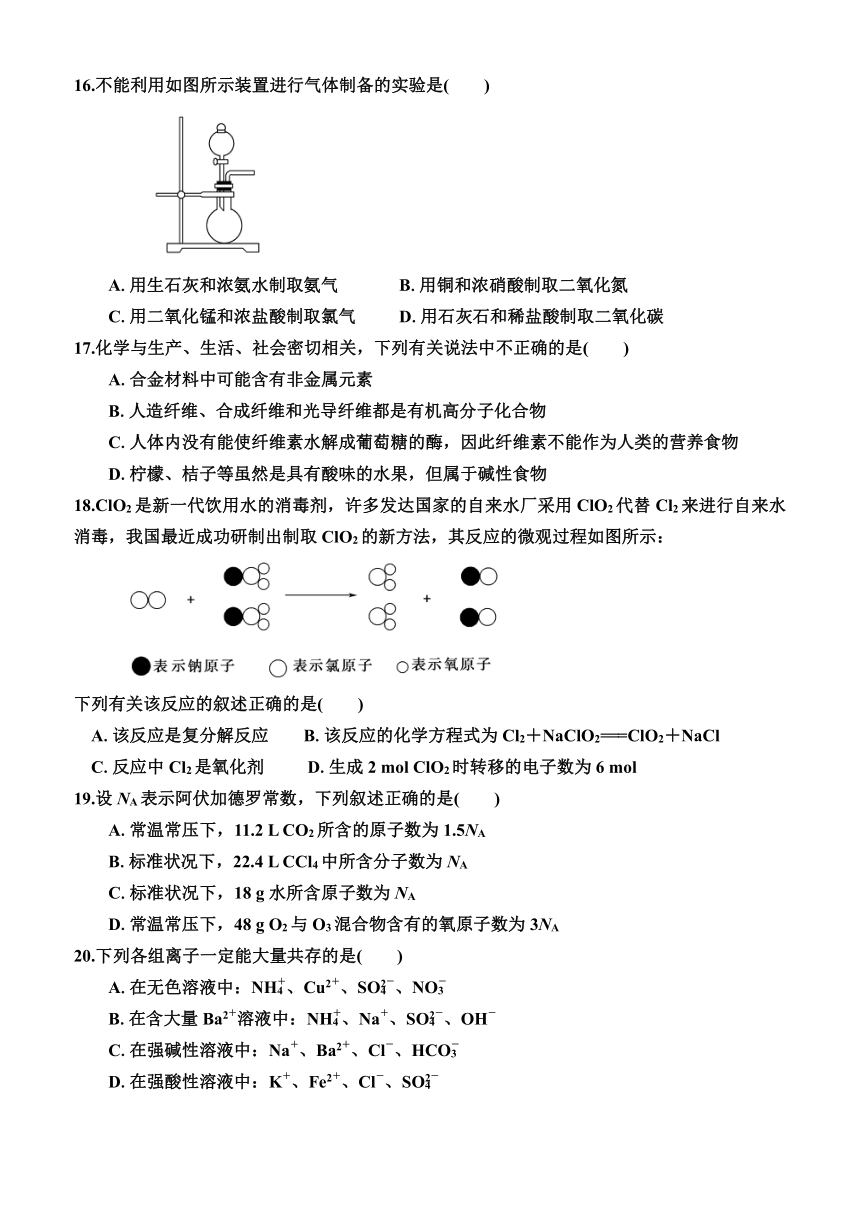
16.不能利用如图所示装置进行气体制备的实验是( )
A.用生石灰和浓氨水制取氨气 B.用铜和浓硝酸制取二氧化氮
C.用二氧化锰和浓盐酸制取氯气 D.用石灰石和稀盐酸制取二氧化碳
17.化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A.合金材料中可能含有非金属元素
B.人造纤维、合成纤维和光导纤维都是有机高分子化合物
C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物
D.柠檬、桔子等虽然是具有酸味的水果,但属于碱性食物
18.ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒,我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
下列有关该反应的叙述正确的是( )
A.该反应是复分解反应 B.该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C.反应中Cl2是氧化剂 D.生成2 mol ClO2时转移的电子数为6 mol
19.设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.标准状况下,22.4 L CCl4中所含分子数为NA
C.标准状况下,18 g水所含原子数为NA
D.常温常压下,48 g O2与O3混合物含有的氧原子数为3NA
20.下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH、Cu2+、SO、NO
B.在含大量Ba2+溶液中:NH、Na+、SO、OH-
C.在强碱性溶液中:Na+、Ba2+、Cl-、HCO
D.在强酸性溶液中:K+、Fe2+、Cl-、SO
第二部分 非选择题
二、非选择题(本大题包括3小题,共40分)
21.(14分)联合国大会将2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性。下表列出了部分元素在周期表中的位置:
(1)元素a~m中金属性最强的是________(填元素符号);原子最外层电子数与所处周期数相同的元素有________种。
(2)g、h、m三种元素最高价氧化物对应的水化物的碱性由强到弱依次为________________________________________________________________(填化学式)。
(3)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”。由d、e、l三种元素组成的化合物是硝石的主要成分,化学式为________,爆炸时可将_______________能转化为热能。
(4)由元素e与元素f组成的一种化合物可用于潜艇供氧,该化合物中所含化学键类型有______键和________键。
(5)元素h的纳米级单质均匀分散在冰中形成的混合物,是一种固体火箭推进剂。该推进剂高温时产生固体氧化物和元素a的单质,反应的化学方程式为_______________________________
22.(12分)填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________。
(2)原子符号为X的元素属于第________周期________族。
(3)周期表中位于第8纵列的铁元素属于第______________族。
(4)周期表中第三周期最活泼的金属元素是________。
(5)已知某微粒的结构示意图为,试回答下列问题:
①当x-y=10时,该微粒为________(填“原子”“阳离子”或“阴离子”)。
②当y=6时,元素最高价氧化物对应水化物的化学式为________。
23.(14分)下列是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同)。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是________________________________。
(4)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发结晶、________。
(5)为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
①写出三种试剂的化学式:A________,B________,C________。
②加过量A的原因是__________________________________________。
③加过量B的原因是____________________________________________,
有关反应的化学方程式为_______________________________________。
参考答案及解析:
一、选择题
1.C 解析:门捷列夫发现的元素周期律。
2.A 解析:此景是因为形成了胶体,而胶体的本质特征是分散质微粒的直径在1~100 nm之间,故答案A正确。丁达尔效应是区别溶液和胶体的,而非胶体的本质。
3.C 4.A
5.A 解析:B项中Ag+与Cl-生成AgCl沉淀;C项中Fe3+与OH-生成Fe(OH)3沉淀;D项中Ba2+与SO生成BaSO4沉淀。
6.D 解析:A.HCl转化为H2被还原,需要加入还原剂,A不符合题意;B.CO2→CO的过程中C元素被还原,需要加入还原剂,B不符合题意;C.Fe2O3→Fe的过程中Fe元素被还原,需要加入还原剂,C不符合题意;D.Br-→Br2的过程中Br元素被氧化,且Br-无法自身歧化,需要加入合适的氧化剂,D符合题意。
7.D
8.A 解析:摩尔是“物质的量”这一物理量的单位。
9.C
10.C
11.A 解析:A.Na2O只含离子键,且属于氧化物,A符合题意;B.HClO只含共价键,且不是氧化物,B不符合题意;C.NO虽为氧化物,但不含离子键,C不符合题意;D.KOH虽含离子键,但不是氧化物,D不符合题意。
12.D 解析:NaOH溶液为碱性,应保存在带橡胶塞的试剂瓶中。
13.C 解析:酒精、汽油均为易燃品,浓硫酸、烧碱均为腐蚀品。
14.D 解析:纯碱不是碱,是Na2CO3,属于盐;烧碱是NaOH,属于碱;H2O、CO不是酸性氧化物。
15.D
16.C 解析:二氧化锰和浓盐酸制取氯气,需加热。
17.B 解析:A.依据合金的定义:合金是由金属和金属或者非金属熔合而成的具有金属特性的材料,合金中可能含有非金属,正确;B.光导纤维的主要成分是二氧化硅,错误;C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物,正确;D.柠檬、桔子等虽然是具有酸味的水果,但是经过消化、吸收、代谢后,最后在人体内变成碱性物质,所以属于碱性食物,正确。
18.C 解析:由图可知该反应为Cl2+2NaClO2===2ClO2+2NaCl,根据氧化还原价态变化规律可知Cl2由0价降为-1价,亚氯酸钠中氯元素由+3价升为+4价。A.该反应为Cl2+2NaClO2===2ClO2+2NaCl,不是复分解反应,A错误、B错误;C.氯气由0价降为-1价,得电子,为氧化剂,C正确;D.根据反应方程式Cl2+2NaClO2===2ClO2+2NaCl可知生成2 mol ClO2时转移的电子为2 mol,D错误。
19.D
20.D 解析:本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;溶液的颜色,如无色时可排除Cu2+、Fe2+、Fe3+、MnO等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等。
二、非选择题
21.答案:(1)K 3 (2)Ca(OH)2>Mg(OH)2>Al(OH)3 (3)KNO3 化学
(4)离子 共价 (5)2Al+3H2OAl2O3+3H2↑
22.答案:(1)8O (2)三 ⅦA (3)Ⅷ (4)Na (5)①原子 ②H2SO4
解析:(1)该元素原子质量数为8+10=18,质子数为8,则为O元素。
(2)17号元素为氯,属于第三周期ⅦA族。(3)元素周期表中第8、9、10三纵列为第Ⅷ族。
(4)周期表中第三周期最活泼的金属元素为Na元素。
(5)①当x-y=10时,x=y+10,该微粒为原子。
②当y=6时,x为16,是硫元素,其最高价氧化物对应的水化物为H2SO4。
23.答案:(1)D (2)B 萃取分液
(3)冷凝管 下 将分液漏斗上部的玻璃塞打开 (4)溶解 过滤
(5)①Ba(OH)2 K2CO3 HCl ②除净Mg2+和SO
③除净过量的Ba2+ Ba(OH)2+K2CO3===BaCO3↓+2KOH
解析:(4)NaNO3和KNO3都易溶于水,但溶解度不同,可用结晶法来提纯。(5)当有多种杂质共存时,应认真分析从而使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面必须除去。要除去Mg2+,可用含OH-的试剂,除SO可用含Ba2+的试剂,故选用Ba(OH)2溶液。加入的过量Ba(OH)2溶液中的Ba2+可用K2CO3除去,过量Ba(OH)2中的OH-以及过量K2CO3中的CO可用稀盐酸除去。
(时间60分钟,总分100分)
第一部分 选择题
一、选择题(本大题包括20小题,每小题3分,共60分。在每小题列出的四个选项中,只有一项最符合题意)
1.科学家为人类社会的进步做了巨大的贡献。下列研究成果与科学家对应关系不符合事实的是( )
A.屠呦呦因提取抗疟药青蒿素而获得诺贝尔奖
B.侯德榜发明的侯氏制碱法推动了我国制碱工业的发展
C.道尔顿发现的元素周期律推动了人们对物质世界的认识
D.拉瓦锡建立的氧化学说使近代化学取得了革命性的进展
2.朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是( )
A.空气中的小水滴颗粒直径介于1~100 nm B.空气中的小水滴颗粒的布朗运动
C.雾是一种胶体,胶粒带相同电荷 D.发生丁达尔效应
3.下列关于物质分类的说法正确的是( )
A.聚乙烯、聚氯乙烯、纤维素都属于合成高分子化合物
B.SO2、SiO2、CO均为酸性氧化物
C.盐酸、漂白粉、水玻璃都是混合物
D.C2H4Cl2、C6H6和CH4O表示的物质都是纯净物
4.化学与生活密切相关,下列说法错误的是( )
A.工业上用氯气与澄清石灰水生产漂白粉 B.“84”消毒液能杀灭病毒,可用于环境消毒
C.疫苗一般应冷藏存放,以避免蛋白质变性 D.误服重金属盐中毒,可立即饮用牛奶解毒
5.下列离子在溶液中能大量共存的一组是( )
A.H+、Na+、Cl- B.Ag+、Cl-、NO
C.Fe3+、Na+、OH- D.Ba2+、NO、SO
6.下列变化中,需要加入合适的氧化剂才能实现的是 ( )
A.HCl→H2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
7.CO2、CH4、N2O等气体都是“温室气体”。下列有关说法正确的是( )
A.CO2是一种酸 B.CH4是一种无机物
C.N2O是由N2与O2组成的混合物 D.CO2属于非金属氧化物
8.下列说法中不正确的是( )
A.摩尔是基本物理量之一 B.0.012 kg C 12含有阿伏加德罗常数个碳原子
C.摩尔是物质的量的单位 D.使用摩尔这一单位时必须指明微粒的种类
9.下列物质存在同分异构体的是( )
A.CH3CH3 B.CH4
C.CH3CH2CH2CH3 D.CH3CH2CH3
10.古典诗词源远流长,包罗万象,是中华文化的瑰宝。下列诗句隐含化学变化的是( )
A.荷风送香气,竹露滴清响 B.遥见寻沙岸,春风动草衣
C.绿蚁新醅酒,红泥小火炉 D.日落山水静,为君起松声
11.含离子键的氧化物是( )
A.Na2O B.HClO C.NO D.KOH
12.实验室对下列药品的保存方法错误的是( )
A.少量碳酸钙固体放在广口瓶中 B.少量浓硝酸放在棕色细口瓶中
C.少量金属钠保存在煤油中 D.少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中
13.对危险化学品要在包装标签上印上警示性标志。下列的化学药品名称与警示标志名称对应正确的是( )
A.酒精——剧毒品 B.浓硫酸——爆炸品
C.汽油——易燃品 D.烧碱——剧毒品
14.下列物质分类的正确组合是( )
选项 碱 酸 盐 酸性氧化物
A 纯碱 盐酸 烧碱 二氧化硫
B 烧碱 硫酸 食盐 一氧化碳
C 苛性钠 醋酸 石灰石 水
D 苛性钾 碳酸 苏打 三氧化硫
15.已知:CH4+Cl2―→CH3Cl+HCl,下列有关化学用语表示正确的是( )
A.CH4的球棍模型:
B.CH3Cl的电子式:
C.Cl-的结构示意图:
D.HCl在水溶液中的电离方程式:HCl===H++Cl-
16.不能利用如图所示装置进行气体制备的实验是( )
A.用生石灰和浓氨水制取氨气 B.用铜和浓硝酸制取二氧化氮
C.用二氧化锰和浓盐酸制取氯气 D.用石灰石和稀盐酸制取二氧化碳
17.化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A.合金材料中可能含有非金属元素
B.人造纤维、合成纤维和光导纤维都是有机高分子化合物
C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物
D.柠檬、桔子等虽然是具有酸味的水果,但属于碱性食物
18.ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒,我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
下列有关该反应的叙述正确的是( )
A.该反应是复分解反应 B.该反应的化学方程式为Cl2+NaClO2===ClO2+NaCl
C.反应中Cl2是氧化剂 D.生成2 mol ClO2时转移的电子数为6 mol
19.设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.标准状况下,22.4 L CCl4中所含分子数为NA
C.标准状况下,18 g水所含原子数为NA
D.常温常压下,48 g O2与O3混合物含有的氧原子数为3NA
20.下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH、Cu2+、SO、NO
B.在含大量Ba2+溶液中:NH、Na+、SO、OH-
C.在强碱性溶液中:Na+、Ba2+、Cl-、HCO
D.在强酸性溶液中:K+、Fe2+、Cl-、SO
第二部分 非选择题
二、非选择题(本大题包括3小题,共40分)
21.(14分)联合国大会将2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性。下表列出了部分元素在周期表中的位置:
(1)元素a~m中金属性最强的是________(填元素符号);原子最外层电子数与所处周期数相同的元素有________种。
(2)g、h、m三种元素最高价氧化物对应的水化物的碱性由强到弱依次为________________________________________________________________(填化学式)。
(3)《天工开物》记载,“凡火药,以硝石、硫磺为主,草木灰为辅”。由d、e、l三种元素组成的化合物是硝石的主要成分,化学式为________,爆炸时可将_______________能转化为热能。
(4)由元素e与元素f组成的一种化合物可用于潜艇供氧,该化合物中所含化学键类型有______键和________键。
(5)元素h的纳米级单质均匀分散在冰中形成的混合物,是一种固体火箭推进剂。该推进剂高温时产生固体氧化物和元素a的单质,反应的化学方程式为_______________________________
22.(12分)填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________。
(2)原子符号为X的元素属于第________周期________族。
(3)周期表中位于第8纵列的铁元素属于第______________族。
(4)周期表中第三周期最活泼的金属元素是________。
(5)已知某微粒的结构示意图为,试回答下列问题:
①当x-y=10时,该微粒为________(填“原子”“阳离子”或“阴离子”)。
②当y=6时,元素最高价氧化物对应水化物的化学式为________。
23.(14分)下列是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同)。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是________________________________。
(4)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发结晶、________。
(5)为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
①写出三种试剂的化学式:A________,B________,C________。
②加过量A的原因是__________________________________________。
③加过量B的原因是____________________________________________,
有关反应的化学方程式为_______________________________________。
参考答案及解析:
一、选择题
1.C 解析:门捷列夫发现的元素周期律。
2.A 解析:此景是因为形成了胶体,而胶体的本质特征是分散质微粒的直径在1~100 nm之间,故答案A正确。丁达尔效应是区别溶液和胶体的,而非胶体的本质。
3.C 4.A
5.A 解析:B项中Ag+与Cl-生成AgCl沉淀;C项中Fe3+与OH-生成Fe(OH)3沉淀;D项中Ba2+与SO生成BaSO4沉淀。
6.D 解析:A.HCl转化为H2被还原,需要加入还原剂,A不符合题意;B.CO2→CO的过程中C元素被还原,需要加入还原剂,B不符合题意;C.Fe2O3→Fe的过程中Fe元素被还原,需要加入还原剂,C不符合题意;D.Br-→Br2的过程中Br元素被氧化,且Br-无法自身歧化,需要加入合适的氧化剂,D符合题意。
7.D
8.A 解析:摩尔是“物质的量”这一物理量的单位。
9.C
10.C
11.A 解析:A.Na2O只含离子键,且属于氧化物,A符合题意;B.HClO只含共价键,且不是氧化物,B不符合题意;C.NO虽为氧化物,但不含离子键,C不符合题意;D.KOH虽含离子键,但不是氧化物,D不符合题意。
12.D 解析:NaOH溶液为碱性,应保存在带橡胶塞的试剂瓶中。
13.C 解析:酒精、汽油均为易燃品,浓硫酸、烧碱均为腐蚀品。
14.D 解析:纯碱不是碱,是Na2CO3,属于盐;烧碱是NaOH,属于碱;H2O、CO不是酸性氧化物。
15.D
16.C 解析:二氧化锰和浓盐酸制取氯气,需加热。
17.B 解析:A.依据合金的定义:合金是由金属和金属或者非金属熔合而成的具有金属特性的材料,合金中可能含有非金属,正确;B.光导纤维的主要成分是二氧化硅,错误;C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物,正确;D.柠檬、桔子等虽然是具有酸味的水果,但是经过消化、吸收、代谢后,最后在人体内变成碱性物质,所以属于碱性食物,正确。
18.C 解析:由图可知该反应为Cl2+2NaClO2===2ClO2+2NaCl,根据氧化还原价态变化规律可知Cl2由0价降为-1价,亚氯酸钠中氯元素由+3价升为+4价。A.该反应为Cl2+2NaClO2===2ClO2+2NaCl,不是复分解反应,A错误、B错误;C.氯气由0价降为-1价,得电子,为氧化剂,C正确;D.根据反应方程式Cl2+2NaClO2===2ClO2+2NaCl可知生成2 mol ClO2时转移的电子为2 mol,D错误。
19.D
20.D 解析:本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;溶液的颜色,如无色时可排除Cu2+、Fe2+、Fe3+、MnO等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等。
二、非选择题
21.答案:(1)K 3 (2)Ca(OH)2>Mg(OH)2>Al(OH)3 (3)KNO3 化学
(4)离子 共价 (5)2Al+3H2OAl2O3+3H2↑
22.答案:(1)8O (2)三 ⅦA (3)Ⅷ (4)Na (5)①原子 ②H2SO4
解析:(1)该元素原子质量数为8+10=18,质子数为8,则为O元素。
(2)17号元素为氯,属于第三周期ⅦA族。(3)元素周期表中第8、9、10三纵列为第Ⅷ族。
(4)周期表中第三周期最活泼的金属元素为Na元素。
(5)①当x-y=10时,x=y+10,该微粒为原子。
②当y=6时,x为16,是硫元素,其最高价氧化物对应的水化物为H2SO4。
23.答案:(1)D (2)B 萃取分液
(3)冷凝管 下 将分液漏斗上部的玻璃塞打开 (4)溶解 过滤
(5)①Ba(OH)2 K2CO3 HCl ②除净Mg2+和SO
③除净过量的Ba2+ Ba(OH)2+K2CO3===BaCO3↓+2KOH
解析:(4)NaNO3和KNO3都易溶于水,但溶解度不同,可用结晶法来提纯。(5)当有多种杂质共存时,应认真分析从而使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面必须除去。要除去Mg2+,可用含OH-的试剂,除SO可用含Ba2+的试剂,故选用Ba(OH)2溶液。加入的过量Ba(OH)2溶液中的Ba2+可用K2CO3除去,过量Ba(OH)2中的OH-以及过量K2CO3中的CO可用稀盐酸除去。
同课章节目录
