四川省凉山州宁南县中2022-2023学年高一上学期期末考试化学试题(含答案)
文档属性
| 名称 | 四川省凉山州宁南县中2022-2023学年高一上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 561.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 19:42:35 | ||
图片预览



文档简介
宁南县中2022-2023学年高一上学期期末考试
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 S-32 Fe-56
一、单选题(每 题2.5分,共50分,每题只有一个最佳答案)
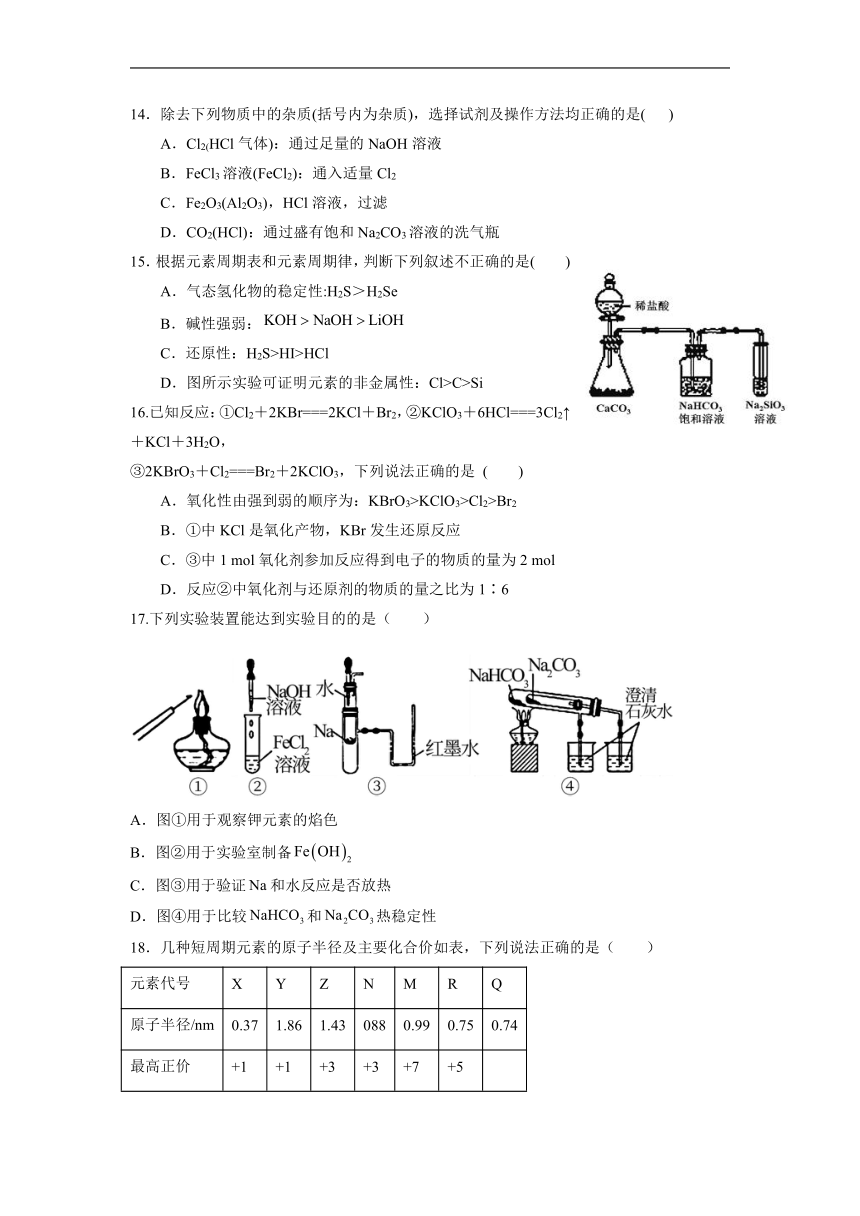
1.新型冠状病毒(冠状病毒粒子直径约80~120nm)主要传播途径有飞沫传播、接触传播和气溶胶传播,可用含氯消毒剂如84消毒液、ClO2等可杀灭新冠病毒,下列有关说法不正确的是( )
A.新冠病毒扩散到空气中可形成气溶胶
B.消毒剂中的ClO2属于氧化物
C.医院常用95%的酒精消毒
D.用“人工肾”进行血液透析救治危重新冠肺炎患者,利用了胶体的性质
2.下列有关化学用语表示正确的是( )
A.的结构示意图:
B.HClO的结构式:
C.质子数为53、中子数为78的碘原子:
D.的电子式:
3.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。下列劳动与所涉及的化学知识不相符的是( )
选项 家务劳动 化学知识
A 用白醋除去水壶中的水垢 白醋可溶解CaCO3沉淀
B 用小苏打粉作膨松剂焙制糕点 NaHCO3加热容易分解放出CO2
C 用含NaClO的84消毒液拖地 NaClO有还原性
D 用洁厕灵洗马桶 洁厕灵中含有盐酸,可以与尿垢反应
4.设表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,含有的共价键数为
B.在常温常压下,含有的原子数为
C.溶液中,的数目为
D.与铁完全反应生成时,反应转移的电子数为
5.能正确表示下列化学反应离子方程式的是( )
A.碳酸钙溶于稀盐酸中:
B.氢氧化钡溶液与稀H2SO4反应:Ba2++=BaSO4↓
C.氯化铁溶液与铜板反应:Fe3++Cu=Fe2++Cu2+
D.澄清的石灰水与盐酸的反应:
6.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图:
下列说法不正确的是( )
A.反应I属于氧化还原反应
B.反应II为2H2SO42SO2↑+O2↑+2H2O
C.该流程将太阳能转化为化学能,该方法的最终产物只有H2
D.反应II中的SO2、反应III中的I2均可循环利用
7.下列叙述能说明氯元素非金属性比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④还原性:Cl-⑤HClO4的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧在周期表中Cl处于S同周期的右侧
A.③④⑤⑥⑦⑧ B.③⑥⑦⑧ C.③④⑥⑦⑧ D.①②③④⑤⑥⑦⑧
8.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图。下列说法正确的是( )
A.装置B可以起到防止倒吸的作用
B.实验中氮气的作用就是将装置内的空气排出
C.ClO2是新型净水剂,它的净水原理和氢氧化铁胶体相同
D.当看到装置C中导管液面上升时应减慢氮气的通入速率
9.学校老师采购了一瓶浓硫酸,标签如图所示,下列说法正确的是( )
A.该硫酸中溶质的物质的量浓度为9.2mol/L
B.配制100mL 4.6mol/L的稀硫酸需取该硫酸25.0 mL
C.稀释该硫酸可以向硫酸中直接加入水
D.使用450mL的容量瓶配置3.0mol/L的稀硫酸溶液
10.下列物质分类正确的是( )
碱 酸 碱性氧化物 酸性氧化物 纯净物
A NaOH H2SO4 MgO Mn2O7 氯水
B 纯碱 HClO CaO SO3 漂白粉
C Ba(OH)2 CH3COOH Na2O SO2 液氯
D NH3 HCl Al2O3 CO2 盐酸
11.下列离子能大量共存的是( )
A.使紫色石蕊溶液呈红色的溶液:、、、
B.无色透明的溶液中:Cu2+、K+、SO、NO
C.使酚酞变红色的溶液:、、、
D.含有大量的溶液:、、、
12.标准状况下,体积都是11.2L的NO和SO2相比较,下列叙述正确的是( )
A.电子数之比为32:15 B.氧原子数之比为1:2
C.分子数之比为2:3 D.摩尔质量之比为32:15
X Y Z
W
13.下表是元素周期表的一部分,其中X、Y、Z、W均为短周期主族元素,已知Z的最外层电子数是其电子层数的3倍,下列说法错误的是( )
A.简单离子半径:
B.仅由X与Z形成的化合物中只存在共价键
C.简单氢化物的沸点:
D.最高价氧化物对应水化物的酸性:
14.除去下列物质中的杂质(括号内为杂质),选择试剂及操作方法均正确的是( )
A.Cl2(HCl气体):通过足量的NaOH溶液
B.FeCl3溶液(FeCl2):通入适量Cl2
C.Fe2O3(Al2O3),HCl溶液,过滤
D.CO2(HCl):通过盛有饱和Na2CO3溶液的洗气瓶
15.根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2S>H2Se
B.碱性强弱:
C.还原性:H2S>HI>HCl
D.图所示实验可证明元素的非金属性:Cl>C>Si
16.已知反应:①Cl2+2KBr===2KCl+Br2,②KClO3+6HCl===3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2===Br2+2KClO3,下列说法正确的是 ( )
A.氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2
B.①中KCl是氧化产物,KBr发生还原反应
C.③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
D.反应②中氧化剂与还原剂的物质的量之比为1∶6
17.下列实验装置能达到实验目的的是( )
A.图①用于观察钾元素的焰色
B.图②用于实验室制备
C.图③用于验证和水反应是否放热
D.图④用于比较和热稳定性
18.几种短周期元素的原子半径及主要化合价如表,下列说法正确的是( )
元素代号 X Y Z N M R Q
原子半径/nm 0.37 1.86 1.43 088 0.99 0.75 0.74
最高正价 +1 +1 +3 +3 +7 +5
最低负价 -1 -1 -3 -2
A.由元素X、R、Q组成的化合物只能是共价化合物
B.由水溶液的酸性:HM>H2S(氢硫酸),可推断元素的非金属性:M>S
C.Y和Q形成的两种常见化合物中,阴、阳离子个数比不同
D.Y、Z、M三种元素的最高价氧化物的水化物两两之间能反应
19.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为、、,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4 7H2O),设计了如下流程:
已知①与酸不反应;②氢氧化铝能与溶液反应生成偏铝酸钠溶液。
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂选用铁粉
B.若改变方案,在溶液中直接加至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4 7H2O
C.从溶液得到FeSO4 7H2O产品的过程中,须控制条件防止其氧化和分解
D.固体中一定有SiO2,加NaOH溶液控制是使Al3+转化为Al(OH)3进入固体
20.将一定质量的Mg-Al合金投入200mL稀H2SO4溶液中,充分反应,向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。下列说法正确的是( )
A.140ml时溶液中溶质的物质的量为0.1mol
B.当沉淀的物质的量为0.1mol时,加入NaOH溶液溶液体积一定为140 mL
C.合金充分反应后,剩余硫酸的物质的量为0.1mol
D.题中试剂浓度分别是 c(H2SO4)=1.5mol/L、c(NaOH)=5 mol/L
第II卷(非选择题共50分)
(每空2分,共18分)根据所学知识回答下列问题:
(1)①写出Fe2(SO4)3在水溶液中的电离方程式:
②FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_______
③写出Al与氢氧化钠溶液反应的离子方程式:
(2)高铁酸钠()是一种新型净水剂。制取高铁酸钠所发生的反应如下:
________NaOH+______________NaCl +
①配平并用“双线桥”表示电子转移的方向和数目。
②该反应中是_______(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
③若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗的Cl2在标准状况下的体积为_______L。
④黄色气体可用于污水杀菌和饮用水净化,可将废水中的转化为而除去,本身还原为,该反应过程中氧化剂与还原剂的物质的量之比为_______。
(3)已知M2O可与R2-作用,R2-被氧化为R单质,M2O的还原产物中M为+3价;又知c(M2O)=0.3mol L-1的溶液100mL可与c(R2-)=0.6mol L-1的溶液150mL恰好完全反应,则n值为_____。
22.(每空2分,共16分)下表是元素周期表的一部分,请用规范的化学用语回答有关问题:
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
二 ① ② ③ ④ ⑤
三 ⑥ ⑦ ⑧ ⑨
(1)元素⑨在周期表中所处位置 。
(2)表中化学性质最不活泼的元素,其原子结构示意图为________。
(3)④⑦⑨元素形成的化合物中含有的化学键类型为 。
(4)④、⑧、⑨三种元素的常见离子的半径由小到大的顺序为______。
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中碱性最强的是________。
(6)写出⑥、⑧元素的最高价氧化物的水化物发生反应的离子方程式_________。
(7)②、③、④的简单氢化物中最稳定的是________。
(8)用电子式表示⑥与⑨形成的化合物的形成过程 。
23.(每空2分,共16分)铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是_______,A中发生反应的离子方程式为 ;浓盐酸表现出的性质为_______。
(2)B中所盛放的试剂为
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。检验溶液中阳离子的方法是: ,D中装的药品是碱石灰,其作用是_______。
(4)定量分析。如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取产物溶于过量的稀盐酸中;
②加入足量溶液;
③再加入足量溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为。
则该产物中铁元素的质量分数为_______%(结果精确到小数点后两位)。
实验结束后某同学想探究、的性质。该同学取一定量氯化亚铁固体,配制成的溶液。在氯化亚铁溶液中需加入少量铁屑,其目的是 。
宁南县中2022-2023学年高一上学期期末考试
化学答案
一、选择题(2.5分一个)
1-5 CBCBD 6-10CAABC 11-15 ABCBD 16-20ACDBD
二、21.(每空2分,共18分)
(1) Fe2(SO4)3=2Fe3++3SO42- 2Al+2H2O+2OH-=2AlO2-+3H2↑ 2Fe3++2I-=2Fe2++I2
(2) ① 216NaOH+3266NaCl+8 双线桥略(配平2分,双线桥2分)
② 氧化产物 ③3.36 ④ 2:5 (3)7
22. (每空2分,共16分)
(1)第三周期第VI A族 (2) (3) 离子键、共价键
(4))Al3+< O2-(6)OH-+Al(OH)3=AlO2-+2H2O (7) H2O (8) 形成过程略
23.(每空2分,共16分)
(1) 分液漏斗 MnO2+ 4H+ +2Cl-Mn2++Cl2↑+2H2O 酸性、还原性
(2)饱和食盐水
(3) 取溶液少许于试管,向其中滴加KSCN溶液,观察溶液是否呈血红色 吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入C中(一点一分)
(4)36.52 (5)防止亚铁离子被氧化试卷第1页,共3页
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 S-32 Fe-56
一、单选题(每 题2.5分,共50分,每题只有一个最佳答案)
1.新型冠状病毒(冠状病毒粒子直径约80~120nm)主要传播途径有飞沫传播、接触传播和气溶胶传播,可用含氯消毒剂如84消毒液、ClO2等可杀灭新冠病毒,下列有关说法不正确的是( )
A.新冠病毒扩散到空气中可形成气溶胶
B.消毒剂中的ClO2属于氧化物
C.医院常用95%的酒精消毒
D.用“人工肾”进行血液透析救治危重新冠肺炎患者,利用了胶体的性质
2.下列有关化学用语表示正确的是( )
A.的结构示意图:
B.HClO的结构式:
C.质子数为53、中子数为78的碘原子:
D.的电子式:
3.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。下列劳动与所涉及的化学知识不相符的是( )
选项 家务劳动 化学知识
A 用白醋除去水壶中的水垢 白醋可溶解CaCO3沉淀
B 用小苏打粉作膨松剂焙制糕点 NaHCO3加热容易分解放出CO2
C 用含NaClO的84消毒液拖地 NaClO有还原性
D 用洁厕灵洗马桶 洁厕灵中含有盐酸,可以与尿垢反应
4.设表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,含有的共价键数为
B.在常温常压下,含有的原子数为
C.溶液中,的数目为
D.与铁完全反应生成时,反应转移的电子数为
5.能正确表示下列化学反应离子方程式的是( )
A.碳酸钙溶于稀盐酸中:
B.氢氧化钡溶液与稀H2SO4反应:Ba2++=BaSO4↓
C.氯化铁溶液与铜板反应:Fe3++Cu=Fe2++Cu2+
D.澄清的石灰水与盐酸的反应:
6.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图:
下列说法不正确的是( )
A.反应I属于氧化还原反应
B.反应II为2H2SO42SO2↑+O2↑+2H2O
C.该流程将太阳能转化为化学能,该方法的最终产物只有H2
D.反应II中的SO2、反应III中的I2均可循环利用
7.下列叙述能说明氯元素非金属性比硫元素强的是( )
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S强
④还原性:Cl-
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧在周期表中Cl处于S同周期的右侧
A.③④⑤⑥⑦⑧ B.③⑥⑦⑧ C.③④⑥⑦⑧ D.①②③④⑤⑥⑦⑧
8.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图。下列说法正确的是( )
A.装置B可以起到防止倒吸的作用
B.实验中氮气的作用就是将装置内的空气排出
C.ClO2是新型净水剂,它的净水原理和氢氧化铁胶体相同
D.当看到装置C中导管液面上升时应减慢氮气的通入速率
9.学校老师采购了一瓶浓硫酸,标签如图所示,下列说法正确的是( )
A.该硫酸中溶质的物质的量浓度为9.2mol/L
B.配制100mL 4.6mol/L的稀硫酸需取该硫酸25.0 mL
C.稀释该硫酸可以向硫酸中直接加入水
D.使用450mL的容量瓶配置3.0mol/L的稀硫酸溶液
10.下列物质分类正确的是( )
碱 酸 碱性氧化物 酸性氧化物 纯净物
A NaOH H2SO4 MgO Mn2O7 氯水
B 纯碱 HClO CaO SO3 漂白粉
C Ba(OH)2 CH3COOH Na2O SO2 液氯
D NH3 HCl Al2O3 CO2 盐酸
11.下列离子能大量共存的是( )
A.使紫色石蕊溶液呈红色的溶液:、、、
B.无色透明的溶液中:Cu2+、K+、SO、NO
C.使酚酞变红色的溶液:、、、
D.含有大量的溶液:、、、
12.标准状况下,体积都是11.2L的NO和SO2相比较,下列叙述正确的是( )
A.电子数之比为32:15 B.氧原子数之比为1:2
C.分子数之比为2:3 D.摩尔质量之比为32:15
X Y Z
W
13.下表是元素周期表的一部分,其中X、Y、Z、W均为短周期主族元素,已知Z的最外层电子数是其电子层数的3倍,下列说法错误的是( )
A.简单离子半径:
B.仅由X与Z形成的化合物中只存在共价键
C.简单氢化物的沸点:
D.最高价氧化物对应水化物的酸性:
14.除去下列物质中的杂质(括号内为杂质),选择试剂及操作方法均正确的是( )
A.Cl2(HCl气体):通过足量的NaOH溶液
B.FeCl3溶液(FeCl2):通入适量Cl2
C.Fe2O3(Al2O3),HCl溶液,过滤
D.CO2(HCl):通过盛有饱和Na2CO3溶液的洗气瓶
15.根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2S>H2Se
B.碱性强弱:
C.还原性:H2S>HI>HCl
D.图所示实验可证明元素的非金属性:Cl>C>Si
16.已知反应:①Cl2+2KBr===2KCl+Br2,②KClO3+6HCl===3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2===Br2+2KClO3,下列说法正确的是 ( )
A.氧化性由强到弱的顺序为:KBrO3>KClO3>Cl2>Br2
B.①中KCl是氧化产物,KBr发生还原反应
C.③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
D.反应②中氧化剂与还原剂的物质的量之比为1∶6
17.下列实验装置能达到实验目的的是( )
A.图①用于观察钾元素的焰色
B.图②用于实验室制备
C.图③用于验证和水反应是否放热
D.图④用于比较和热稳定性
18.几种短周期元素的原子半径及主要化合价如表,下列说法正确的是( )
元素代号 X Y Z N M R Q
原子半径/nm 0.37 1.86 1.43 088 0.99 0.75 0.74
最高正价 +1 +1 +3 +3 +7 +5
最低负价 -1 -1 -3 -2
A.由元素X、R、Q组成的化合物只能是共价化合物
B.由水溶液的酸性:HM>H2S(氢硫酸),可推断元素的非金属性:M>S
C.Y和Q形成的两种常见化合物中,阴、阳离子个数比不同
D.Y、Z、M三种元素的最高价氧化物的水化物两两之间能反应
19.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为、、,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4 7H2O),设计了如下流程:
已知①与酸不反应;②氢氧化铝能与溶液反应生成偏铝酸钠溶液。
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂选用铁粉
B.若改变方案,在溶液中直接加至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4 7H2O
C.从溶液得到FeSO4 7H2O产品的过程中,须控制条件防止其氧化和分解
D.固体中一定有SiO2,加NaOH溶液控制是使Al3+转化为Al(OH)3进入固体
20.将一定质量的Mg-Al合金投入200mL稀H2SO4溶液中,充分反应,向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。下列说法正确的是( )
A.140ml时溶液中溶质的物质的量为0.1mol
B.当沉淀的物质的量为0.1mol时,加入NaOH溶液溶液体积一定为140 mL
C.合金充分反应后,剩余硫酸的物质的量为0.1mol
D.题中试剂浓度分别是 c(H2SO4)=1.5mol/L、c(NaOH)=5 mol/L
第II卷(非选择题共50分)
(每空2分,共18分)根据所学知识回答下列问题:
(1)①写出Fe2(SO4)3在水溶液中的电离方程式:
②FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为:_______
③写出Al与氢氧化钠溶液反应的离子方程式:
(2)高铁酸钠()是一种新型净水剂。制取高铁酸钠所发生的反应如下:
________NaOH+______________NaCl +
①配平并用“双线桥”表示电子转移的方向和数目。
②该反应中是_______(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”)。
③若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则消耗的Cl2在标准状况下的体积为_______L。
④黄色气体可用于污水杀菌和饮用水净化,可将废水中的转化为而除去,本身还原为,该反应过程中氧化剂与还原剂的物质的量之比为_______。
(3)已知M2O可与R2-作用,R2-被氧化为R单质,M2O的还原产物中M为+3价;又知c(M2O)=0.3mol L-1的溶液100mL可与c(R2-)=0.6mol L-1的溶液150mL恰好完全反应,则n值为_____。
22.(每空2分,共16分)下表是元素周期表的一部分,请用规范的化学用语回答有关问题:
族 周期 IA IIA IIIA IVA VA VIA VIIA 0
二 ① ② ③ ④ ⑤
三 ⑥ ⑦ ⑧ ⑨
(1)元素⑨在周期表中所处位置 。
(2)表中化学性质最不活泼的元素,其原子结构示意图为________。
(3)④⑦⑨元素形成的化合物中含有的化学键类型为 。
(4)④、⑧、⑨三种元素的常见离子的半径由小到大的顺序为______。
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中碱性最强的是________。
(6)写出⑥、⑧元素的最高价氧化物的水化物发生反应的离子方程式_________。
(7)②、③、④的简单氢化物中最稳定的是________。
(8)用电子式表示⑥与⑨形成的化合物的形成过程 。
23.(每空2分,共16分)铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是_______,A中发生反应的离子方程式为 ;浓盐酸表现出的性质为_______。
(2)B中所盛放的试剂为
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。检验溶液中阳离子的方法是: ,D中装的药品是碱石灰,其作用是_______。
(4)定量分析。如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取产物溶于过量的稀盐酸中;
②加入足量溶液;
③再加入足量溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为。
则该产物中铁元素的质量分数为_______%(结果精确到小数点后两位)。
实验结束后某同学想探究、的性质。该同学取一定量氯化亚铁固体,配制成的溶液。在氯化亚铁溶液中需加入少量铁屑,其目的是 。
宁南县中2022-2023学年高一上学期期末考试
化学答案
一、选择题(2.5分一个)
1-5 CBCBD 6-10CAABC 11-15 ABCBD 16-20ACDBD
二、21.(每空2分,共18分)
(1) Fe2(SO4)3=2Fe3++3SO42- 2Al+2H2O+2OH-=2AlO2-+3H2↑ 2Fe3++2I-=2Fe2++I2
(2) ① 216NaOH+3266NaCl+8 双线桥略(配平2分,双线桥2分)
② 氧化产物 ③3.36 ④ 2:5 (3)7
22. (每空2分,共16分)
(1)第三周期第VI A族 (2) (3) 离子键、共价键
(4))Al3+< O2-
23.(每空2分,共16分)
(1) 分液漏斗 MnO2+ 4H+ +2Cl-Mn2++Cl2↑+2H2O 酸性、还原性
(2)饱和食盐水
(3) 取溶液少许于试管,向其中滴加KSCN溶液,观察溶液是否呈血红色 吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入C中(一点一分)
(4)36.52 (5)防止亚铁离子被氧化试卷第1页,共3页
同课章节目录
