2022—2023学年化学人教版九年级下册第9单元 溶液 分层优选练习(含答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第9单元 溶液 分层优选练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 653.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 19:29:08 | ||
图片预览



文档简介
2022—2023学年化学人教版九年级下册第9单元 溶液 分层优选练习附答案
人教版第9单元 溶液
一、选择题。
1、下列有关溶液的说法,正确的是( )
A.溶液一定是混合物 B.溶剂一定是水
C.溶质一定是固体 D.溶液一定是无色
2、溶液在生产、生活中应用广泛。下列有关溶液的说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶液中不能同时存在两种溶质
C.只有固体和液体可以作为溶质
D.外界条件不改变,溶质与溶剂不会分离
3、下列说法中,不正确的是( )
A.任何物质溶于水都能放出大量的热
B.煮沸的菜汤要比煮沸的水温度高
C.有水的手接触正在通电的电器设备更易发生触电事故
D.在严寒的冬季,厨房里的水结冰了而食醋却不易结
4、下列关于溶液的说法正确的是( )
A.溶质一定是固体 B.溶剂一定是水
C.溶液都是无色透明的 D.溶液都是均一稳定的
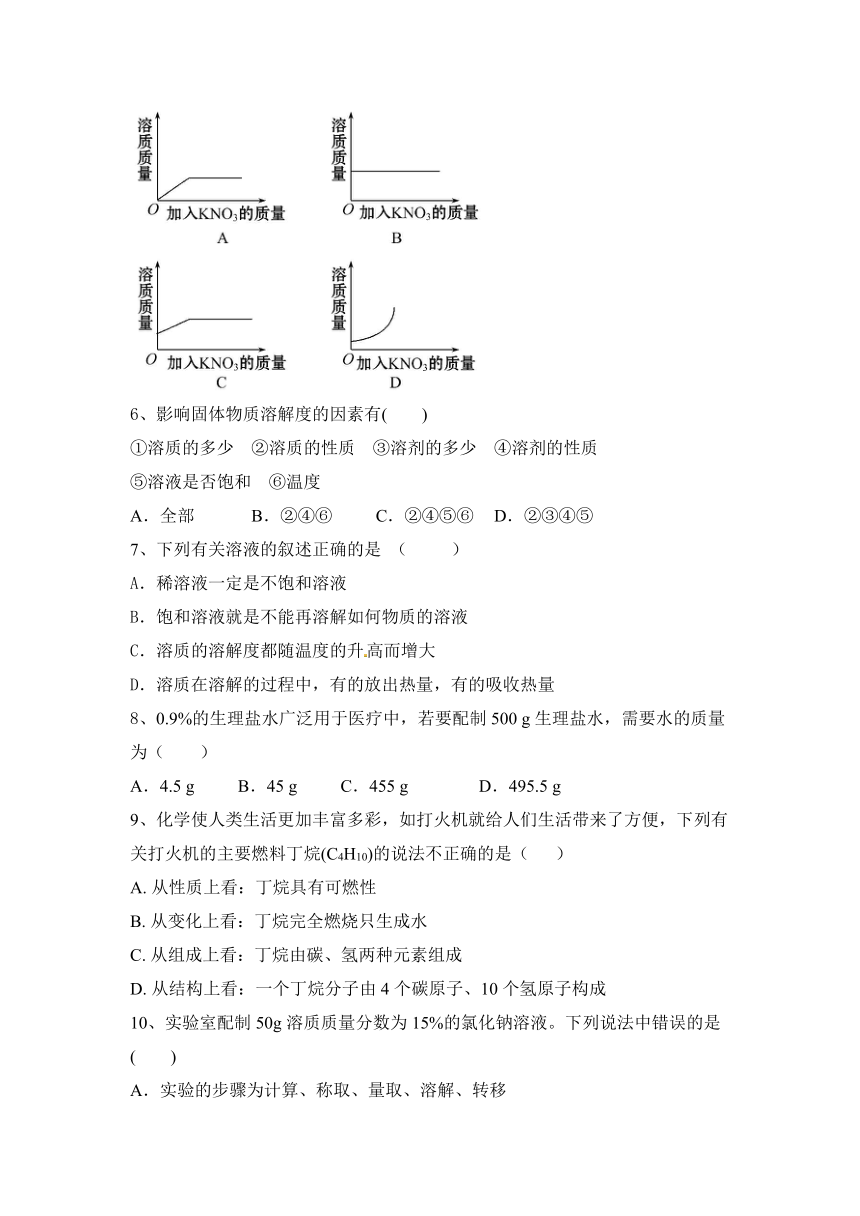
5、25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )
6、影响固体物质溶解度的因素有( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥温度
A.全部 B.②④⑥ C.②④⑤⑥ D.②③④⑤
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
8、0.9%的生理盐水广泛用于医疗中,若要配制500 g生理盐水,需要水的质量为( )
A.4.5 g B.45 g C.455 g D.495.5 g
9、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A. 从性质上看:丁烷具有可燃性
B. 从变化上看:丁烷完全燃烧只生成水
C. 从组成上看:丁烷由碳、氢两种元素组成
D. 从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
10、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
11、“恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性。
A.①②④ B.②④⑤ C.①③⑤ D.③④⑤
*12、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.泥土 C.蔗糖 D.汽油
13、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
14、地球深处的水处于超临界状态,称为超临界水,如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )
A. 在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B. 在超临界水中,2种物质的溶解度都随温度升高而增大
C. 450℃时,NaCl在超临界水中的溶解度为0.04g
D. 450℃时,可得到0.04%的CaCl2的超临界水溶液
15、实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是( )
A.用托盘天平称取10.0g氯化钠
B.用量筒量取90.0mL的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
二、填空题。
16、写出下列溶液中溶质的化学式:
(1)石灰水________。
(2)锌与稀硫酸恰好完全反应后的溶液________。
(3)食盐水________。
(4)80mL酒精与20mL水组成的溶液________。
(5)硫酸铜溶液显________色,溶质是________。
(6)氧气可用于________(填一种用途),但氧气也是导致铁锈蚀的因素之一。写出防止铁生锈的一种方法:________。
17、20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如表所示:
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
(1)所得四杯溶液中________________一定是饱和溶液。
(2)如何判断丙溶液是否为饱和溶液 __________________。
(3)向乙溶液中继续加入3 g乙物质,此时乙溶液质量______________。
18、溶液在生命活动中起着十分重要的作用。
(1)医用碘酒,常用于杀菌消毒,其中的溶剂是________ 。
(2)医疗上常用0.9%的氯化钠溶液作为生理盐水,一袋100mL(密度约为1g/mL)的生理盐水,所含溶质的质量是________ 。
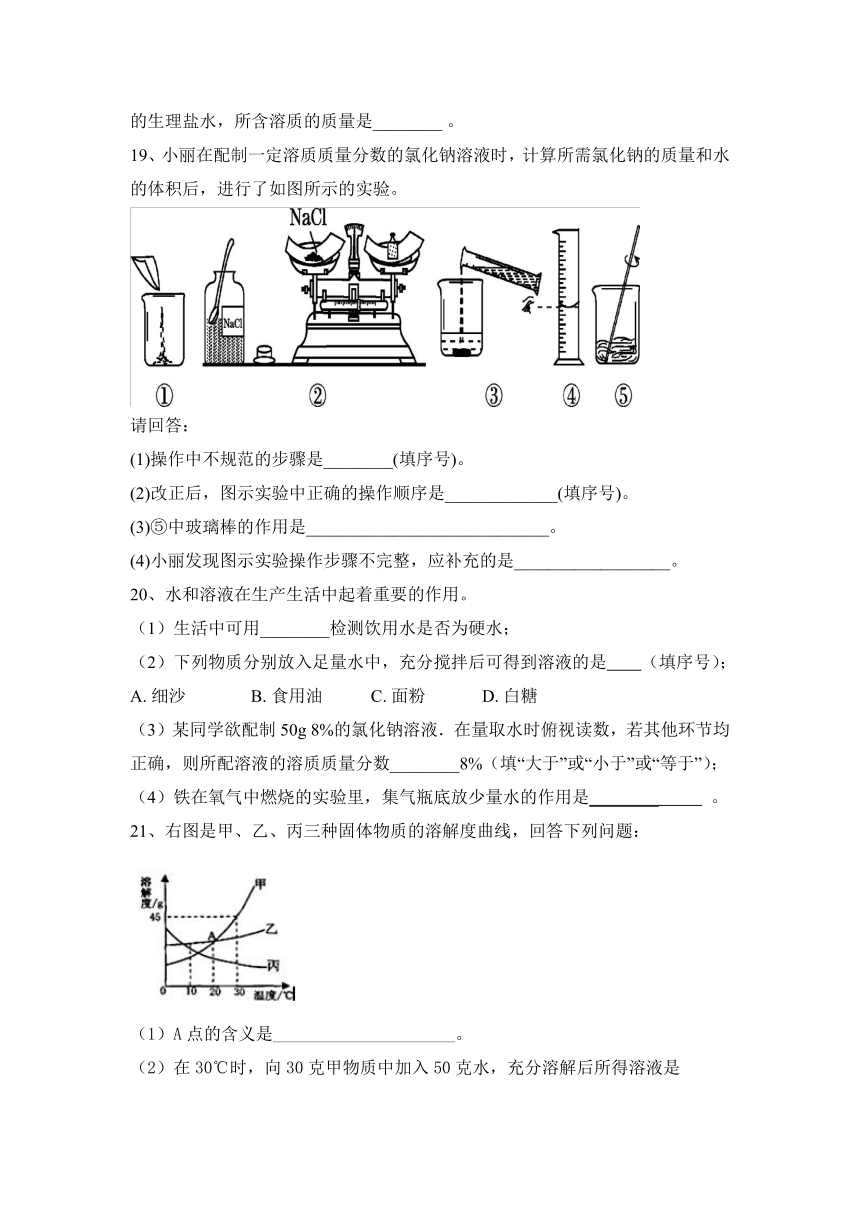
19、小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验。
请回答:
(1)操作中不规范的步骤是________(填序号)。
(2)改正后,图示实验中正确的操作顺序是_____________(填序号)。
(3)⑤中玻璃棒的作用是____________________________。
(4)小丽发现图示实验操作步骤不完整,应补充的是__________________。
20、水和溶液在生产生活中起着重要的作用。
(1)生活中可用________检测饮用水是否为硬水;
(2)下列物质分别放入足量水中,充分搅拌后可得到溶液的是 (填序号);
A. 细沙 B. 食用油 C. 面粉 D. 白糖
(3)某同学欲配制50g 8%的氯化钠溶液.在量取水时俯视读数,若其他环节均正确,则所配溶液的溶质质量分数________8%(填“大于”或“小于”或“等于”);
(4)铁在氧气中燃烧的实验里,集气瓶底放少量水的作用是________ 。
21、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
22、如图为甲、乙两种固体物质的溶解度曲线(水的密度约为1g/cm3)。
(1)两种物质中,溶解度受温度影响更大的是________(填“甲”或“乙”)。
(2)20℃时,乙的溶解度为________ 。
(3)下列实验中:10mL水XYZ为饱和溶液的是________(填“X”或“Y”或“Z”);若三中溶液中溶质的质量分数分别为a、b、c,则它们的大小关系是________(用“<”或“>”或“=”表示出来)。
23、“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500 g溶质质量分数为0.9%的生理盐水,需氯化钠固体________g;下列实验操作与目的分析均正确的一组是______(填序号)。
(2)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有烧杯、玻璃棒、量筒和________。
(3)实验室若用恒温蒸发溶剂的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示,与丙烧杯中溶液溶质质量分数一定相同的是________(填序号)烧杯中的溶液。
三、问答题。
24、汽油和洗涤剂都能除去衣物上的油污,二者的原理分别是什么?
四、实验题。
25、多角度认识溶液,有助于我们更好地了解其在生活中的重要作用。
(1)溶液的形成
①将适量调味品加入水中,充分搅拌后不能形成溶液的是________(填标号)
a.食盐 b.蔗糖 c.花生油
②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水,写出生石灰与水反应的化学方程式________ 。
(2)溶液的性质
①关于溶液的说法正确的有________(填标号)
a.盐酸是纯净物 b.溶液是均一、稳定的
c.溶液的酸碱度可用石蕊溶液测定 d.饱和溶液不一定是浓溶液
②常温下,将某固态物质A溶于水,形成饱和溶液Ⅰ(如图1),进行以下实验,回答下列问题:
a.该物质的溶解度随温度升高而________(填“增大”或“减小”);
b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈红色,据此现象,写出对“饱和溶液”的理解________ 。
③常温时,该物质在不同质量的水中,溶解达到饱和状态,溶质的质量与水的质量关系如图2所示。
a.常温时,该物质的溶解度是________g。
b.D点时,该溶液的溶质质量分数为________(结果精确到0.1%)。
c.将A点状态的溶液变化到C点状态的操作步骤为________ 。
d.图中A,B,C三个点表示溶液中溶质质量分数从大到小的关系是________。
(3)溶液的用途
生活中溶液有许多用途,例如:碘酒能用于杀菌消毒;请再举一个生活中溶液应用的实例________ 。
五、计算题。
26、20℃时,KNO3的溶解度为31.6g,将20g KNO3投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数。
2022—2023学年化学人教版九年级下册第9单元 溶液 分层优选练习附答案
人教版第9单元 溶液
一、选择题。
1、下列有关溶液的说法,正确的是( )
A.溶液一定是混合物 B.溶剂一定是水
C.溶质一定是固体 D.溶液一定是无色
【答案】A
2、溶液在生产、生活中应用广泛。下列有关溶液的说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶液中不能同时存在两种溶质
C.只有固体和液体可以作为溶质
D.外界条件不改变,溶质与溶剂不会分离
【答案】D
3、下列说法中,不正确的是( )
A.任何物质溶于水都能放出大量的热
B.煮沸的菜汤要比煮沸的水温度高
C.有水的手接触正在通电的电器设备更易发生触电事故
D.在严寒的冬季,厨房里的水结冰了而食醋却不易结
【答案】A
4、下列关于溶液的说法正确的是( )
A.溶质一定是固体 B.溶剂一定是水
C.溶液都是无色透明的 D.溶液都是均一稳定的
【答案】D。
5、25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )
【答案】C
6、影响固体物质溶解度的因素有( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥温度
A.全部 B.②④⑥ C.②④⑤⑥ D.②③④⑤
【答案】B
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
【答案】D
8、0.9%的生理盐水广泛用于医疗中,若要配制500 g生理盐水,需要水的质量为( )
A.4.5 g B.45 g C.455 g D.495.5 g
【答案】D
9、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A. 从性质上看:丁烷具有可燃性
B. 从变化上看:丁烷完全燃烧只生成水
C. 从组成上看:丁烷由碳、氢两种元素组成
D. 从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
【答案】B
10、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
【答案】C
11、“恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性。
A.①②④ B.②④⑤ C.①③⑤ D.③④⑤
【答案】B。
*12、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.泥土 C.蔗糖 D.汽油
【答案】C。
13、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
【答案】A
14、地球深处的水处于超临界状态,称为超临界水,如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )
A. 在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B. 在超临界水中,2种物质的溶解度都随温度升高而增大
C. 450℃时,NaCl在超临界水中的溶解度为0.04g
D. 450℃时,可得到0.04%的CaCl2的超临界水溶液
【答案】C
15、实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是( )
A.用托盘天平称取10.0g氯化钠
B.用量筒量取90.0mL的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
【答案】C
二、填空题。
16、写出下列溶液中溶质的化学式:
(1)石灰水________。
(2)锌与稀硫酸恰好完全反应后的溶液________。
(3)食盐水________。
(4)80mL酒精与20mL水组成的溶液________。
(5)硫酸铜溶液显________色,溶质是________。
(6)氧气可用于________(填一种用途),但氧气也是导致铁锈蚀的因素之一。写出防止铁生锈的一种方法:________。
【答案】(1)Ca(OH)2 (2)ZnSO4 (3)NaCl
(4)C2H5OH (5)蓝;CuSO4 (6)冶炼钢铁;涂油漆
17、20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如表所示:
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
(1)所得四杯溶液中________________一定是饱和溶液。
(2)如何判断丙溶液是否为饱和溶液 __________________。
(3)向乙溶液中继续加入3 g乙物质,此时乙溶液质量______________。
【答案】(1)甲、乙、丁
(2)取样,向丙溶液中加入少量的丙物质,观察是否继续溶解 (3)68 g
18、溶液在生命活动中起着十分重要的作用。
(1)医用碘酒,常用于杀菌消毒,其中的溶剂是________ 。
(2)医疗上常用0.9%的氯化钠溶液作为生理盐水,一袋100mL(密度约为1g/mL)的生理盐水,所含溶质的质量是________ 。
【答案】酒精; 0.9g
19、小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验。
请回答:
(1)操作中不规范的步骤是________(填序号)。
(2)改正后,图示实验中正确的操作顺序是_____________(填序号)。
(3)⑤中玻璃棒的作用是____________________________。
(4)小丽发现图示实验操作步骤不完整,应补充的是__________________。
【答案】(1)③ (2)②①④③⑤
(3)搅拌,加速溶解 (4)装瓶贴标签
20、水和溶液在生产生活中起着重要的作用。
(1)生活中可用________检测饮用水是否为硬水;
(2)下列物质分别放入足量水中,充分搅拌后可得到溶液的是 (填序号);
A. 细沙 B. 食用油 C. 面粉 D. 白糖
(3)某同学欲配制50g 8%的氯化钠溶液.在量取水时俯视读数,若其他环节均正确,则所配溶液的溶质质量分数________8%(填“大于”或“小于”或“等于”);
(4)铁在氧气中燃烧的实验里,集气瓶底放少量水的作用是________ 。
【答案】(1)肥皂水 (2)D
(3)大于 (4)防止溅落的物质炸裂瓶底
21、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
【答案】(1)20℃时,曱乙两种物质的溶解度相等
(2)饱和 (3)蒸发结晶 (4)丙
22、如图为甲、乙两种固体物质的溶解度曲线(水的密度约为1g/cm3)。
(1)两种物质中,溶解度受温度影响更大的是________(填“甲”或“乙”)。
(2)20℃时,乙的溶解度为________ 。
(3)下列实验中:10mL水XYZ为饱和溶液的是________(填“X”或“Y”或“Z”);若三中溶液中溶质的质量分数分别为a、b、c,则它们的大小关系是________(用“<”或“>”或“=”表示出来)。
【答案】甲;36g;Y;Z>Y>X
23、“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500 g溶质质量分数为0.9%的生理盐水,需氯化钠固体________g;下列实验操作与目的分析均正确的一组是______(填序号)。
(2)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有烧杯、玻璃棒、量筒和________。
(3)实验室若用恒温蒸发溶剂的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示,与丙烧杯中溶液溶质质量分数一定相同的是________(填序号)烧杯中的溶液。
【答案】(1)4.5;D (2)胶头滴管 (3)丁
三、问答题。
24、汽油和洗涤剂都能除去衣物上的油污,二者的原理分别是什么?
【答案】用汽油洗去衣物上的油污是利用汽油能溶解油污形成溶液来达到目的,利用的是溶解原理; 洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,除去衣物上的油污,是利用了乳化作用。
四、实验题。
25、多角度认识溶液,有助于我们更好地了解其在生活中的重要作用。
(1)溶液的形成
①将适量调味品加入水中,充分搅拌后不能形成溶液的是________(填标号)
a.食盐 b.蔗糖 c.花生油
②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水,写出生石灰与水反应的化学方程式________ 。
(2)溶液的性质
①关于溶液的说法正确的有________(填标号)
a.盐酸是纯净物 b.溶液是均一、稳定的
c.溶液的酸碱度可用石蕊溶液测定 d.饱和溶液不一定是浓溶液
②常温下,将某固态物质A溶于水,形成饱和溶液Ⅰ(如图1),进行以下实验,回答下列问题:
a.该物质的溶解度随温度升高而________(填“增大”或“减小”);
b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈红色,据此现象,写出对“饱和溶液”的理解________ 。
③常温时,该物质在不同质量的水中,溶解达到饱和状态,溶质的质量与水的质量关系如图2所示。
a.常温时,该物质的溶解度是________g。
b.D点时,该溶液的溶质质量分数为________(结果精确到0.1%)。
c.将A点状态的溶液变化到C点状态的操作步骤为________ 。
d.图中A,B,C三个点表示溶液中溶质质量分数从大到小的关系是________。
(3)溶液的用途
生活中溶液有许多用途,例如:碘酒能用于杀菌消毒;请再举一个生活中溶液应用的实例________ 。
【答案】(1)c;CaO+H2O═Ca(OH)2
(2)bd;减小;一定温度下,某物质的饱和溶液对于其它物质不一定是饱和的;40;28.6%;常温下,往A状态的溶液中加入20g溶质和20g水,使之充分溶解;C、A、B
(3)生理盐水给病人补充水分
五、计算题。
26、20℃时,KNO3的溶解度为31.6g,将20g KNO3投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数。
【答案】24%
人教版第9单元 溶液
一、选择题。
1、下列有关溶液的说法,正确的是( )
A.溶液一定是混合物 B.溶剂一定是水
C.溶质一定是固体 D.溶液一定是无色
2、溶液在生产、生活中应用广泛。下列有关溶液的说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶液中不能同时存在两种溶质
C.只有固体和液体可以作为溶质
D.外界条件不改变,溶质与溶剂不会分离
3、下列说法中,不正确的是( )
A.任何物质溶于水都能放出大量的热
B.煮沸的菜汤要比煮沸的水温度高
C.有水的手接触正在通电的电器设备更易发生触电事故
D.在严寒的冬季,厨房里的水结冰了而食醋却不易结
4、下列关于溶液的说法正确的是( )
A.溶质一定是固体 B.溶剂一定是水
C.溶液都是无色透明的 D.溶液都是均一稳定的
5、25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )
6、影响固体物质溶解度的因素有( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥温度
A.全部 B.②④⑥ C.②④⑤⑥ D.②③④⑤
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
8、0.9%的生理盐水广泛用于医疗中,若要配制500 g生理盐水,需要水的质量为( )
A.4.5 g B.45 g C.455 g D.495.5 g
9、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A. 从性质上看:丁烷具有可燃性
B. 从变化上看:丁烷完全燃烧只生成水
C. 从组成上看:丁烷由碳、氢两种元素组成
D. 从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
10、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
11、“恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性。
A.①②④ B.②④⑤ C.①③⑤ D.③④⑤
*12、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.泥土 C.蔗糖 D.汽油
13、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
14、地球深处的水处于超临界状态,称为超临界水,如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )
A. 在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B. 在超临界水中,2种物质的溶解度都随温度升高而增大
C. 450℃时,NaCl在超临界水中的溶解度为0.04g
D. 450℃时,可得到0.04%的CaCl2的超临界水溶液
15、实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是( )
A.用托盘天平称取10.0g氯化钠
B.用量筒量取90.0mL的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
二、填空题。
16、写出下列溶液中溶质的化学式:
(1)石灰水________。
(2)锌与稀硫酸恰好完全反应后的溶液________。
(3)食盐水________。
(4)80mL酒精与20mL水组成的溶液________。
(5)硫酸铜溶液显________色,溶质是________。
(6)氧气可用于________(填一种用途),但氧气也是导致铁锈蚀的因素之一。写出防止铁生锈的一种方法:________。
17、20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如表所示:
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
(1)所得四杯溶液中________________一定是饱和溶液。
(2)如何判断丙溶液是否为饱和溶液 __________________。
(3)向乙溶液中继续加入3 g乙物质,此时乙溶液质量______________。
18、溶液在生命活动中起着十分重要的作用。
(1)医用碘酒,常用于杀菌消毒,其中的溶剂是________ 。
(2)医疗上常用0.9%的氯化钠溶液作为生理盐水,一袋100mL(密度约为1g/mL)的生理盐水,所含溶质的质量是________ 。
19、小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验。
请回答:
(1)操作中不规范的步骤是________(填序号)。
(2)改正后,图示实验中正确的操作顺序是_____________(填序号)。
(3)⑤中玻璃棒的作用是____________________________。
(4)小丽发现图示实验操作步骤不完整,应补充的是__________________。
20、水和溶液在生产生活中起着重要的作用。
(1)生活中可用________检测饮用水是否为硬水;
(2)下列物质分别放入足量水中,充分搅拌后可得到溶液的是 (填序号);
A. 细沙 B. 食用油 C. 面粉 D. 白糖
(3)某同学欲配制50g 8%的氯化钠溶液.在量取水时俯视读数,若其他环节均正确,则所配溶液的溶质质量分数________8%(填“大于”或“小于”或“等于”);
(4)铁在氧气中燃烧的实验里,集气瓶底放少量水的作用是________ 。
21、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
22、如图为甲、乙两种固体物质的溶解度曲线(水的密度约为1g/cm3)。
(1)两种物质中,溶解度受温度影响更大的是________(填“甲”或“乙”)。
(2)20℃时,乙的溶解度为________ 。
(3)下列实验中:10mL水XYZ为饱和溶液的是________(填“X”或“Y”或“Z”);若三中溶液中溶质的质量分数分别为a、b、c,则它们的大小关系是________(用“<”或“>”或“=”表示出来)。
23、“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500 g溶质质量分数为0.9%的生理盐水,需氯化钠固体________g;下列实验操作与目的分析均正确的一组是______(填序号)。
(2)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有烧杯、玻璃棒、量筒和________。
(3)实验室若用恒温蒸发溶剂的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示,与丙烧杯中溶液溶质质量分数一定相同的是________(填序号)烧杯中的溶液。
三、问答题。
24、汽油和洗涤剂都能除去衣物上的油污,二者的原理分别是什么?
四、实验题。
25、多角度认识溶液,有助于我们更好地了解其在生活中的重要作用。
(1)溶液的形成
①将适量调味品加入水中,充分搅拌后不能形成溶液的是________(填标号)
a.食盐 b.蔗糖 c.花生油
②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水,写出生石灰与水反应的化学方程式________ 。
(2)溶液的性质
①关于溶液的说法正确的有________(填标号)
a.盐酸是纯净物 b.溶液是均一、稳定的
c.溶液的酸碱度可用石蕊溶液测定 d.饱和溶液不一定是浓溶液
②常温下,将某固态物质A溶于水,形成饱和溶液Ⅰ(如图1),进行以下实验,回答下列问题:
a.该物质的溶解度随温度升高而________(填“增大”或“减小”);
b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈红色,据此现象,写出对“饱和溶液”的理解________ 。
③常温时,该物质在不同质量的水中,溶解达到饱和状态,溶质的质量与水的质量关系如图2所示。
a.常温时,该物质的溶解度是________g。
b.D点时,该溶液的溶质质量分数为________(结果精确到0.1%)。
c.将A点状态的溶液变化到C点状态的操作步骤为________ 。
d.图中A,B,C三个点表示溶液中溶质质量分数从大到小的关系是________。
(3)溶液的用途
生活中溶液有许多用途,例如:碘酒能用于杀菌消毒;请再举一个生活中溶液应用的实例________ 。
五、计算题。
26、20℃时,KNO3的溶解度为31.6g,将20g KNO3投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数。
2022—2023学年化学人教版九年级下册第9单元 溶液 分层优选练习附答案
人教版第9单元 溶液
一、选择题。
1、下列有关溶液的说法,正确的是( )
A.溶液一定是混合物 B.溶剂一定是水
C.溶质一定是固体 D.溶液一定是无色
【答案】A
2、溶液在生产、生活中应用广泛。下列有关溶液的说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶液中不能同时存在两种溶质
C.只有固体和液体可以作为溶质
D.外界条件不改变,溶质与溶剂不会分离
【答案】D
3、下列说法中,不正确的是( )
A.任何物质溶于水都能放出大量的热
B.煮沸的菜汤要比煮沸的水温度高
C.有水的手接触正在通电的电器设备更易发生触电事故
D.在严寒的冬季,厨房里的水结冰了而食醋却不易结
【答案】A
4、下列关于溶液的说法正确的是( )
A.溶质一定是固体 B.溶剂一定是水
C.溶液都是无色透明的 D.溶液都是均一稳定的
【答案】D。
5、25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )
【答案】C
6、影响固体物质溶解度的因素有( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥温度
A.全部 B.②④⑥ C.②④⑤⑥ D.②③④⑤
【答案】B
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
【答案】D
8、0.9%的生理盐水广泛用于医疗中,若要配制500 g生理盐水,需要水的质量为( )
A.4.5 g B.45 g C.455 g D.495.5 g
【答案】D
9、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A. 从性质上看:丁烷具有可燃性
B. 从变化上看:丁烷完全燃烧只生成水
C. 从组成上看:丁烷由碳、氢两种元素组成
D. 从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
【答案】B
10、实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
【答案】C
11、“恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性。
A.①②④ B.②④⑤ C.①③⑤ D.③④⑤
【答案】B。
*12、把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.泥土 C.蔗糖 D.汽油
【答案】C。
13、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
【答案】A
14、地球深处的水处于超临界状态,称为超临界水,如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确的是( )
A. 在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B. 在超临界水中,2种物质的溶解度都随温度升高而增大
C. 450℃时,NaCl在超临界水中的溶解度为0.04g
D. 450℃时,可得到0.04%的CaCl2的超临界水溶液
【答案】C
15、实验室配制100g 10%的氯化钠溶液,有关实验操作不正确的是( )
A.用托盘天平称取10.0g氯化钠
B.用量筒量取90.0mL的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
【答案】C
二、填空题。
16、写出下列溶液中溶质的化学式:
(1)石灰水________。
(2)锌与稀硫酸恰好完全反应后的溶液________。
(3)食盐水________。
(4)80mL酒精与20mL水组成的溶液________。
(5)硫酸铜溶液显________色,溶质是________。
(6)氧气可用于________(填一种用途),但氧气也是导致铁锈蚀的因素之一。写出防止铁生锈的一种方法:________。
【答案】(1)Ca(OH)2 (2)ZnSO4 (3)NaCl
(4)C2H5OH (5)蓝;CuSO4 (6)冶炼钢铁;涂油漆
17、20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入四个盛有50 g水的烧杯中,充分溶解,其溶解情况如表所示:
物质 甲 乙 丙 丁
未溶解固体的质量/g 4.2 2 0 9.2
(1)所得四杯溶液中________________一定是饱和溶液。
(2)如何判断丙溶液是否为饱和溶液 __________________。
(3)向乙溶液中继续加入3 g乙物质,此时乙溶液质量______________。
【答案】(1)甲、乙、丁
(2)取样,向丙溶液中加入少量的丙物质,观察是否继续溶解 (3)68 g
18、溶液在生命活动中起着十分重要的作用。
(1)医用碘酒,常用于杀菌消毒,其中的溶剂是________ 。
(2)医疗上常用0.9%的氯化钠溶液作为生理盐水,一袋100mL(密度约为1g/mL)的生理盐水,所含溶质的质量是________ 。
【答案】酒精; 0.9g
19、小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验。
请回答:
(1)操作中不规范的步骤是________(填序号)。
(2)改正后,图示实验中正确的操作顺序是_____________(填序号)。
(3)⑤中玻璃棒的作用是____________________________。
(4)小丽发现图示实验操作步骤不完整,应补充的是__________________。
【答案】(1)③ (2)②①④③⑤
(3)搅拌,加速溶解 (4)装瓶贴标签
20、水和溶液在生产生活中起着重要的作用。
(1)生活中可用________检测饮用水是否为硬水;
(2)下列物质分别放入足量水中,充分搅拌后可得到溶液的是 (填序号);
A. 细沙 B. 食用油 C. 面粉 D. 白糖
(3)某同学欲配制50g 8%的氯化钠溶液.在量取水时俯视读数,若其他环节均正确,则所配溶液的溶质质量分数________8%(填“大于”或“小于”或“等于”);
(4)铁在氧气中燃烧的实验里,集气瓶底放少量水的作用是________ 。
【答案】(1)肥皂水 (2)D
(3)大于 (4)防止溅落的物质炸裂瓶底
21、右图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
(1)A点的含义是_____________________。
(2)在30℃时,向30克甲物质中加入50克水,充分溶解后所得溶液是____________溶液(填“饱和”或“不饱和”)。
(3)若乙中混有少量甲,最好采用_________的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_________________。
【答案】(1)20℃时,曱乙两种物质的溶解度相等
(2)饱和 (3)蒸发结晶 (4)丙
22、如图为甲、乙两种固体物质的溶解度曲线(水的密度约为1g/cm3)。
(1)两种物质中,溶解度受温度影响更大的是________(填“甲”或“乙”)。
(2)20℃时,乙的溶解度为________ 。
(3)下列实验中:10mL水XYZ为饱和溶液的是________(填“X”或“Y”或“Z”);若三中溶液中溶质的质量分数分别为a、b、c,则它们的大小关系是________(用“<”或“>”或“=”表示出来)。
【答案】甲;36g;Y;Z>Y>X
23、“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500 g溶质质量分数为0.9%的生理盐水,需氯化钠固体________g;下列实验操作与目的分析均正确的一组是______(填序号)。
(2)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有烧杯、玻璃棒、量筒和________。
(3)实验室若用恒温蒸发溶剂的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示,与丙烧杯中溶液溶质质量分数一定相同的是________(填序号)烧杯中的溶液。
【答案】(1)4.5;D (2)胶头滴管 (3)丁
三、问答题。
24、汽油和洗涤剂都能除去衣物上的油污,二者的原理分别是什么?
【答案】用汽油洗去衣物上的油污是利用汽油能溶解油污形成溶液来达到目的,利用的是溶解原理; 洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,除去衣物上的油污,是利用了乳化作用。
四、实验题。
25、多角度认识溶液,有助于我们更好地了解其在生活中的重要作用。
(1)溶液的形成
①将适量调味品加入水中,充分搅拌后不能形成溶液的是________(填标号)
a.食盐 b.蔗糖 c.花生油
②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水,写出生石灰与水反应的化学方程式________ 。
(2)溶液的性质
①关于溶液的说法正确的有________(填标号)
a.盐酸是纯净物 b.溶液是均一、稳定的
c.溶液的酸碱度可用石蕊溶液测定 d.饱和溶液不一定是浓溶液
②常温下,将某固态物质A溶于水,形成饱和溶液Ⅰ(如图1),进行以下实验,回答下列问题:
a.该物质的溶解度随温度升高而________(填“增大”或“减小”);
b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈红色,据此现象,写出对“饱和溶液”的理解________ 。
③常温时,该物质在不同质量的水中,溶解达到饱和状态,溶质的质量与水的质量关系如图2所示。
a.常温时,该物质的溶解度是________g。
b.D点时,该溶液的溶质质量分数为________(结果精确到0.1%)。
c.将A点状态的溶液变化到C点状态的操作步骤为________ 。
d.图中A,B,C三个点表示溶液中溶质质量分数从大到小的关系是________。
(3)溶液的用途
生活中溶液有许多用途,例如:碘酒能用于杀菌消毒;请再举一个生活中溶液应用的实例________ 。
【答案】(1)c;CaO+H2O═Ca(OH)2
(2)bd;减小;一定温度下,某物质的饱和溶液对于其它物质不一定是饱和的;40;28.6%;常温下,往A状态的溶液中加入20g溶质和20g水,使之充分溶解;C、A、B
(3)生理盐水给病人补充水分
五、计算题。
26、20℃时,KNO3的溶解度为31.6g,将20g KNO3投进50g水中,充分搅拌,制成20℃时的溶液,求该溶液中溶质的质量分数。
【答案】24%
同课章节目录
