专题6 化学反应与能量变化 复习 素养提升 教案
文档属性
| 名称 | 专题6 化学反应与能量变化 复习 素养提升 教案 |
|
|
| 格式 | DOCX | ||
| 文件大小 | 171.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 21:59:53 | ||
图片预览


文档简介
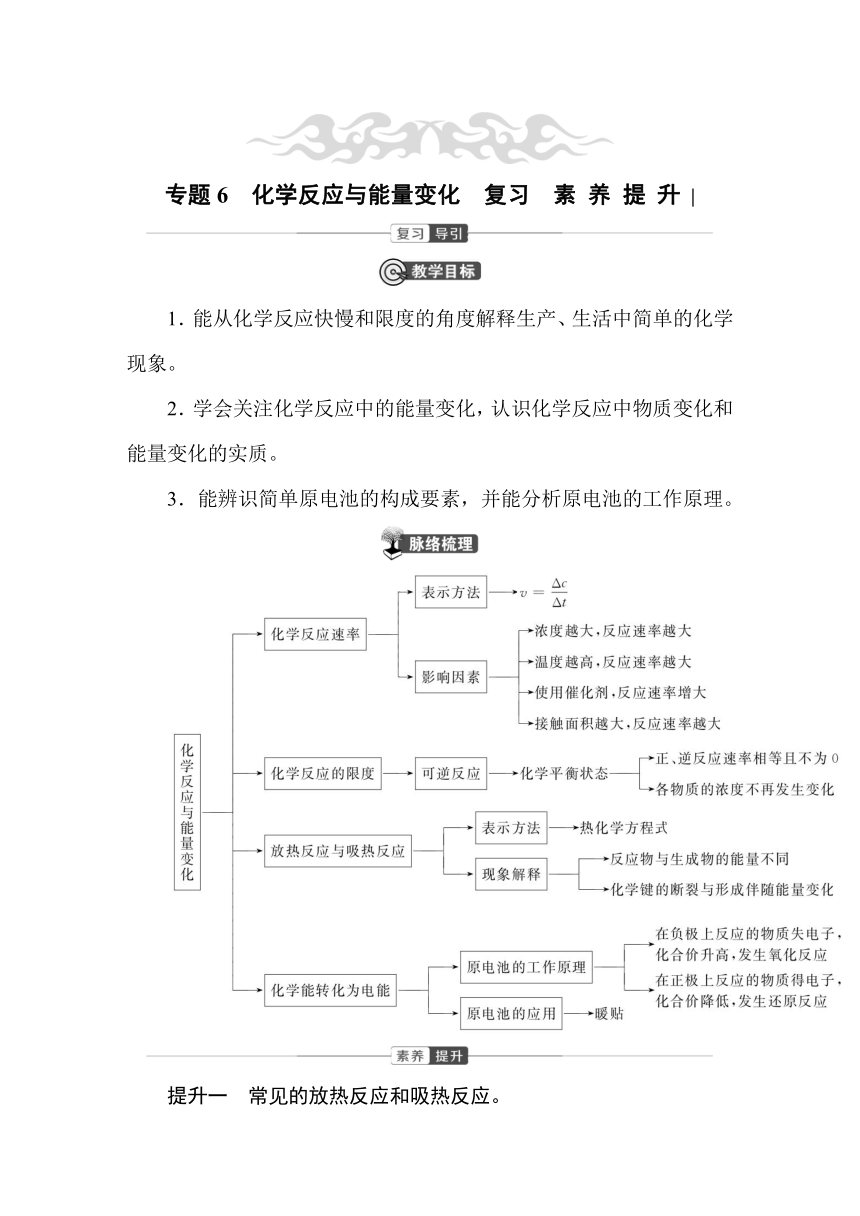
专题6 化学反应与能量变化 复习 素 养 提 升 |
1.能从化学反应快慢和限度的角度解释生产、生活中简单的化学现象。
2.学会关注化学反应中的能量变化,认识化学反应中物质变化和能量变化的实质。
3.能辨识简单原电池的构成要素,并能分析原电池的工作原理。
提升一 常见的放热反应和吸热反应。
1.放热反应
(1) 活泼金属与水或酸的反应:如Zn+H2SO4===ZnSO4+H2↑。
(2) 酸碱中和反应:如NaOH+HCl===NaCl+H2O。
(3) 燃烧反应:如2H2+O22H2O。
(4) 铝热反应:如2Al+Fe2O32Fe+Al2O3。
(5) 缓慢氧化:钢铁的腐蚀。
(6) 多数化合反应:CaO+H2O===Ca(OH)2。
2.吸热反应
(1) 铵盐与碱的反应:如氢氧化钡晶体与氯化铵的反应。
(2) 碳与水的反应:C+H2O(g)CO+H2。
(3) 碳与二氧化碳的反应:C+CO22CO。
(4) 多数分解反应:如CaCO3CaO+CO2↑。
下列属于吸热反应的是( C )
A.镁的燃烧反应 B.盐酸与氢氧化钠溶液的反应
C.水的分解反应 D.铝与氧化铁的铝热反应
【解析】 大多数分解反应属于吸热反应。
【素养要求】 认识常见的放热反应与吸热反应。
提升二 物质的量(或物质的量浓度)—时间图像。
例 T℃时,在恒容(VL)密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。
根据图像可进行以下计算。
(1) 求达到化学平衡时,某物质的平均反应速率、转化率。
v(Y)=mol·L-1·s-1, Y的转化率=×100%。
(2) 确定化学方程式的化学计量数之比。
X、Y、Z的化学计量数之比为(n1-n3)∶(n2-n3)∶n2。
一定温度下,在容积为2L的密闭容器中加入一定量的气体A和气体B发生反应,A和B的物质的量随时间变化的曲线如下图所示。
(1) 此反应的化学方程式为__2A B__。
(2) 0~t1时刻,以A的浓度变化表示的平均反应速率为__mol·L-1·min-1__。
(3) 下列能说明上述反应达到平衡状态的是__AD__(填字母)。
A.混合气体的压强保持不变
B.A与B的物质的量相等
C.相同时间内每消耗1mol A,同时消耗2mol B
D.混合气体中A的质量分数保持不变
【解析】 (1) 从开始反应至达到化学平衡状态,物质A减少了 6mol,物质B增加了3mol,所以A、B的化学计量数之比为2∶1,化学方程式为2A B。(2) 0~t1时刻,A的物质的量减少了2mol, A的浓度降低了1mol·L-1,所以0~t1时刻,以A的浓度变化表示的平均反应速率为mol·L-1·min-1。 (3) 2A B是气体分子数减少的反应,随着反应的进行,容器内气体压强减小,当气体压强不变时,说明该反应达到了化学平衡状态。从图像可知,平衡时A、B的物质的量不相等。相同时间内,若每消耗2mol A,同时消耗1mol B,则该反应达到化学平衡状态。当反应达到化学平衡状态时,各物质的浓度、质量分数都保持不变。
【素养要求】 能从化学反应的快慢和限度的角度解释简单的化学现象。
*选做强化题 将4mol A和2mol B在2L的密闭容器中混合,并在一定条件下发生反应:2A(s)+B(g) 2C(g),反应2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( D )
A.用物质A表示2s内的反应速率为0.3mol·L-1·s-1
B.用物质B表示2s内的反应速率为0.6mol·L-1·s-1
C.2s时v(C)=0.3mol·L-1·s-1
D.2s时物质B的浓度为0.7mol·L-1
【解析】 液态、固态物质的浓度视为常数,所以不能用固体表示化学反应速率,A项错误。化学反应速率指的是平均速率,C项错误。据题目条件知v(C)=0.6mol·L-1÷2 s=0.3mol·L-1·s-1,所以v(B)=0.3mol·L-1·s-1÷2=0.15mol·L-1·s-1,则2s时物质B的浓度为2mol÷2L-0.6mol·L-1÷2=0.7mol·L-1,因此B项错误,D项正确。
【素养要求】 能根据化学反应的快慢解释生活、生产中的简单化学现象。
1.能从化学反应快慢和限度的角度解释生产、生活中简单的化学现象。
2.学会关注化学反应中的能量变化,认识化学反应中物质变化和能量变化的实质。
3.能辨识简单原电池的构成要素,并能分析原电池的工作原理。
提升一 常见的放热反应和吸热反应。
1.放热反应
(1) 活泼金属与水或酸的反应:如Zn+H2SO4===ZnSO4+H2↑。
(2) 酸碱中和反应:如NaOH+HCl===NaCl+H2O。
(3) 燃烧反应:如2H2+O22H2O。
(4) 铝热反应:如2Al+Fe2O32Fe+Al2O3。
(5) 缓慢氧化:钢铁的腐蚀。
(6) 多数化合反应:CaO+H2O===Ca(OH)2。
2.吸热反应
(1) 铵盐与碱的反应:如氢氧化钡晶体与氯化铵的反应。
(2) 碳与水的反应:C+H2O(g)CO+H2。
(3) 碳与二氧化碳的反应:C+CO22CO。
(4) 多数分解反应:如CaCO3CaO+CO2↑。
下列属于吸热反应的是( C )
A.镁的燃烧反应 B.盐酸与氢氧化钠溶液的反应
C.水的分解反应 D.铝与氧化铁的铝热反应
【解析】 大多数分解反应属于吸热反应。
【素养要求】 认识常见的放热反应与吸热反应。
提升二 物质的量(或物质的量浓度)—时间图像。
例 T℃时,在恒容(VL)密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示。
根据图像可进行以下计算。
(1) 求达到化学平衡时,某物质的平均反应速率、转化率。
v(Y)=mol·L-1·s-1, Y的转化率=×100%。
(2) 确定化学方程式的化学计量数之比。
X、Y、Z的化学计量数之比为(n1-n3)∶(n2-n3)∶n2。
一定温度下,在容积为2L的密闭容器中加入一定量的气体A和气体B发生反应,A和B的物质的量随时间变化的曲线如下图所示。
(1) 此反应的化学方程式为__2A B__。
(2) 0~t1时刻,以A的浓度变化表示的平均反应速率为__mol·L-1·min-1__。
(3) 下列能说明上述反应达到平衡状态的是__AD__(填字母)。
A.混合气体的压强保持不变
B.A与B的物质的量相等
C.相同时间内每消耗1mol A,同时消耗2mol B
D.混合气体中A的质量分数保持不变
【解析】 (1) 从开始反应至达到化学平衡状态,物质A减少了 6mol,物质B增加了3mol,所以A、B的化学计量数之比为2∶1,化学方程式为2A B。(2) 0~t1时刻,A的物质的量减少了2mol, A的浓度降低了1mol·L-1,所以0~t1时刻,以A的浓度变化表示的平均反应速率为mol·L-1·min-1。 (3) 2A B是气体分子数减少的反应,随着反应的进行,容器内气体压强减小,当气体压强不变时,说明该反应达到了化学平衡状态。从图像可知,平衡时A、B的物质的量不相等。相同时间内,若每消耗2mol A,同时消耗1mol B,则该反应达到化学平衡状态。当反应达到化学平衡状态时,各物质的浓度、质量分数都保持不变。
【素养要求】 能从化学反应的快慢和限度的角度解释简单的化学现象。
*选做强化题 将4mol A和2mol B在2L的密闭容器中混合,并在一定条件下发生反应:2A(s)+B(g) 2C(g),反应2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( D )
A.用物质A表示2s内的反应速率为0.3mol·L-1·s-1
B.用物质B表示2s内的反应速率为0.6mol·L-1·s-1
C.2s时v(C)=0.3mol·L-1·s-1
D.2s时物质B的浓度为0.7mol·L-1
【解析】 液态、固态物质的浓度视为常数,所以不能用固体表示化学反应速率,A项错误。化学反应速率指的是平均速率,C项错误。据题目条件知v(C)=0.6mol·L-1÷2 s=0.3mol·L-1·s-1,所以v(B)=0.3mol·L-1·s-1÷2=0.15mol·L-1·s-1,则2s时物质B的浓度为2mol÷2L-0.6mol·L-1÷2=0.7mol·L-1,因此B项错误,D项正确。
【素养要求】 能根据化学反应的快慢解释生活、生产中的简单化学现象。
