鲁科版高中化学第1章第1节第1课时 原子结构与元素性质 课件 (21张ppt)
文档属性
| 名称 | 鲁科版高中化学第1章第1节第1课时 原子结构与元素性质 课件 (21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 09:47:55 | ||
图片预览








文档简介
(共21张PPT)
第1章 原子结构 元素周期律
第1节 原子结构与元素性质
回顾
与思考
1.物质是由什么粒子构成的?
2.化学变化的最小粒子是什么?
原子。
原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成。
3.为什么原子不是一个简单的、不可分割的实心球体?
4.为什么原子核也不是一个简单的、不可分割的实心球体?
原子核是由带正电荷的质子和不带电的中子构成的。
5.原子为什么不显电性?
原子核内质子所带正电荷总数等于核外电子所带负电荷总数。
分子、原子、离子等。
一个原子跟一个兵乓球体积之比,相当于兵乓球跟地球的体积之比。
6.你想象中的原子的体积小到什么程度?
如果把一个原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。
7.你想象中的原子核的体积小到什么程度?
在原子里,电子在原子核外的运动空间“相当的大”。
8.由第7个问题你得到什么启发?
回顾
与思考
01
实验探究
那么、原子的内部结构究竟是怎样的呢?
科学家是怎样探索原子内部结构的呢?
知识准备
α粒子:带正电荷,由2个带正电荷的质子和2个中性的中子组成,相等于一个氦原子核。由于带正电荷,它会受电磁场影响。在自然界内大部分的重元素都会在衰变时释放它。
β粒子:就是电子,也就是e-。
γ粒子:就是光子,几乎不可计。
穿透力:γ粒子>β粒子>α粒子
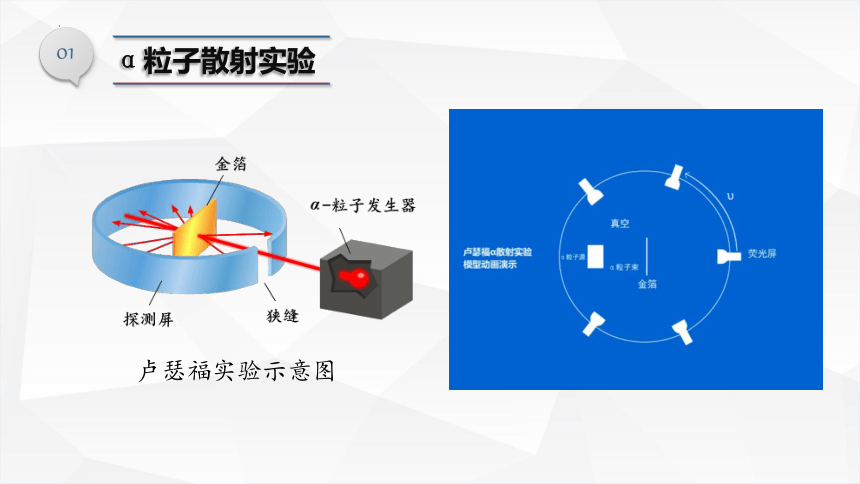
卢瑟福α粒子散射实验
01
α粒子散射实验
卢瑟福实验示意图
01
问题探究
卢瑟福所作α粒子散射实验
为什么是:
绝大多数α粒子直线通过;
少数α粒子转向;
个别α粒子反弹,
这一现象说明什么问题?
01
思考与回答
卢瑟福的原子核式模型
英国物理学家卢瑟福(E.Rutherford)在α粒子散射实验的基础上,经过理论分析和计算,提出了核式原子模型:原子由原子核和核外电子构成,原子核带正电荷,位于原子的中心;电子带负电荷,在原子核周围空间做高速运动。
02
原子结构
原子核的构成
微 粒 电 子 质 子 中 子
质量(kg) 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
(1)在原子中,质子数、核电荷数、核外电子数之间存在什么关系?
(2)原子的质量由哪些微粒决定?
(3)忽略电子质量,原子的相对质量与质子数、中子数有什么关系?
(1)核电荷数=质子数=核外电子数
(2)原子的质量主要由质子和中子决定
(3)原子的相对质量的数值=质子数+中子数
每一个质子带 电荷
相对质量约为
质子的数目决定
02
归纳与总结
原子核
核外电子
质子
中子
一个单位正
1
元素的种类
1
一个单位负
1/1836
元素的化学性质
原子
中子不带电,相对质量约为
围绕原子核作高速运动,每个电子带 电荷
相对质量为一个质子(中子)的
最外层电子数目决定
02
概念与分析
1.质量数
2.原子的相对质量和质量数的关系?
质量数(A)= 质子数(Z)+ 中子数(N)
3.原子组成式:
原子核中质子数和中子数之和称为质量数。
原子的相对质量和质量数的概念不同,计算方法不同,但中学阶段数值通用。
如 H
1
1
表示质量数为1,
质子数为1的氢原子
02
数字意义
O
8
16
2
2-
- 2
离子电荷
原子个数
质量数
质子数
化合价
的含义?
的中子数?
练习
中子数
电子数
微粒符号 质子数 中子数 质量数 用 表示
N 7 7 14
Al 13 14 27
Ar 18 22 40
Cl 17 18 35
H 1 0 1
02
填写表格
核素
03
自主探究
【回顾】
元素的种类是由原子核内的质子数决定的。元素是具有相同质子数(核电荷数)的同一类原子的总称。
【质疑】
同种元素原子的质子数相同,那么,中子数是否也相同呢
03
观察与思考
三种不同的氢原子
【比较】
三种氢原子结构的异同。
【质疑】
它们是不是同一种元素?
它们是不是同一种原子?它们之间有什么关系?
(1)元素:具有相同质子数(核电荷数)的同一类原子的总称。
8 O
16
8O
17
8O
18
(2)核素:具有一定数目质子和一定数目中子的一种原子。
氢元素三种核素: 氕 氘 氚
1
H
H
H
1
1
1
2
3
(3)同位素:
质子数相同而中子数
不同的同一元素的不同核素互称
为同位素。
三者关系:
核素
核素
……
元素
(同位素)
03
归纳与总结
03
同位素性质
a.同位素的化学性质相同,物理性质有一定差别。
b.天然存在的同一元素的各同位素所占的原子百分组成不变。
03
同位素性质
同位素分为稳定同位素和放射性同位素。
放射性同位素最常见的应用是作为放射源和进行同位素示踪。
例如:金属探伤 、治疗肿瘤、食物保鲜等。
同位素的应用
同位素、元素、同素异形体的比较:
H C
具有相同核电荷数的同一类原子的总称
广义的原子
区别与联系:
1、联系:同位素属于同一元素的原子;
同素异形体由同一元素的原子构成。
2、区别:同位素有1800余种,元素只有100多种。
金刚石与石墨
氧气与臭氧
11H、21H、31H
由同种元素组成的结构和性质不同的单质
质子数相同,中子数不同的同一元素的不同原子
单质
原子
元素
实例
定义
定义对象
同素异形体
同位素
03
巩固练习
1.下列各组物质中,互为同位素的是 ( )
(A)O2、、O3 、O4 (B)H2、D2、T2
(C)H2O、D2O、 T2O (D) 和
2.下列说法正确的是( )
(A)同种元素的质子数必定相同
(B)不同元素原子的质量数必定不同
(C)原子核都是由质子和中子构成的
(D)凡是核外电子数相同的微粒必定属于同一元素
D
A
42
THANK YOU
第1章 原子结构 元素周期律
第1节 原子结构与元素性质
回顾
与思考
1.物质是由什么粒子构成的?
2.化学变化的最小粒子是什么?
原子。
原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成。
3.为什么原子不是一个简单的、不可分割的实心球体?
4.为什么原子核也不是一个简单的、不可分割的实心球体?
原子核是由带正电荷的质子和不带电的中子构成的。
5.原子为什么不显电性?
原子核内质子所带正电荷总数等于核外电子所带负电荷总数。
分子、原子、离子等。
一个原子跟一个兵乓球体积之比,相当于兵乓球跟地球的体积之比。
6.你想象中的原子的体积小到什么程度?
如果把一个原子比作一个庞大的体育场,而原子核只相当于一只蚂蚁。
7.你想象中的原子核的体积小到什么程度?
在原子里,电子在原子核外的运动空间“相当的大”。
8.由第7个问题你得到什么启发?
回顾
与思考
01
实验探究
那么、原子的内部结构究竟是怎样的呢?
科学家是怎样探索原子内部结构的呢?
知识准备
α粒子:带正电荷,由2个带正电荷的质子和2个中性的中子组成,相等于一个氦原子核。由于带正电荷,它会受电磁场影响。在自然界内大部分的重元素都会在衰变时释放它。
β粒子:就是电子,也就是e-。
γ粒子:就是光子,几乎不可计。
穿透力:γ粒子>β粒子>α粒子
卢瑟福α粒子散射实验
01
α粒子散射实验
卢瑟福实验示意图
01
问题探究
卢瑟福所作α粒子散射实验
为什么是:
绝大多数α粒子直线通过;
少数α粒子转向;
个别α粒子反弹,
这一现象说明什么问题?
01
思考与回答
卢瑟福的原子核式模型
英国物理学家卢瑟福(E.Rutherford)在α粒子散射实验的基础上,经过理论分析和计算,提出了核式原子模型:原子由原子核和核外电子构成,原子核带正电荷,位于原子的中心;电子带负电荷,在原子核周围空间做高速运动。
02
原子结构
原子核的构成
微 粒 电 子 质 子 中 子
质量(kg) 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
(1)在原子中,质子数、核电荷数、核外电子数之间存在什么关系?
(2)原子的质量由哪些微粒决定?
(3)忽略电子质量,原子的相对质量与质子数、中子数有什么关系?
(1)核电荷数=质子数=核外电子数
(2)原子的质量主要由质子和中子决定
(3)原子的相对质量的数值=质子数+中子数
每一个质子带 电荷
相对质量约为
质子的数目决定
02
归纳与总结
原子核
核外电子
质子
中子
一个单位正
1
元素的种类
1
一个单位负
1/1836
元素的化学性质
原子
中子不带电,相对质量约为
围绕原子核作高速运动,每个电子带 电荷
相对质量为一个质子(中子)的
最外层电子数目决定
02
概念与分析
1.质量数
2.原子的相对质量和质量数的关系?
质量数(A)= 质子数(Z)+ 中子数(N)
3.原子组成式:
原子核中质子数和中子数之和称为质量数。
原子的相对质量和质量数的概念不同,计算方法不同,但中学阶段数值通用。
如 H
1
1
表示质量数为1,
质子数为1的氢原子
02
数字意义
O
8
16
2
2-
- 2
离子电荷
原子个数
质量数
质子数
化合价
的含义?
的中子数?
练习
中子数
电子数
微粒符号 质子数 中子数 质量数 用 表示
N 7 7 14
Al 13 14 27
Ar 18 22 40
Cl 17 18 35
H 1 0 1
02
填写表格
核素
03
自主探究
【回顾】
元素的种类是由原子核内的质子数决定的。元素是具有相同质子数(核电荷数)的同一类原子的总称。
【质疑】
同种元素原子的质子数相同,那么,中子数是否也相同呢
03
观察与思考
三种不同的氢原子
【比较】
三种氢原子结构的异同。
【质疑】
它们是不是同一种元素?
它们是不是同一种原子?它们之间有什么关系?
(1)元素:具有相同质子数(核电荷数)的同一类原子的总称。
8 O
16
8O
17
8O
18
(2)核素:具有一定数目质子和一定数目中子的一种原子。
氢元素三种核素: 氕 氘 氚
1
H
H
H
1
1
1
2
3
(3)同位素:
质子数相同而中子数
不同的同一元素的不同核素互称
为同位素。
三者关系:
核素
核素
……
元素
(同位素)
03
归纳与总结
03
同位素性质
a.同位素的化学性质相同,物理性质有一定差别。
b.天然存在的同一元素的各同位素所占的原子百分组成不变。
03
同位素性质
同位素分为稳定同位素和放射性同位素。
放射性同位素最常见的应用是作为放射源和进行同位素示踪。
例如:金属探伤 、治疗肿瘤、食物保鲜等。
同位素的应用
同位素、元素、同素异形体的比较:
H C
具有相同核电荷数的同一类原子的总称
广义的原子
区别与联系:
1、联系:同位素属于同一元素的原子;
同素异形体由同一元素的原子构成。
2、区别:同位素有1800余种,元素只有100多种。
金刚石与石墨
氧气与臭氧
11H、21H、31H
由同种元素组成的结构和性质不同的单质
质子数相同,中子数不同的同一元素的不同原子
单质
原子
元素
实例
定义
定义对象
同素异形体
同位素
03
巩固练习
1.下列各组物质中,互为同位素的是 ( )
(A)O2、、O3 、O4 (B)H2、D2、T2
(C)H2O、D2O、 T2O (D) 和
2.下列说法正确的是( )
(A)同种元素的质子数必定相同
(B)不同元素原子的质量数必定不同
(C)原子核都是由质子和中子构成的
(D)凡是核外电子数相同的微粒必定属于同一元素
D
A
42
THANK YOU
