5.1硫及其化合物 课件(17张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1硫及其化合物 课件(17张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 09:49:15 | ||
图片预览


文档简介
(共17张PPT)
滴雨穿孔
临沂市高中化学优质课评比
硫及其化合物
第一课时
学
习
目
标
通过含硫物质及其转化关系的认识过程,建立物质性质与物质用途的关联。
通过实验探究SO2的主要化学性质,形成基于物质类别、元素价态对物质性质进行预测和检验的认识模型。
通过设计如何防治酸雨等问题,感受化学物质及其变化的价值,进一步增强合理使用化学品的意识。
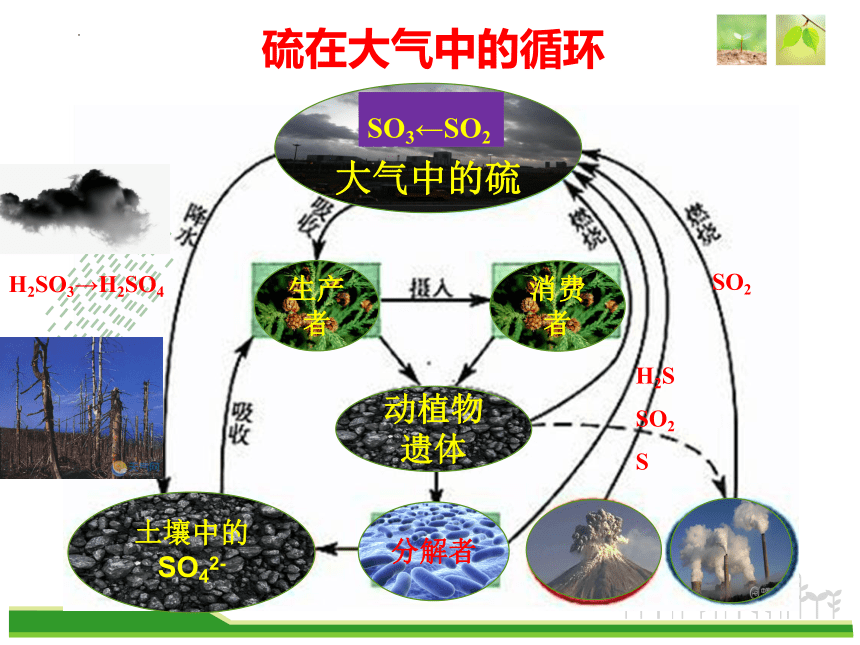
生产者
消费者
动植物
遗体
土壤中的
SO42-
分解者
大气中的硫
硫在大气中的循环
H2S
SO2S
SO2
H2SO3→H2SO4
SO3←SO2
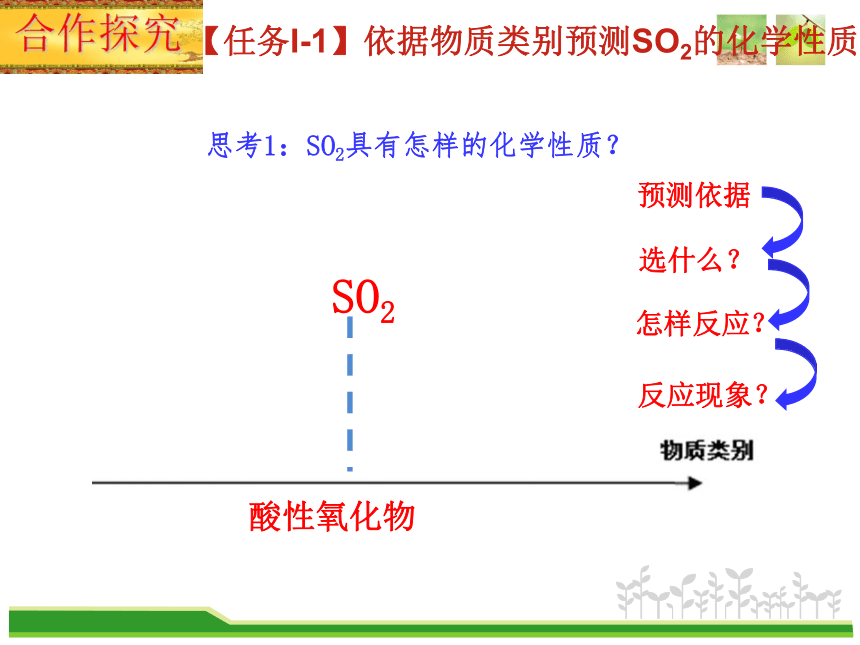
SO2
酸性氧化物
思考1:SO2具有怎样的化学性质?
合作探究
【任务I-1】依据物质类别预测SO2的化学性质
预测依据
选什么?
怎样反应?
反应现象?
合作探究
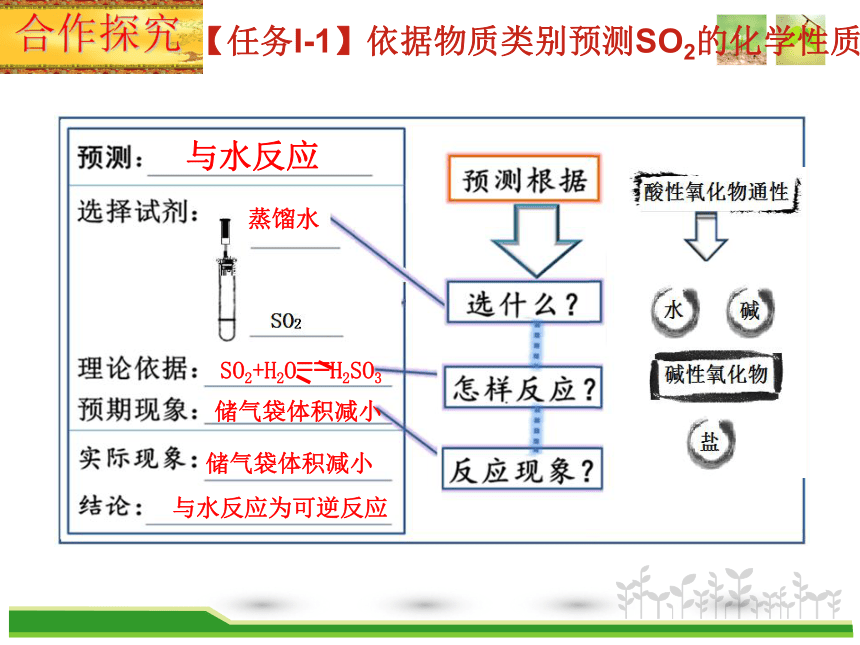
【任务I-1】依据物质类别预测SO2的化学性质
与水反应
蒸馏水
SO2+H2O==H2SO3
储气袋体积减小
储气袋体积减小
与水反应为可逆反应
SO2
酸性氧化物
+4
-2
+6
0
+4
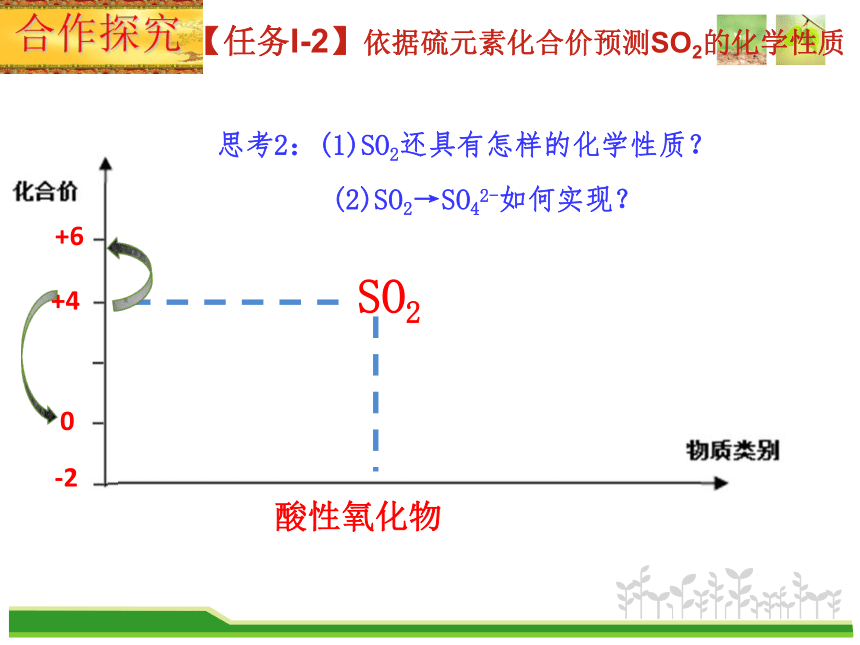
思考2:(1)SO2还具有怎样的化学性质?
(2)SO2→SO42-如何实现?
合作探究
【任务I-2】依据硫元素化合价预测SO2的化学性质
合作探究
【任务I-2】依据硫元素化合价预测SO2的化学性质
实验:SO2与 反应
选择试剂:
理论依据: 。
预期现象: 。
实际现象: 。
实验结论: 。
提供下列试剂
FeCl3溶液、H2O2
酸性KMnO4溶液
H2S、BaCl2溶液
新制氯水、SO2
依据硫元素化合价预测SO2的化学性质
实验:SO2与 反应
选择试剂:
理论依据: 。
预期现象: 。
实际现象: 。
实验结论: 。
提供下列试剂
展示交流
KMnO4
KMnO4
2MnO4-+5SO2→2Mn2++5SO42-
溶液紫红色褪去
溶液紫红色褪去
SO2具有还原性
FeCl3溶液、H2O2
酸性KMnO4溶液
H2S、BaCl2溶液
新制氯水、SO2
SO2
酸性氧化物
+4
-2
+6
0
+4
思考2:(1)SO2还具有怎样的化学性质?
(2)SO2→SO42-如何实现?
(3)SO2→S如何实现?
合作探究
【任务I-2】依据硫元素化合价预测SO2的化学性质
SO2
酸性氧化物
+4
-2
+6
0
+4
H2S、S、SO3、H2SO3、H2SO4
将上述含硫物质按SO2的方式填入下图中,构建含硫物质的价类二维图
合作探究
【任务II】构建含硫物质的价类二维图
含硫物质的价类二维图
展示交流
单质 酸性氧化物 酸式盐 酸 正盐
+6
+4
0
-2
-
-
S
SO2
SO3
H2SO4
H2SO3
H2S
-
| | | | |
-
硫化物 单质 酸性氧化物 酸式盐 酸 正盐
+6
+4
0
-1
-2
-
-
S
SO2
SO3
H2SO4
H2SO3
H2S
-
| | | | | |
-
CaSO3
FeS2
CaSO4
-
思考3:
(1)SO3、H2SO3、CaSO3、H2S
(2)如何实现 S→H2SO4 、FeS2 →H2SO4 的转化?
【任务II-1】预测其它含硫物质的化学性质
合作探究
【拓展应用】某科技小组同学采集了龙门石窟雨水样品,在实验室中每隔一段时间测定其pH:
时间 开始 8小时 16小时 24小时 32小时 40小时 48小时 56小时 64小时
pH 5.0 4.8 4.5 4.2 4.0 4.0 4.0 4.0 4.0
硫化物 单质 酸性氧化物 酸式盐 酸 正盐
+6
+4
0
-1
-2
-
-
S
SO2
SO3
H2SO4
H2SO3
H2S
-
| | | | | |
-
CaSO3
FeS2
CaSO4
-
思考4:
(1)乐山大佛、龙门石窟原面目全非的原因是什么?
(2)如何防治酸雨?
CaO
【任务II-2】酸雨的形成与防治
合作探究
试剂:品红试液
合作探究
【任务III】SO2的特性:漂白性
实验:SO2与 反应
选择试剂:
理论依据: 。
预期现象: 。
实际现象: 。
实验结论: 。
应用
预测
实验验证
认识模型
物质类别
化合价
从 生 活 中 来
到 生 活 中 去
作业
绿水青山就是金山银山,我们同住地球村,环境保护人人有责,酸雨的防治途径有多种,请同学们查阅资料,完成一份防治酸雨的报告。
滴雨穿孔
临沂市高中化学优质课评比
硫及其化合物
第一课时
学
习
目
标
通过含硫物质及其转化关系的认识过程,建立物质性质与物质用途的关联。
通过实验探究SO2的主要化学性质,形成基于物质类别、元素价态对物质性质进行预测和检验的认识模型。
通过设计如何防治酸雨等问题,感受化学物质及其变化的价值,进一步增强合理使用化学品的意识。
生产者
消费者
动植物
遗体
土壤中的
SO42-
分解者
大气中的硫
硫在大气中的循环
H2S
SO2S
SO2
H2SO3→H2SO4
SO3←SO2
SO2
酸性氧化物
思考1:SO2具有怎样的化学性质?
合作探究
【任务I-1】依据物质类别预测SO2的化学性质
预测依据
选什么?
怎样反应?
反应现象?
合作探究
【任务I-1】依据物质类别预测SO2的化学性质
与水反应
蒸馏水
SO2+H2O==H2SO3
储气袋体积减小
储气袋体积减小
与水反应为可逆反应
SO2
酸性氧化物
+4
-2
+6
0
+4
思考2:(1)SO2还具有怎样的化学性质?
(2)SO2→SO42-如何实现?
合作探究
【任务I-2】依据硫元素化合价预测SO2的化学性质
合作探究
【任务I-2】依据硫元素化合价预测SO2的化学性质
实验:SO2与 反应
选择试剂:
理论依据: 。
预期现象: 。
实际现象: 。
实验结论: 。
提供下列试剂
FeCl3溶液、H2O2
酸性KMnO4溶液
H2S、BaCl2溶液
新制氯水、SO2
依据硫元素化合价预测SO2的化学性质
实验:SO2与 反应
选择试剂:
理论依据: 。
预期现象: 。
实际现象: 。
实验结论: 。
提供下列试剂
展示交流
KMnO4
KMnO4
2MnO4-+5SO2→2Mn2++5SO42-
溶液紫红色褪去
溶液紫红色褪去
SO2具有还原性
FeCl3溶液、H2O2
酸性KMnO4溶液
H2S、BaCl2溶液
新制氯水、SO2
SO2
酸性氧化物
+4
-2
+6
0
+4
思考2:(1)SO2还具有怎样的化学性质?
(2)SO2→SO42-如何实现?
(3)SO2→S如何实现?
合作探究
【任务I-2】依据硫元素化合价预测SO2的化学性质
SO2
酸性氧化物
+4
-2
+6
0
+4
H2S、S、SO3、H2SO3、H2SO4
将上述含硫物质按SO2的方式填入下图中,构建含硫物质的价类二维图
合作探究
【任务II】构建含硫物质的价类二维图
含硫物质的价类二维图
展示交流
单质 酸性氧化物 酸式盐 酸 正盐
+6
+4
0
-2
-
-
S
SO2
SO3
H2SO4
H2SO3
H2S
-
| | | | |
-
硫化物 单质 酸性氧化物 酸式盐 酸 正盐
+6
+4
0
-1
-2
-
-
S
SO2
SO3
H2SO4
H2SO3
H2S
-
| | | | | |
-
CaSO3
FeS2
CaSO4
-
思考3:
(1)SO3、H2SO3、CaSO3、H2S
(2)如何实现 S→H2SO4 、FeS2 →H2SO4 的转化?
【任务II-1】预测其它含硫物质的化学性质
合作探究
【拓展应用】某科技小组同学采集了龙门石窟雨水样品,在实验室中每隔一段时间测定其pH:
时间 开始 8小时 16小时 24小时 32小时 40小时 48小时 56小时 64小时
pH 5.0 4.8 4.5 4.2 4.0 4.0 4.0 4.0 4.0
硫化物 单质 酸性氧化物 酸式盐 酸 正盐
+6
+4
0
-1
-2
-
-
S
SO2
SO3
H2SO4
H2SO3
H2S
-
| | | | | |
-
CaSO3
FeS2
CaSO4
-
思考4:
(1)乐山大佛、龙门石窟原面目全非的原因是什么?
(2)如何防治酸雨?
CaO
【任务II-2】酸雨的形成与防治
合作探究
试剂:品红试液
合作探究
【任务III】SO2的特性:漂白性
实验:SO2与 反应
选择试剂:
理论依据: 。
预期现象: 。
实际现象: 。
实验结论: 。
应用
预测
实验验证
认识模型
物质类别
化合价
从 生 活 中 来
到 生 活 中 去
作业
绿水青山就是金山银山,我们同住地球村,环境保护人人有责,酸雨的防治途径有多种,请同学们查阅资料,完成一份防治酸雨的报告。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
