专题6 第1单元 第2课时 影响化学反应速率的因素 课后练习(含答案)
文档属性
| 名称 | 专题6 第1单元 第2课时 影响化学反应速率的因素 课后练习(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 273.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 22:59:33 | ||
图片预览

文档简介
第2课时 影响化学反应速率的因素 课后练习
1.水—碳催化制氢的反应为C+H2OH2+CO,可提高碳的资源化利用。下列关于该反应的说法正确的是( )
A.增大压强能减小化学反应速率
B.合适的催化剂能增大化学反应速率
C.增大水蒸气的浓度能减小化学反应速率
D.增加碳的用量能减小化学反应速率
2.下列各组反应(表中金属粉末均为 0.1mol)在反应刚开始时,放出 H2的速率最大的是( )
选项 金属(粉末状) 酸的浓度及体积 反应温度/℃
A Mg 6mol·L-1硝酸 10mL 30
B Mg 3mol·L-1盐酸 10mL 60
C Fe 3mol·L-1盐酸 10mL 60
D Mg 3mol·L-1硫酸 10mL 60
3.NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成N2和CO2。下列关于该反应的叙述正确的是( )
A.使用适当的催化剂不能改变反应速率
B.减小压强能增大反应速率
C.升高温度能增大反应速率
D.改变压强对反应速率无影响
4.实验室用锌粒与2mol·L-1硫酸反应制取H2。下列措施不能增大反应速率的是( )
A.用锌粉代替锌粒 B.改用3mol·L-1硫酸
C.改用热的2mol·L-1硫酸 D.向该硫酸中加入等体积的水
5.某密闭容器中发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。不改变其他条件,下列措施不能增大反应速率的是( )
A.升高温度 B.减小容器体积
C.保持容积不变,通入He D.选用合适的催化剂
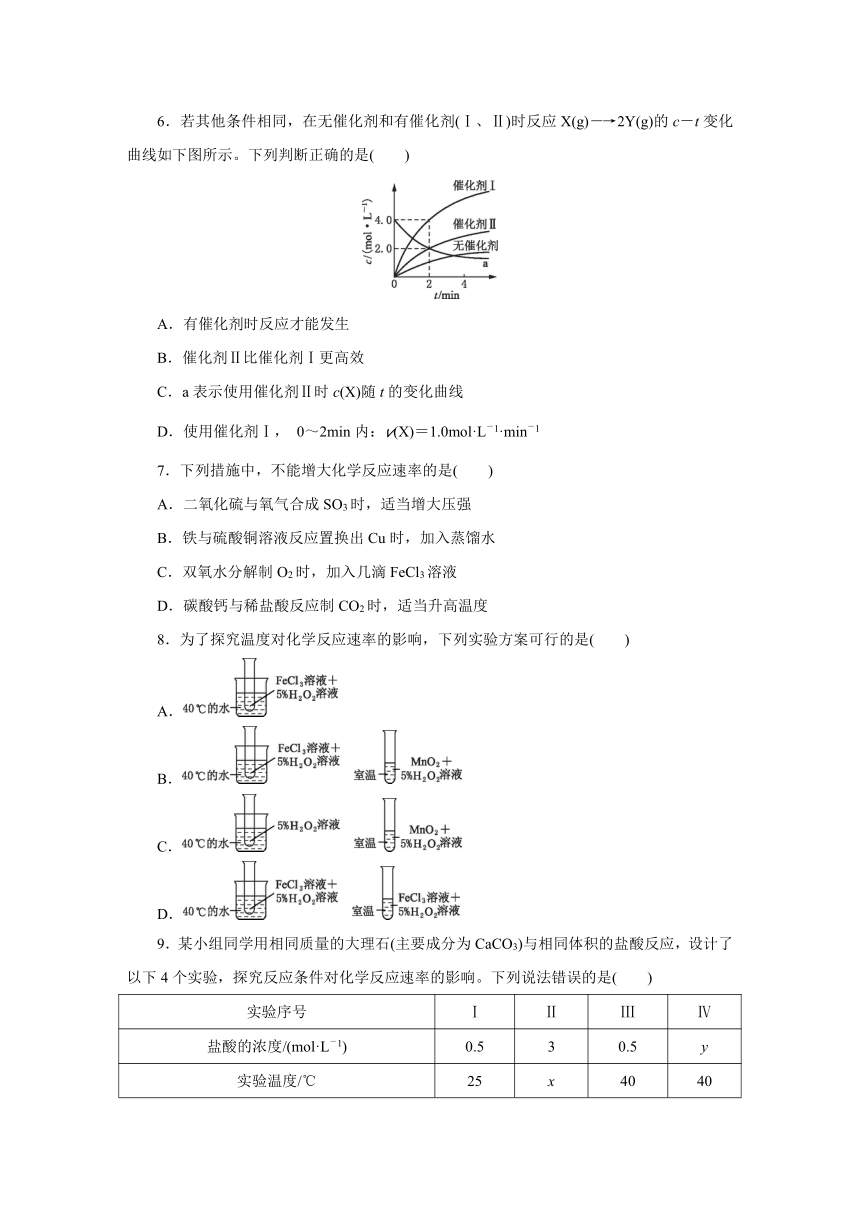
6.若其他条件相同,在无催化剂和有催化剂(Ⅰ、Ⅱ)时反应X(g)―→2Y(g)的c-t变化曲线如下图所示。下列判断正确的是( )
A.有催化剂时反应才能发生
B.催化剂Ⅱ比催化剂Ⅰ更高效
C.a表示使用催化剂Ⅱ时c(X)随t的变化曲线
D.使用催化剂Ⅰ, 0~2min内:v(X)=1.0mol·L-1·min-1
7.下列措施中,不能增大化学反应速率的是( )
A.二氧化硫与氧气合成SO3时,适当增大压强
B.铁与硫酸铜溶液反应置换出Cu时,加入蒸馏水
C.双氧水分解制O2时,加入几滴FeCl3溶液
D.碳酸钙与稀盐酸反应制CO2时,适当升高温度
8.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
A.
B.
C.
D.
9.某小组同学用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸反应,设计了以下4个实验,探究反应条件对化学反应速率的影响。下列说法错误的是( )
实验序号 Ⅰ Ⅱ Ⅲ Ⅳ
盐酸的浓度/(mol·L-1) 0.5 3 0.5 y
实验温度/℃ 25 x 40 40
是否使用催化剂 否 否 是 否
A.若实验Ⅰ、Ⅱ研究浓度对反应速率的影响,则x的值为25
B.若实验Ⅱ、Ⅳ研究温度对反应速率的影响,则y的值为3
C.实验Ⅰ、Ⅲ可研究温度对反应速率的影响
D.可通过实验Ⅲ、Ⅳ研究催化剂对反应速率的影响
10.为了研究CaCO3与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,并绘制曲线。在O~t1、t1~t2、t2~t3、t3~t4各相同的时间段里,收集到的气体最多的时间段为 ,反应速率最大的时间段为 ,反应速率最小的时间段为 。
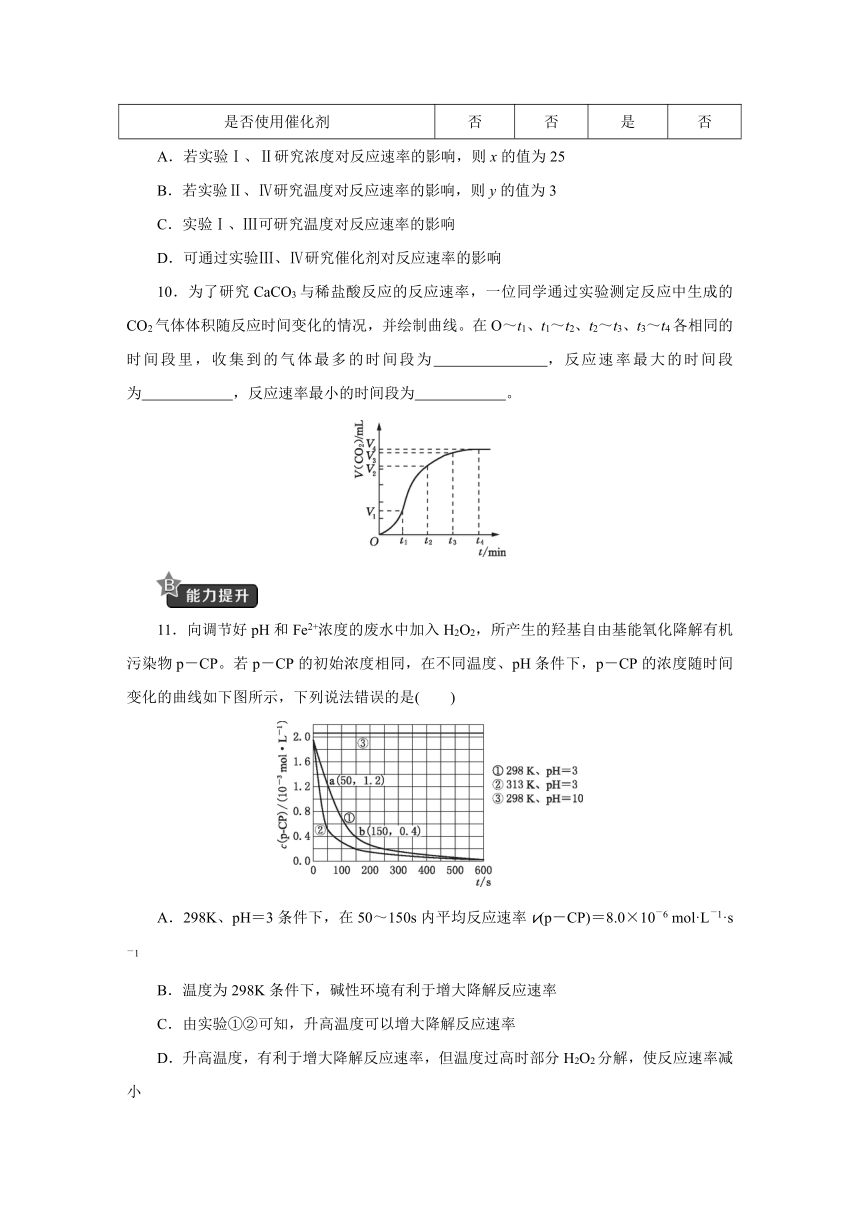
11.向调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解有机污染物p-CP。若p-CP的初始浓度相同,在不同温度、pH条件下,p-CP的浓度随时间变化的曲线如下图所示,下列说法错误的是( )
A.298K、pH=3条件下,在50~150s内平均反应速率v(p-CP)=8.0×10-6 mol·L-1·s-1
B.温度为298K条件下,碱性环境有利于增大降解反应速率
C.由实验①②可知,升高温度可以增大降解反应速率
D.升高温度,有利于增大降解反应速率,但温度过高时部分H2O2分解,使反应速率减小
12.某学习小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
实验编号 H2C2O4溶液 酸性KMnO4溶液 温度/℃
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
① 0.10 2.0 0.01 3.0 25
② 0.20 2.0 0.01 3.0 25
③ 0.20 2.0 0.01 3.0 50
(1) 实验时发生的反应为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。为了顺利观察KMnO4溶液颜色的变化,起始时H2C2O4与KMnO4的物质的量关系需要满足n(H2C2O4)∶n(KMnO4)≥ 。
(2) 探究反应物浓度对化学反应速率影响的实验编号是 ,探究温度对化学反应速率影响的实验编号是 。
(3) 测得实验①中KMnO4溶液的褪色时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= 。
(4) 实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是:a.该反应是放热反应,溶液温度逐渐升高,反应速率增大;b. 。
第2课时 影响化学反应速率的因素 课后练习
1.水—碳催化制氢的反应为C+H2OH2+CO,可提高碳的资源化利用。下列关于该反应的说法正确的是( B )
A.增大压强能减小化学反应速率
B.合适的催化剂能增大化学反应速率
C.增大水蒸气的浓度能减小化学反应速率
D.增加碳的用量能减小化学反应速率
2.下列各组反应(表中金属粉末均为 0.1mol)在反应刚开始时,放出 H2的速率最大的是( D )
选项 金属(粉末状) 酸的浓度及体积 反应温度/℃
A Mg 6mol·L-1硝酸 10mL 30
B Mg 3mol·L-1盐酸 10mL 60
C Fe 3mol·L-1盐酸 10mL 60
D Mg 3mol·L-1硫酸 10mL 60
3.NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成N2和CO2。下列关于该反应的叙述正确的是( C )
A.使用适当的催化剂不能改变反应速率
B.减小压强能增大反应速率
C.升高温度能增大反应速率
D.改变压强对反应速率无影响
【解析】 有气体参加的反应,减小压强,化学反应速率减小。
4.实验室用锌粒与2mol·L-1硫酸反应制取H2。下列措施不能增大反应速率的是( D )
A.用锌粉代替锌粒 B.改用3mol·L-1硫酸
C.改用热的2mol·L-1硫酸 D.向该硫酸中加入等体积的水
5.某密闭容器中发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。不改变其他条件,下列措施不能增大反应速率的是( C )
A.升高温度 B.减小容器体积
C.保持容积不变,通入He D.选用合适的催化剂
6.若其他条件相同,在无催化剂和有催化剂(Ⅰ、Ⅱ)时反应X(g)―→2Y(g)的c-t变化曲线如下图所示。下列判断正确的是( D )
A.有催化剂时反应才能发生
B.催化剂Ⅱ比催化剂Ⅰ更高效
C.a表示使用催化剂Ⅱ时c(X)随t的变化曲线
D.使用催化剂Ⅰ, 0~2min内:v(X)=1.0mol·L-1·min-1
【解析】 由图知无催化剂反应也能发生,A项错误。单位时间内,使用催化剂Ⅰ的浓度变化量更大,因此催化剂Ⅰ比催化剂Ⅱ更高效,B项错误。a曲线表示的是反应物浓度随时间的变化曲线,即表示X的浓度变化的曲线,2min内,X的浓度减少2.0mol·L-1,由X(g)2Y(g)可知,生成物Y的浓度应增加4.0mol·L-1,其对应的应是使用催化剂Ⅰ的曲线,C项错误。使用催化剂Ⅰ, 0~2min内:v(Y)==2.0mol·L-1·min-1, v(X)=v(Y)=1.0mol·L-1·min-1, D项正确。
7.下列措施中,不能增大化学反应速率的是( B )
A.二氧化硫与氧气合成SO3时,适当增大压强
B.铁与硫酸铜溶液反应置换出Cu时,加入蒸馏水
C.双氧水分解制O2时,加入几滴FeCl3溶液
D.碳酸钙与稀盐酸反应制CO2时,适当升高温度
8.为了探究温度对化学反应速率的影响,下列实验方案可行的是( D )
A.
B.
C.
D.
【解析】 A项中缺少对比实验,错误。B、C项出现两个变量,无法比较,错误。D项中只有温度不同,其他条件都相同,只有一个变量,该方案可行。
9.某小组同学用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸反应,设计了以下4个实验,探究反应条件对化学反应速率的影响。下列说法错误的是( C )
实验序号 Ⅰ Ⅱ Ⅲ Ⅳ
盐酸的浓度/(mol·L-1) 0.5 3 0.5 y
实验温度/℃ 25 x 40 40
是否使用催化剂 否 否 是 否
A.若实验Ⅰ、Ⅱ研究浓度对反应速率的影响,则x的值为25
B.若实验Ⅱ、Ⅳ研究温度对反应速率的影响,则y的值为3
C.实验Ⅰ、Ⅲ可研究温度对反应速率的影响
D.可通过实验Ⅲ、Ⅳ研究催化剂对反应速率的影响
10.为了研究CaCO3与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,并绘制曲线。在O~t1、t1~t2、t2~t3、t3~t4各相同的时间段里,收集到的气体最多的时间段为__t1~t2__,反应速率最大的时间段为__t1~t2__,反应速率最小的时间段为__t3~t4__。
11.向调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解有机污染物p-CP。若p-CP的初始浓度相同,在不同温度、pH条件下,p-CP的浓度随时间变化的曲线如下图所示,下列说法错误的是( B )
A.298K、pH=3条件下,在50~150s内平均反应速率v(p-CP)=8.0×10-6 mol·L-1·s-1
B.温度为298K条件下,碱性环境有利于增大降解反应速率
C.由实验①②可知,升高温度可以增大降解反应速率
D.升高温度,有利于增大降解反应速率,但温度过高时部分H2O2分解,使反应速率减小
【解析】 由曲线①可得,降解反应在50~150s内的平均反应速率v(p-CP)==8.0×10-6mol·L-1·s-1,A项正确。据图示,298K下,有机物p-CP的降解速率在pH=3时比pH=10时快,B项错误。由实验①②可知,pH相同,升高温度可以增大降解反应速率,C项正确。升高温度,有利于增大降解反应速率,但温度过高导致部分过氧化氢分解,所以反应速率又会变小,D项正确。
12.某学习小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
实验编号 H2C2O4溶液 酸性KMnO4溶液 温度/℃
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
① 0.10 2.0 0.01 3.0 25
② 0.20 2.0 0.01 3.0 25
③ 0.20 2.0 0.01 3.0 50
(1) 实验时发生的反应为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。为了顺利观察KMnO4溶液颜色的变化,起始时H2C2O4与KMnO4的物质的量关系需要满足n(H2C2O4)∶n(KMnO4)≥__5∶2__。
(2) 探究反应物浓度对化学反应速率影响的实验编号是__①②__,探究温度对化学反应速率影响的实验编号是__②③__。
(3) 测得实验①中KMnO4溶液的褪色时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__2×10-4mol·L-1·s-1__。
(4) 实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是:a.该反应是放热反应,溶液温度逐渐升高,反应速率增大;b.__该反应生成的Mn2+作催化剂__。
【解析】 (1) 根据化学方程式的化学计量数可知两者的物质的量之比应不小于5∶2。 (3) 实验①中KMnO4的起始浓度c(KMnO4)==0.006mol·L-1, 30s内,v(KMnO4)===2×10-4mol·L-1·s-1。 (4) 反应一段时间后,速率增大,可能与温度有关,也可能与生成的某物质起了催化作用有关。
1.水—碳催化制氢的反应为C+H2OH2+CO,可提高碳的资源化利用。下列关于该反应的说法正确的是( )
A.增大压强能减小化学反应速率
B.合适的催化剂能增大化学反应速率
C.增大水蒸气的浓度能减小化学反应速率
D.增加碳的用量能减小化学反应速率
2.下列各组反应(表中金属粉末均为 0.1mol)在反应刚开始时,放出 H2的速率最大的是( )
选项 金属(粉末状) 酸的浓度及体积 反应温度/℃
A Mg 6mol·L-1硝酸 10mL 30
B Mg 3mol·L-1盐酸 10mL 60
C Fe 3mol·L-1盐酸 10mL 60
D Mg 3mol·L-1硫酸 10mL 60
3.NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成N2和CO2。下列关于该反应的叙述正确的是( )
A.使用适当的催化剂不能改变反应速率
B.减小压强能增大反应速率
C.升高温度能增大反应速率
D.改变压强对反应速率无影响
4.实验室用锌粒与2mol·L-1硫酸反应制取H2。下列措施不能增大反应速率的是( )
A.用锌粉代替锌粒 B.改用3mol·L-1硫酸
C.改用热的2mol·L-1硫酸 D.向该硫酸中加入等体积的水
5.某密闭容器中发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。不改变其他条件,下列措施不能增大反应速率的是( )
A.升高温度 B.减小容器体积
C.保持容积不变,通入He D.选用合适的催化剂
6.若其他条件相同,在无催化剂和有催化剂(Ⅰ、Ⅱ)时反应X(g)―→2Y(g)的c-t变化曲线如下图所示。下列判断正确的是( )
A.有催化剂时反应才能发生
B.催化剂Ⅱ比催化剂Ⅰ更高效
C.a表示使用催化剂Ⅱ时c(X)随t的变化曲线
D.使用催化剂Ⅰ, 0~2min内:v(X)=1.0mol·L-1·min-1
7.下列措施中,不能增大化学反应速率的是( )
A.二氧化硫与氧气合成SO3时,适当增大压强
B.铁与硫酸铜溶液反应置换出Cu时,加入蒸馏水
C.双氧水分解制O2时,加入几滴FeCl3溶液
D.碳酸钙与稀盐酸反应制CO2时,适当升高温度
8.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
A.
B.
C.
D.
9.某小组同学用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸反应,设计了以下4个实验,探究反应条件对化学反应速率的影响。下列说法错误的是( )
实验序号 Ⅰ Ⅱ Ⅲ Ⅳ
盐酸的浓度/(mol·L-1) 0.5 3 0.5 y
实验温度/℃ 25 x 40 40
是否使用催化剂 否 否 是 否
A.若实验Ⅰ、Ⅱ研究浓度对反应速率的影响,则x的值为25
B.若实验Ⅱ、Ⅳ研究温度对反应速率的影响,则y的值为3
C.实验Ⅰ、Ⅲ可研究温度对反应速率的影响
D.可通过实验Ⅲ、Ⅳ研究催化剂对反应速率的影响
10.为了研究CaCO3与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,并绘制曲线。在O~t1、t1~t2、t2~t3、t3~t4各相同的时间段里,收集到的气体最多的时间段为 ,反应速率最大的时间段为 ,反应速率最小的时间段为 。
11.向调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解有机污染物p-CP。若p-CP的初始浓度相同,在不同温度、pH条件下,p-CP的浓度随时间变化的曲线如下图所示,下列说法错误的是( )
A.298K、pH=3条件下,在50~150s内平均反应速率v(p-CP)=8.0×10-6 mol·L-1·s-1
B.温度为298K条件下,碱性环境有利于增大降解反应速率
C.由实验①②可知,升高温度可以增大降解反应速率
D.升高温度,有利于增大降解反应速率,但温度过高时部分H2O2分解,使反应速率减小
12.某学习小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
实验编号 H2C2O4溶液 酸性KMnO4溶液 温度/℃
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
① 0.10 2.0 0.01 3.0 25
② 0.20 2.0 0.01 3.0 25
③ 0.20 2.0 0.01 3.0 50
(1) 实验时发生的反应为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。为了顺利观察KMnO4溶液颜色的变化,起始时H2C2O4与KMnO4的物质的量关系需要满足n(H2C2O4)∶n(KMnO4)≥ 。
(2) 探究反应物浓度对化学反应速率影响的实验编号是 ,探究温度对化学反应速率影响的实验编号是 。
(3) 测得实验①中KMnO4溶液的褪色时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= 。
(4) 实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是:a.该反应是放热反应,溶液温度逐渐升高,反应速率增大;b. 。
第2课时 影响化学反应速率的因素 课后练习
1.水—碳催化制氢的反应为C+H2OH2+CO,可提高碳的资源化利用。下列关于该反应的说法正确的是( B )
A.增大压强能减小化学反应速率
B.合适的催化剂能增大化学反应速率
C.增大水蒸气的浓度能减小化学反应速率
D.增加碳的用量能减小化学反应速率
2.下列各组反应(表中金属粉末均为 0.1mol)在反应刚开始时,放出 H2的速率最大的是( D )
选项 金属(粉末状) 酸的浓度及体积 反应温度/℃
A Mg 6mol·L-1硝酸 10mL 30
B Mg 3mol·L-1盐酸 10mL 60
C Fe 3mol·L-1盐酸 10mL 60
D Mg 3mol·L-1硫酸 10mL 60
3.NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成N2和CO2。下列关于该反应的叙述正确的是( C )
A.使用适当的催化剂不能改变反应速率
B.减小压强能增大反应速率
C.升高温度能增大反应速率
D.改变压强对反应速率无影响
【解析】 有气体参加的反应,减小压强,化学反应速率减小。
4.实验室用锌粒与2mol·L-1硫酸反应制取H2。下列措施不能增大反应速率的是( D )
A.用锌粉代替锌粒 B.改用3mol·L-1硫酸
C.改用热的2mol·L-1硫酸 D.向该硫酸中加入等体积的水
5.某密闭容器中发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。不改变其他条件,下列措施不能增大反应速率的是( C )
A.升高温度 B.减小容器体积
C.保持容积不变,通入He D.选用合适的催化剂
6.若其他条件相同,在无催化剂和有催化剂(Ⅰ、Ⅱ)时反应X(g)―→2Y(g)的c-t变化曲线如下图所示。下列判断正确的是( D )
A.有催化剂时反应才能发生
B.催化剂Ⅱ比催化剂Ⅰ更高效
C.a表示使用催化剂Ⅱ时c(X)随t的变化曲线
D.使用催化剂Ⅰ, 0~2min内:v(X)=1.0mol·L-1·min-1
【解析】 由图知无催化剂反应也能发生,A项错误。单位时间内,使用催化剂Ⅰ的浓度变化量更大,因此催化剂Ⅰ比催化剂Ⅱ更高效,B项错误。a曲线表示的是反应物浓度随时间的变化曲线,即表示X的浓度变化的曲线,2min内,X的浓度减少2.0mol·L-1,由X(g)2Y(g)可知,生成物Y的浓度应增加4.0mol·L-1,其对应的应是使用催化剂Ⅰ的曲线,C项错误。使用催化剂Ⅰ, 0~2min内:v(Y)==2.0mol·L-1·min-1, v(X)=v(Y)=1.0mol·L-1·min-1, D项正确。
7.下列措施中,不能增大化学反应速率的是( B )
A.二氧化硫与氧气合成SO3时,适当增大压强
B.铁与硫酸铜溶液反应置换出Cu时,加入蒸馏水
C.双氧水分解制O2时,加入几滴FeCl3溶液
D.碳酸钙与稀盐酸反应制CO2时,适当升高温度
8.为了探究温度对化学反应速率的影响,下列实验方案可行的是( D )
A.
B.
C.
D.
【解析】 A项中缺少对比实验,错误。B、C项出现两个变量,无法比较,错误。D项中只有温度不同,其他条件都相同,只有一个变量,该方案可行。
9.某小组同学用相同质量的大理石(主要成分为CaCO3)与相同体积的盐酸反应,设计了以下4个实验,探究反应条件对化学反应速率的影响。下列说法错误的是( C )
实验序号 Ⅰ Ⅱ Ⅲ Ⅳ
盐酸的浓度/(mol·L-1) 0.5 3 0.5 y
实验温度/℃ 25 x 40 40
是否使用催化剂 否 否 是 否
A.若实验Ⅰ、Ⅱ研究浓度对反应速率的影响,则x的值为25
B.若实验Ⅱ、Ⅳ研究温度对反应速率的影响,则y的值为3
C.实验Ⅰ、Ⅲ可研究温度对反应速率的影响
D.可通过实验Ⅲ、Ⅳ研究催化剂对反应速率的影响
10.为了研究CaCO3与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,并绘制曲线。在O~t1、t1~t2、t2~t3、t3~t4各相同的时间段里,收集到的气体最多的时间段为__t1~t2__,反应速率最大的时间段为__t1~t2__,反应速率最小的时间段为__t3~t4__。
11.向调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解有机污染物p-CP。若p-CP的初始浓度相同,在不同温度、pH条件下,p-CP的浓度随时间变化的曲线如下图所示,下列说法错误的是( B )
A.298K、pH=3条件下,在50~150s内平均反应速率v(p-CP)=8.0×10-6 mol·L-1·s-1
B.温度为298K条件下,碱性环境有利于增大降解反应速率
C.由实验①②可知,升高温度可以增大降解反应速率
D.升高温度,有利于增大降解反应速率,但温度过高时部分H2O2分解,使反应速率减小
【解析】 由曲线①可得,降解反应在50~150s内的平均反应速率v(p-CP)==8.0×10-6mol·L-1·s-1,A项正确。据图示,298K下,有机物p-CP的降解速率在pH=3时比pH=10时快,B项错误。由实验①②可知,pH相同,升高温度可以增大降解反应速率,C项正确。升高温度,有利于增大降解反应速率,但温度过高导致部分过氧化氢分解,所以反应速率又会变小,D项正确。
12.某学习小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
实验编号 H2C2O4溶液 酸性KMnO4溶液 温度/℃
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
① 0.10 2.0 0.01 3.0 25
② 0.20 2.0 0.01 3.0 25
③ 0.20 2.0 0.01 3.0 50
(1) 实验时发生的反应为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。为了顺利观察KMnO4溶液颜色的变化,起始时H2C2O4与KMnO4的物质的量关系需要满足n(H2C2O4)∶n(KMnO4)≥__5∶2__。
(2) 探究反应物浓度对化学反应速率影响的实验编号是__①②__,探究温度对化学反应速率影响的实验编号是__②③__。
(3) 测得实验①中KMnO4溶液的褪色时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__2×10-4mol·L-1·s-1__。
(4) 实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是:a.该反应是放热反应,溶液温度逐渐升高,反应速率增大;b.__该反应生成的Mn2+作催化剂__。
【解析】 (1) 根据化学方程式的化学计量数可知两者的物质的量之比应不小于5∶2。 (3) 实验①中KMnO4的起始浓度c(KMnO4)==0.006mol·L-1, 30s内,v(KMnO4)===2×10-4mol·L-1·s-1。 (4) 反应一段时间后,速率增大,可能与温度有关,也可能与生成的某物质起了催化作用有关。
