专题6 第2单元 第1课时 放热反应与吸热反应 课后练习(含答案)
文档属性
| 名称 | 专题6 第2单元 第1课时 放热反应与吸热反应 课后练习(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 456.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 23:07:14 | ||
图片预览

文档简介
第1课时 放热反应与吸热反应
1.下列关于化学反应中能量变化的说法,正确的是( )
A.断开化学键会释放能量
B.化学反应过程中一定伴有能量变化
C.常温下进行的一定是放热反应
D.下图表示的反应为吸热反应
2.甲醇蒸气重整—变压吸附技术可获得高浓度CO2、H2混合气,化学反应原理是CH3OH+H2O―→CO2+3H2,其能量变化如下图所示。下列说法正确的是( )
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.反应物的总能量大于生成物的总能量
C.形成H—H键吸收能量
D.断开H—C键放出能量
3.已知金刚石在一定条件下转化为石墨是放热的。下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在任何条件下都不能发生
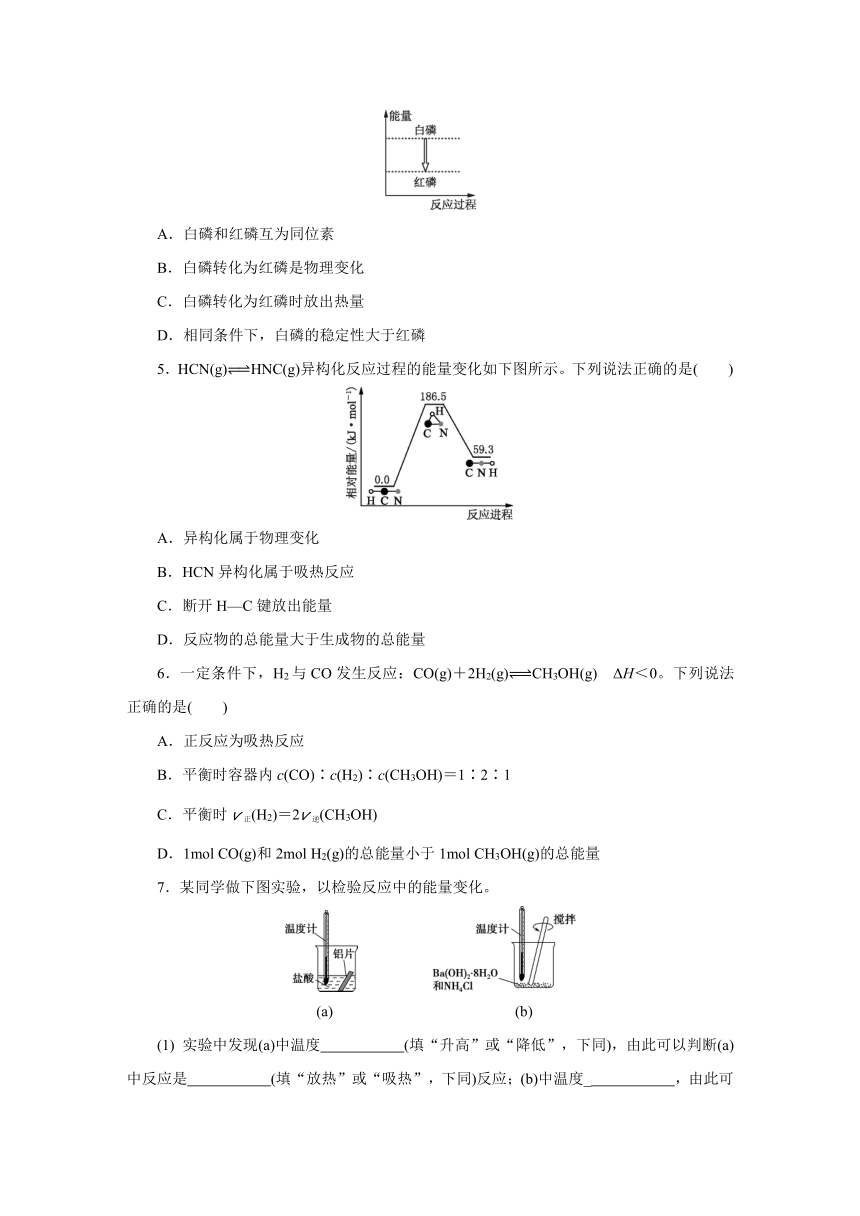
4.(2021扬州高一期末)白磷和红磷的能量转化关系如下图所示,下列说法正确的是( )
A.白磷和红磷互为同位素
B.白磷转化为红磷是物理变化
C.白磷转化为红磷时放出热量
D.相同条件下,白磷的稳定性大于红磷
5.HCN(g) HNC(g)异构化反应过程的能量变化如下图所示。下列说法正确的是( )
A.异构化属于物理变化
B.HCN异构化属于吸热反应
C.断开H—C键放出能量
D.反应物的总能量大于生成物的总能量
6.一定条件下,H2与CO发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。下列说法正确的是( )
A.正反应为吸热反应
B.平衡时容器内c(CO)∶c(H2)∶c(CH3OH)=1∶2∶1
C.平衡时v正(H2)=2v逆(CH3OH)
D.1mol CO(g)和2mol H2(g)的总能量小于1mol CH3OH(g)的总能量
7.某同学做下图实验,以检验反应中的能量变化。
(a) (b)
(1) 实验中发现(a)中温度 (填“升高”或“降低”,下同),由此可以判断(a)中反应是 (填“放热”或“吸热”,下同)反应;(b)中温度_ ,由此可以判断(b)中反应是 反应。
(2) 写出铝与盐酸反应的离子方程式: 。
(3) 根据能量守恒定律,(b)中反应物的总能量应该 (填“大于”“小于”或“等于”)生成物的总能量。
8.下列过程中发生化学反应且可说明是放热反应的是( )
A B C D
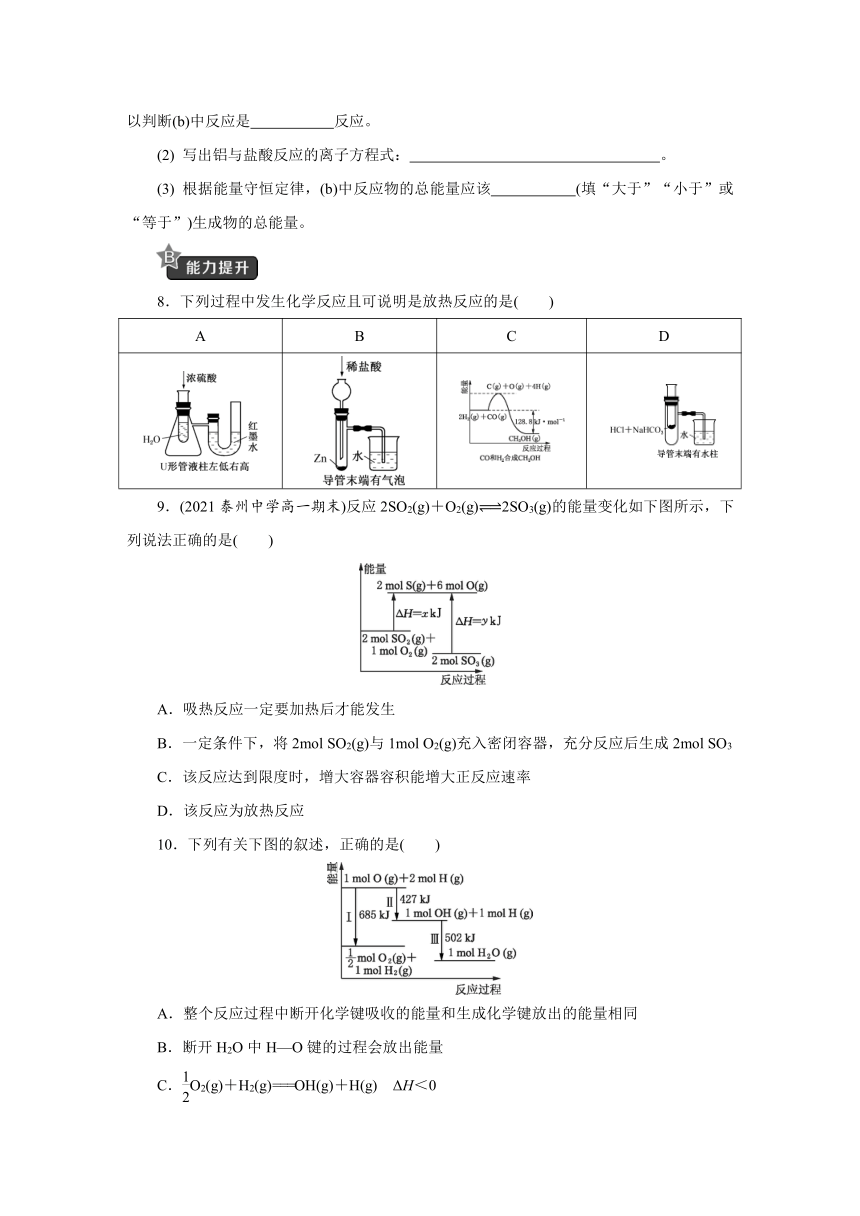
9.(2021泰州中学高一期末)反应2SO2(g)+O2(g) 2SO3(g)的能量变化如下图所示,下列说法正确的是( )
A.吸热反应一定要加热后才能发生
B.一定条件下,将2mol SO2(g)与1mol O2(g)充入密闭容器,充分反应后生成2mol SO3
C.该反应达到限度时,增大容器容积能增大正反应速率
D.该反应为放热反应
10.下列有关下图的叙述,正确的是( )
A.整个反应过程中断开化学键吸收的能量和生成化学键放出的能量相同
B.断开H2O中H—O键的过程会放出能量
C.O2(g)+H2(g)===OH(g)+H(g) ΔH<0
D.H2O(g)===O2(g)+H2(g) ΔH>0
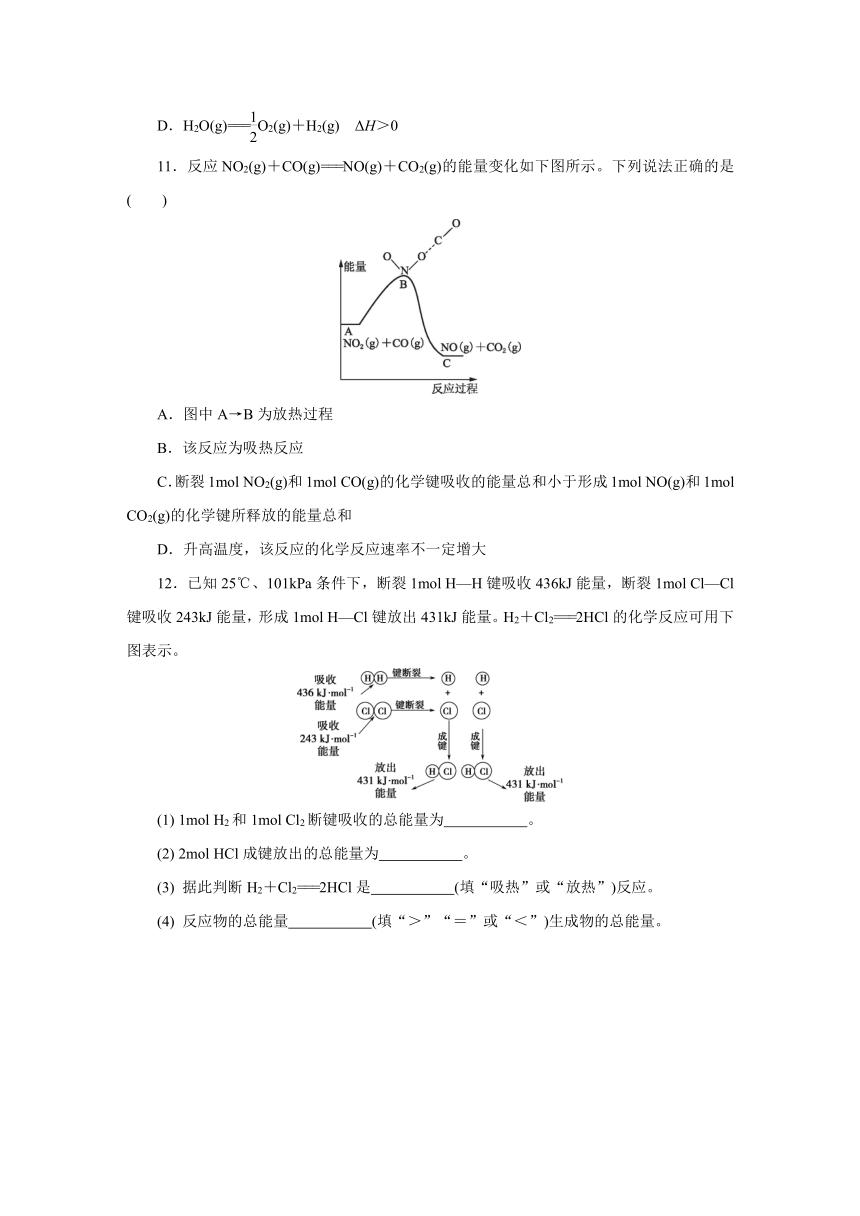
11.反应NO2(g)+CO(g)===NO(g)+CO2(g)的能量变化如下图所示。下列说法正确的是( )
A.图中A→B为放热过程
B.该反应为吸热反应
C.断裂1mol NO2(g)和1mol CO(g)的化学键吸收的能量总和小于形成1mol NO(g)和1mol CO2(g)的化学键所释放的能量总和
D.升高温度,该反应的化学反应速率不一定增大
12.已知25℃、101kPa条件下,断裂1mol H—H键吸收436kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1mol H—Cl键放出431kJ能量。H2+Cl2===2HCl的化学反应可用下图表示。
(1) 1mol H2和1mol Cl2断键吸收的总能量为 。
(2) 2mol HCl成键放出的总能量为 。
(3) 据此判断H2+Cl2===2HCl是 (填“吸热”或“放热”)反应。
(4) 反应物的总能量 (填“>”“=”或“<”)生成物的总能量。
第1课时 放热反应与吸热反应
1.下列关于化学反应中能量变化的说法,正确的是( B )
A.断开化学键会释放能量
B.化学反应过程中一定伴有能量变化
C.常温下进行的一定是放热反应
D.下图表示的反应为吸热反应
2.甲醇蒸气重整—变压吸附技术可获得高浓度CO2、H2混合气,化学反应原理是CH3OH+H2O―→CO2+3H2,其能量变化如下图所示。下列说法正确的是( B )
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.反应物的总能量大于生成物的总能量
C.形成H—H键吸收能量
D.断开H—C键放出能量
3.已知金刚石在一定条件下转化为石墨是放热的。下列说法正确的是( C )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在任何条件下都不能发生
4.(2021扬州高一期末)白磷和红磷的能量转化关系如下图所示,下列说法正确的是( C )
A.白磷和红磷互为同位素
B.白磷转化为红磷是物理变化
C.白磷转化为红磷时放出热量
D.相同条件下,白磷的稳定性大于红磷
5.HCN(g) HNC(g)异构化反应过程的能量变化如下图所示。下列说法正确的是( B )
A.异构化属于物理变化
B.HCN异构化属于吸热反应
C.断开H—C键放出能量
D.反应物的总能量大于生成物的总能量
6.一定条件下,H2与CO发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。下列说法正确的是( C )
A.正反应为吸热反应
B.平衡时容器内c(CO)∶c(H2)∶c(CH3OH)=1∶2∶1
C.平衡时v正(H2)=2v逆(CH3OH)
D.1mol CO(g)和2mol H2(g)的总能量小于1mol CH3OH(g)的总能量
7.某同学做下图实验,以检验反应中的能量变化。
(a) (b)
(1) 实验中发现(a)中温度__升高__(填“升高”或“降低”,下同),由此可以判断(a)中反应是__放热__(填“放热”或“吸热”,下同)反应;(b)中温度__降低__,由此可以判断(b)中反应是__吸热__反应。
(2) 写出铝与盐酸反应的离子方程式:__2Al+6H+===2Al3++3H2↑__。
(3) 根据能量守恒定律,(b)中反应物的总能量应该__小于__(填“大于”“小于”或“等于”)生成物的总能量。
8.下列过程中发生化学反应且可说明是放热反应的是( C )
A B C D
【解析】 浓硫酸稀释过程放出热量,是物理变化,不是放热反应,A项错误。Zn和稀盐酸反应生成氯化锌和氢气,因此有气泡产生,不能说明该反应是放热反应,B项错误。由图知反应物的总能量大于生成物的总能量,该反应是放热反应,C项正确。碳酸氢钠和盐酸的反应是吸热反应,可观察到烧杯中的水倒吸进入导管,D项错误。
9.(2021泰州中学高一期末)反应2SO2(g)+O2(g) 2SO3(g)的能量变化如下图所示,下列说法正确的是( D )
A.吸热反应一定要加热后才能发生
B.一定条件下,将2mol SO2(g)与1mol O2(g)充入密闭容器,充分反应后生成2mol SO3
C.该反应达到限度时,增大容器容积能增大正反应速率
D.该反应为放热反应
【解析】 有些吸热反应在常温下也能发生,不一定需要加热,如NH4Cl与Ba(OH)2晶体的反应,A项错误。此反应是可逆反应,不能进行到底,B项错误。该反应达到限度时,增大容器容积,相当于减小各物质的浓度,所以正反应速率减小,C项错误。根据图示,反应物的总能量大于生成物的总能量,为放热反应,D项正确。
10.下列有关下图的叙述,正确的是( D )
A.整个反应过程中断开化学键吸收的能量和生成化学键放出的能量相同
B.断开H2O中H—O键的过程会放出能量
C.O2(g)+H2(g)===OH(g)+H(g) ΔH<0
D.H2O(g)===O2(g)+H2(g) ΔH>0
【解析】 从图可看出O2(g)+H2(g)===H2O(g)是放热反应,所以整个反应过程中断开化学键吸收的能量小于生成化学键放出的能量,A项错误。从图可知,断开H2O中H—O键的过程会吸收能量,B项错误。O2(g)+H2(g)===OH(g)+H(g)中,生成物的总能量大于反应物的总能量,所以ΔH>0, C项错误。H2O(g)===O2(g)+H2(g)中生成物的总能量大于反应物的总能量,所以ΔH>0, D项正确。
11.反应NO2(g)+CO(g)===NO(g)+CO2(g)的能量变化如下图所示。下列说法正确的是( C )
A.图中A→B为放热过程
B.该反应为吸热反应
C.断裂1mol NO2(g)和1mol CO(g)的化学键吸收的能量总和小于形成1mol NO(g)和1mol CO2(g)的化学键所释放的能量总和
D.升高温度,该反应的化学反应速率不一定增大
【解析】 图中A→B的过程,能量升高,为吸热过程,A项错误。生成物总能量小于反应物总能量,该反应为放热反应,B项错误。该反应为放热反应,则断裂1molNO2(g)和1molCO(g)的化学键吸收的能量总和小于形成1molNO(g)和1molCO2(g)的化学键所释放的能量总和,C项正确。升高温度,该反应的化学反应速率一定增大,D项错误。
12.已知25℃、101kPa条件下,断裂1mol H—H键吸收436kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1mol H—Cl键放出431kJ能量。H2+Cl2===2HCl的化学反应可用下图表示。
(1) 1mol H2和1mol Cl2断键吸收的总能量为__679kJ__。
(2) 2mol HCl成键放出的总能量为__862kJ__。
(3) 据此判断H2+Cl2===2HCl是__放热__(填“吸热”或“放热”)反应。
(4) 反应物的总能量__>__(填“>”“=”或“<”)生成物的总能量。
【解析】 (3) 该反应中断开旧化学键吸收的能量(679kJ)小于形成新化学键放出的能量(862kJ),所以该反应是放热反应。 (4) 由于该反应是放热反应,所以反应物的总能量大于生成物的总能量。
1.下列关于化学反应中能量变化的说法,正确的是( )
A.断开化学键会释放能量
B.化学反应过程中一定伴有能量变化
C.常温下进行的一定是放热反应
D.下图表示的反应为吸热反应
2.甲醇蒸气重整—变压吸附技术可获得高浓度CO2、H2混合气,化学反应原理是CH3OH+H2O―→CO2+3H2,其能量变化如下图所示。下列说法正确的是( )
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.反应物的总能量大于生成物的总能量
C.形成H—H键吸收能量
D.断开H—C键放出能量
3.已知金刚石在一定条件下转化为石墨是放热的。下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在任何条件下都不能发生
4.(2021扬州高一期末)白磷和红磷的能量转化关系如下图所示,下列说法正确的是( )
A.白磷和红磷互为同位素
B.白磷转化为红磷是物理变化
C.白磷转化为红磷时放出热量
D.相同条件下,白磷的稳定性大于红磷
5.HCN(g) HNC(g)异构化反应过程的能量变化如下图所示。下列说法正确的是( )
A.异构化属于物理变化
B.HCN异构化属于吸热反应
C.断开H—C键放出能量
D.反应物的总能量大于生成物的总能量
6.一定条件下,H2与CO发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。下列说法正确的是( )
A.正反应为吸热反应
B.平衡时容器内c(CO)∶c(H2)∶c(CH3OH)=1∶2∶1
C.平衡时v正(H2)=2v逆(CH3OH)
D.1mol CO(g)和2mol H2(g)的总能量小于1mol CH3OH(g)的总能量
7.某同学做下图实验,以检验反应中的能量变化。
(a) (b)
(1) 实验中发现(a)中温度 (填“升高”或“降低”,下同),由此可以判断(a)中反应是 (填“放热”或“吸热”,下同)反应;(b)中温度_ ,由此可以判断(b)中反应是 反应。
(2) 写出铝与盐酸反应的离子方程式: 。
(3) 根据能量守恒定律,(b)中反应物的总能量应该 (填“大于”“小于”或“等于”)生成物的总能量。
8.下列过程中发生化学反应且可说明是放热反应的是( )
A B C D
9.(2021泰州中学高一期末)反应2SO2(g)+O2(g) 2SO3(g)的能量变化如下图所示,下列说法正确的是( )
A.吸热反应一定要加热后才能发生
B.一定条件下,将2mol SO2(g)与1mol O2(g)充入密闭容器,充分反应后生成2mol SO3
C.该反应达到限度时,增大容器容积能增大正反应速率
D.该反应为放热反应
10.下列有关下图的叙述,正确的是( )
A.整个反应过程中断开化学键吸收的能量和生成化学键放出的能量相同
B.断开H2O中H—O键的过程会放出能量
C.O2(g)+H2(g)===OH(g)+H(g) ΔH<0
D.H2O(g)===O2(g)+H2(g) ΔH>0
11.反应NO2(g)+CO(g)===NO(g)+CO2(g)的能量变化如下图所示。下列说法正确的是( )
A.图中A→B为放热过程
B.该反应为吸热反应
C.断裂1mol NO2(g)和1mol CO(g)的化学键吸收的能量总和小于形成1mol NO(g)和1mol CO2(g)的化学键所释放的能量总和
D.升高温度,该反应的化学反应速率不一定增大
12.已知25℃、101kPa条件下,断裂1mol H—H键吸收436kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1mol H—Cl键放出431kJ能量。H2+Cl2===2HCl的化学反应可用下图表示。
(1) 1mol H2和1mol Cl2断键吸收的总能量为 。
(2) 2mol HCl成键放出的总能量为 。
(3) 据此判断H2+Cl2===2HCl是 (填“吸热”或“放热”)反应。
(4) 反应物的总能量 (填“>”“=”或“<”)生成物的总能量。
第1课时 放热反应与吸热反应
1.下列关于化学反应中能量变化的说法,正确的是( B )
A.断开化学键会释放能量
B.化学反应过程中一定伴有能量变化
C.常温下进行的一定是放热反应
D.下图表示的反应为吸热反应
2.甲醇蒸气重整—变压吸附技术可获得高浓度CO2、H2混合气,化学反应原理是CH3OH+H2O―→CO2+3H2,其能量变化如下图所示。下列说法正确的是( B )
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.反应物的总能量大于生成物的总能量
C.形成H—H键吸收能量
D.断开H—C键放出能量
3.已知金刚石在一定条件下转化为石墨是放热的。下列说法正确的是( C )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在任何条件下都不能发生
4.(2021扬州高一期末)白磷和红磷的能量转化关系如下图所示,下列说法正确的是( C )
A.白磷和红磷互为同位素
B.白磷转化为红磷是物理变化
C.白磷转化为红磷时放出热量
D.相同条件下,白磷的稳定性大于红磷
5.HCN(g) HNC(g)异构化反应过程的能量变化如下图所示。下列说法正确的是( B )
A.异构化属于物理变化
B.HCN异构化属于吸热反应
C.断开H—C键放出能量
D.反应物的总能量大于生成物的总能量
6.一定条件下,H2与CO发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。下列说法正确的是( C )
A.正反应为吸热反应
B.平衡时容器内c(CO)∶c(H2)∶c(CH3OH)=1∶2∶1
C.平衡时v正(H2)=2v逆(CH3OH)
D.1mol CO(g)和2mol H2(g)的总能量小于1mol CH3OH(g)的总能量
7.某同学做下图实验,以检验反应中的能量变化。
(a) (b)
(1) 实验中发现(a)中温度__升高__(填“升高”或“降低”,下同),由此可以判断(a)中反应是__放热__(填“放热”或“吸热”,下同)反应;(b)中温度__降低__,由此可以判断(b)中反应是__吸热__反应。
(2) 写出铝与盐酸反应的离子方程式:__2Al+6H+===2Al3++3H2↑__。
(3) 根据能量守恒定律,(b)中反应物的总能量应该__小于__(填“大于”“小于”或“等于”)生成物的总能量。
8.下列过程中发生化学反应且可说明是放热反应的是( C )
A B C D
【解析】 浓硫酸稀释过程放出热量,是物理变化,不是放热反应,A项错误。Zn和稀盐酸反应生成氯化锌和氢气,因此有气泡产生,不能说明该反应是放热反应,B项错误。由图知反应物的总能量大于生成物的总能量,该反应是放热反应,C项正确。碳酸氢钠和盐酸的反应是吸热反应,可观察到烧杯中的水倒吸进入导管,D项错误。
9.(2021泰州中学高一期末)反应2SO2(g)+O2(g) 2SO3(g)的能量变化如下图所示,下列说法正确的是( D )
A.吸热反应一定要加热后才能发生
B.一定条件下,将2mol SO2(g)与1mol O2(g)充入密闭容器,充分反应后生成2mol SO3
C.该反应达到限度时,增大容器容积能增大正反应速率
D.该反应为放热反应
【解析】 有些吸热反应在常温下也能发生,不一定需要加热,如NH4Cl与Ba(OH)2晶体的反应,A项错误。此反应是可逆反应,不能进行到底,B项错误。该反应达到限度时,增大容器容积,相当于减小各物质的浓度,所以正反应速率减小,C项错误。根据图示,反应物的总能量大于生成物的总能量,为放热反应,D项正确。
10.下列有关下图的叙述,正确的是( D )
A.整个反应过程中断开化学键吸收的能量和生成化学键放出的能量相同
B.断开H2O中H—O键的过程会放出能量
C.O2(g)+H2(g)===OH(g)+H(g) ΔH<0
D.H2O(g)===O2(g)+H2(g) ΔH>0
【解析】 从图可看出O2(g)+H2(g)===H2O(g)是放热反应,所以整个反应过程中断开化学键吸收的能量小于生成化学键放出的能量,A项错误。从图可知,断开H2O中H—O键的过程会吸收能量,B项错误。O2(g)+H2(g)===OH(g)+H(g)中,生成物的总能量大于反应物的总能量,所以ΔH>0, C项错误。H2O(g)===O2(g)+H2(g)中生成物的总能量大于反应物的总能量,所以ΔH>0, D项正确。
11.反应NO2(g)+CO(g)===NO(g)+CO2(g)的能量变化如下图所示。下列说法正确的是( C )
A.图中A→B为放热过程
B.该反应为吸热反应
C.断裂1mol NO2(g)和1mol CO(g)的化学键吸收的能量总和小于形成1mol NO(g)和1mol CO2(g)的化学键所释放的能量总和
D.升高温度,该反应的化学反应速率不一定增大
【解析】 图中A→B的过程,能量升高,为吸热过程,A项错误。生成物总能量小于反应物总能量,该反应为放热反应,B项错误。该反应为放热反应,则断裂1molNO2(g)和1molCO(g)的化学键吸收的能量总和小于形成1molNO(g)和1molCO2(g)的化学键所释放的能量总和,C项正确。升高温度,该反应的化学反应速率一定增大,D项错误。
12.已知25℃、101kPa条件下,断裂1mol H—H键吸收436kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1mol H—Cl键放出431kJ能量。H2+Cl2===2HCl的化学反应可用下图表示。
(1) 1mol H2和1mol Cl2断键吸收的总能量为__679kJ__。
(2) 2mol HCl成键放出的总能量为__862kJ__。
(3) 据此判断H2+Cl2===2HCl是__放热__(填“吸热”或“放热”)反应。
(4) 反应物的总能量__>__(填“>”“=”或“<”)生成物的总能量。
【解析】 (3) 该反应中断开旧化学键吸收的能量(679kJ)小于形成新化学键放出的能量(862kJ),所以该反应是放热反应。 (4) 由于该反应是放热反应,所以反应物的总能量大于生成物的总能量。
