专题6 第3单元 第1课时 化学能转化为电能 课后练习(含答案)
文档属性
| 名称 | 专题6 第3单元 第1课时 化学能转化为电能 课后练习(含答案) |
|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-02 23:10:54 | ||
图片预览



文档简介
第1课时 化学能转化为电能
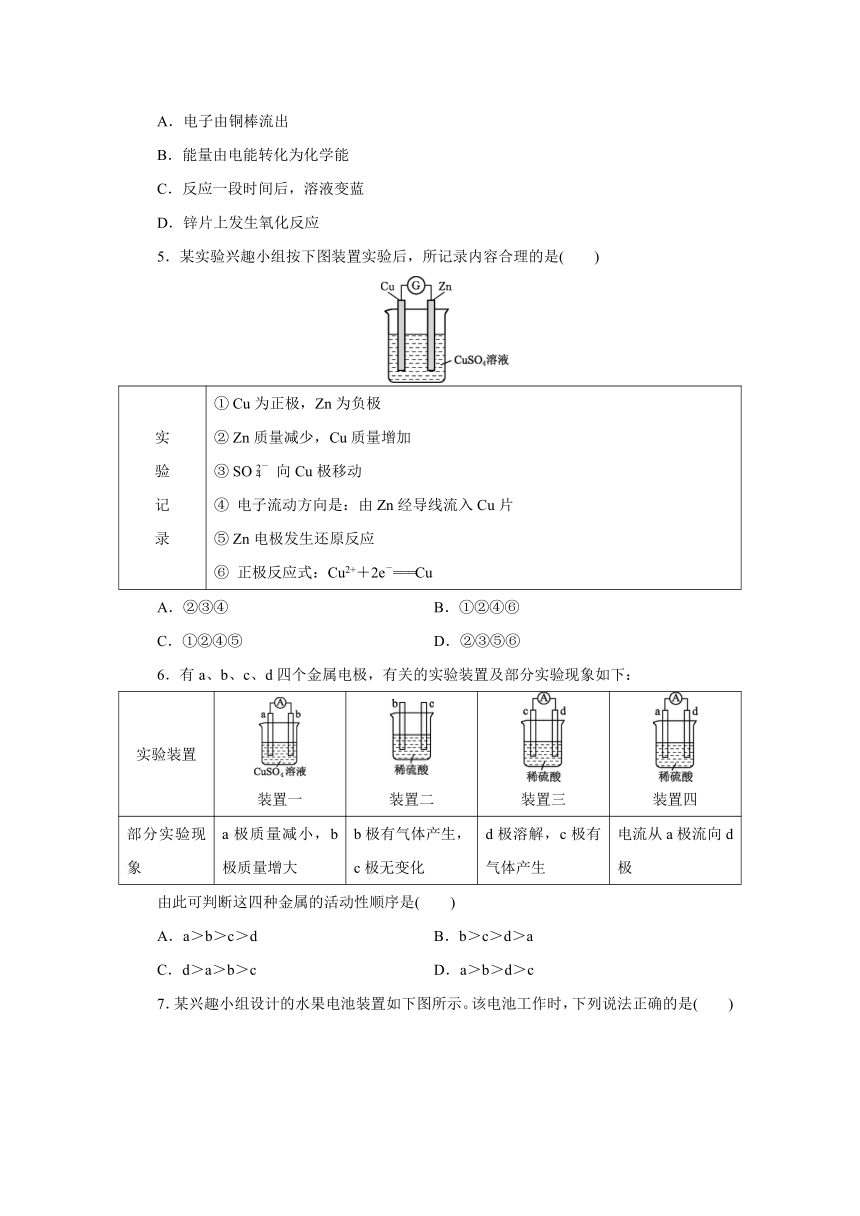
1.下列过程中涉及化学能转化为电能的是( )
A B C D
使用燃料电池驱动新能源汽车 晶体硅太阳能电池提供“绿电” 利用风能进行发电 植物利用太阳能进行光合作用
2.下列装置能形成原电池的是( )
① ② ③ ④ ⑤ ⑥ ⑦
A.①②③⑦ B.①②⑤⑥
C.①②③④ D.①②③⑥⑦
3.下列关于下图装置的叙述,错误的是( )
A.石墨电极的反应为O2+4H++4e-===2H2O
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入盐酸,石墨电极反应式为2H++2e-===H2↑
4.(2021扬州高一期末)下图为某原电池的示意图,下列有关说法正确的是( )
A.电子由铜棒流出
B.能量由电能转化为化学能
C.反应一段时间后,溶液变蓝
D.锌片上发生氧化反应
5.某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
实验记录 ① Cu为正极,Zn为负极② Zn质量减少,Cu质量增加③ SO向Cu极移动④ 电子流动方向是:由Zn经导线流入Cu片⑤ Zn电极发生还原反应⑥ 正极反应式:Cu2++2e-===Cu
A.②③④ B.①②④⑥
C.①②④⑤ D.②③⑤⑥
6.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 装置一 装置二 装置三 装置四
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
7.某兴趣小组设计的水果电池装置如下图所示。该电池工作时,下列说法正确的是( )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
8.下图为钢铁生锈的原理示意图,下列有关说法错误的是( )
A.转化过程中由化学能转化为电能
B.铁锈的主要成分是Fe2O3·xH2O
C.正极的电极反应式为Fe-2e-===Fe2+
D.发生电化学反应的总反应式为2Fe+O2+2H2O===2Fe(OH)2
9.如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡,小心地往烧杯中央滴入CuSO4溶液。
(1) 片刻后可观察到的现象是(指悬吊的金属圈) (填字母)。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2) 产生上述现象的原因是 。
10.现有如下两个反应:①NaOH+HCl===NaCl+H2O, ②Cu+2Ag+===2Ag+Cu2+。其中能设计成原电池的是 _(填序号),并填空。
负极材料: ,电极反应式: ,反应类型: 。
正极材料: ,电极反应式: ,反应类型: 。
11.某兴趣小组模拟纸电池进行实验(如右下图),下列有关说法正确的是( )
A.Zn为正极
B.工作时,Cu电极发生氧化反应
C.工作时,电子经外电路由Cu电极流向Zn电极
D.工作一段时间后,Cu电极的质量增加
12.运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O===2H2SO4,装置如下图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
(1) 该电池的负极是 (填“电极a”或“电极b”)。
(2) 通入O2的电极反应式是 。
第1课时 化学能转化为电能
1.下列过程中涉及化学能转化为电能的是( A )
A B C D
使用燃料电池驱动新能源汽车 晶体硅太阳能电池提供“绿电” 利用风能进行发电 植物利用太阳能进行光合作用
2.下列装置能形成原电池的是( A )
① ② ③ ④ ⑤ ⑥ ⑦
A.①②③⑦ B.①②⑤⑥
C.①②③④ D.①②③⑥⑦
【解析】 ①②③⑦装置中具有自发的氧化还原反应,且形成闭合回路,存在能导电的电解质溶液,所以它们能形成工作状态的原电池。装置④不能形成闭合回路。装置⑤中只有一个电极。装置⑥中酒精不是电解质溶液。
3.下列关于下图装置的叙述,错误的是( A )
A.石墨电极的反应为O2+4H++4e-===2H2O
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入盐酸,石墨电极反应式为2H++2e-===H2↑
【解析】 这可以看成是模拟钢铁腐蚀的实验,石墨上的电极反应为O2+2H2O+4e-===4OH-。
4.(2021扬州高一期末)下图为某原电池的示意图,下列有关说法正确的是( D )
A.电子由铜棒流出
B.能量由电能转化为化学能
C.反应一段时间后,溶液变蓝
D.锌片上发生氧化反应
5.某实验兴趣小组按下图装置实验后,所记录内容合理的是( B )
实验记录 ① Cu为正极,Zn为负极② Zn质量减少,Cu质量增加③ SO向Cu极移动④ 电子流动方向是:由Zn经导线流入Cu片⑤ Zn电极发生还原反应⑥ 正极反应式:Cu2++2e-===Cu
A.②③④ B.①②④⑥
C.①②④⑤ D.②③⑤⑥
【解析】 ① Zn比Cu活泼,Zn为负极,Cu为正极,故①正确。② 铜为正极,发生反应Cu2++2e-===Cu,铜极质量增大,故②正确。③ 原电池工作时,阴离子向负极移动,故③错误。④ 电子由负极流向正极,即电子由Zn电极流向Cu电极,故④正确。⑤ Zn电极发生氧化反应,故⑤错误。⑥ 正极发生还原反应,电极反应式为Cu2++2e-===Cu,故⑥正确。
6.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 装置一 装置二 装置三 装置四
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( C )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
【解析】 装置一构成了工作状态的原电池,a极质量减小,说明a极的金属易失去电子,所以a极的金属比b极的金属活泼。装置二没有形成工作状态的原电池,可知b位于金属活动性顺序表中氢的前面,c位于氢的后面。装置三和四均形成了工作状态的原电池,推知d比c活泼,d比a活泼。因此四种金属的活动性顺序为d>a>b>c。
7.某兴趣小组设计的水果电池装置如下图所示。该电池工作时,下列说法正确的是( D )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
8.下图为钢铁生锈的原理示意图,下列有关说法错误的是( C )
A.转化过程中由化学能转化为电能
B.铁锈的主要成分是Fe2O3·xH2O
C.正极的电极反应式为Fe-2e-===Fe2+
D.发生电化学反应的总反应式为2Fe+O2+2H2O===2Fe(OH)2
【解析】 由图可知,转化过程中由化学能转化为电能,A项正确。铁锈的主要成分是Fe2O3·xH2O, B项正确。正极氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O===4OH-, C项错误。该电池中Fe失去电子变成Fe2+,和正极生成的OH-结合生成Fe(OH)2,发生电化学反应的总反应式为2Fe+O2+2H2O===2Fe(OH)2, D项正确。
9.如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡,小心地往烧杯中央滴入CuSO4溶液。
(1) 片刻后可观察到的现象是(指悬吊的金属圈)__D__(填字母)。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2) 产生上述现象的原因是__烧杯中的CuSO4溶液、Fe、_Ag三者构成了工作状态的原电池,发生反应Fe+CuSO4===FeSO4+Cu。铁较活泼,作负极,失电子而溶解,质量减轻。Cu2+在银圈上得到电子,生成Cu沉积在银圈上,质量增加__。
10.现有如下两个反应:①NaOH+HCl===NaCl+H2O, ②Cu+2Ag+===2Ag+Cu2+。其中能设计成原电池的是__②__(填序号),并填空。
负极材料:__Cu__,电极反应式:__Cu-2e-===Cu2+__,反应类型:__氧化反应__。
正极材料:__碳棒(或铂、银等)__,电极反应式:__2Ag++2e-===2Ag__,反应类型:__还原反应__。
11.某兴趣小组模拟纸电池进行实验(如右下图),下列有关说法正确的是( D )
A.Zn为正极
B.工作时,Cu电极发生氧化反应
C.工作时,电子经外电路由Cu电极流向Zn电极
D.工作一段时间后,Cu电极的质量增加
【解析】 本题是教材中铜锌原电池的变式。由于Zn比Cu活泼,故Zn作负极,电极反应式为Zn-2e-===Zn2+。 Cu作正极,CuSO4溶液作电解质溶液,故正极反应式为Cu2++2e-===Cu。原电池中的电子由负极经外电路导线流向正极。
12.运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O===2H2SO4,装置如下图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
(1) 该电池的负极是__电极a__(填“电极a”或“电极b”)。
(2) 通入O2的电极反应式是__O2+4H++4e-===2H2O__。
【解析】 (1)在原电池中,负极上的电极反应是氧化反应,根据总反应2SO2+O2+2H2O===2H2SO4可以判断SO2在反应中被氧化,所以电极a是负极。(2)O2在反应中得电子,与H+结合生成水,所以电极反应式是O2+4H++4e-===2H2O。
1.下列过程中涉及化学能转化为电能的是( )
A B C D
使用燃料电池驱动新能源汽车 晶体硅太阳能电池提供“绿电” 利用风能进行发电 植物利用太阳能进行光合作用
2.下列装置能形成原电池的是( )
① ② ③ ④ ⑤ ⑥ ⑦
A.①②③⑦ B.①②⑤⑥
C.①②③④ D.①②③⑥⑦
3.下列关于下图装置的叙述,错误的是( )
A.石墨电极的反应为O2+4H++4e-===2H2O
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入盐酸,石墨电极反应式为2H++2e-===H2↑
4.(2021扬州高一期末)下图为某原电池的示意图,下列有关说法正确的是( )
A.电子由铜棒流出
B.能量由电能转化为化学能
C.反应一段时间后,溶液变蓝
D.锌片上发生氧化反应
5.某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
实验记录 ① Cu为正极,Zn为负极② Zn质量减少,Cu质量增加③ SO向Cu极移动④ 电子流动方向是:由Zn经导线流入Cu片⑤ Zn电极发生还原反应⑥ 正极反应式:Cu2++2e-===Cu
A.②③④ B.①②④⑥
C.①②④⑤ D.②③⑤⑥
6.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 装置一 装置二 装置三 装置四
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
7.某兴趣小组设计的水果电池装置如下图所示。该电池工作时,下列说法正确的是( )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
8.下图为钢铁生锈的原理示意图,下列有关说法错误的是( )
A.转化过程中由化学能转化为电能
B.铁锈的主要成分是Fe2O3·xH2O
C.正极的电极反应式为Fe-2e-===Fe2+
D.发生电化学反应的总反应式为2Fe+O2+2H2O===2Fe(OH)2
9.如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡,小心地往烧杯中央滴入CuSO4溶液。
(1) 片刻后可观察到的现象是(指悬吊的金属圈) (填字母)。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2) 产生上述现象的原因是 。
10.现有如下两个反应:①NaOH+HCl===NaCl+H2O, ②Cu+2Ag+===2Ag+Cu2+。其中能设计成原电池的是 _(填序号),并填空。
负极材料: ,电极反应式: ,反应类型: 。
正极材料: ,电极反应式: ,反应类型: 。
11.某兴趣小组模拟纸电池进行实验(如右下图),下列有关说法正确的是( )
A.Zn为正极
B.工作时,Cu电极发生氧化反应
C.工作时,电子经外电路由Cu电极流向Zn电极
D.工作一段时间后,Cu电极的质量增加
12.运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O===2H2SO4,装置如下图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
(1) 该电池的负极是 (填“电极a”或“电极b”)。
(2) 通入O2的电极反应式是 。
第1课时 化学能转化为电能
1.下列过程中涉及化学能转化为电能的是( A )
A B C D
使用燃料电池驱动新能源汽车 晶体硅太阳能电池提供“绿电” 利用风能进行发电 植物利用太阳能进行光合作用
2.下列装置能形成原电池的是( A )
① ② ③ ④ ⑤ ⑥ ⑦
A.①②③⑦ B.①②⑤⑥
C.①②③④ D.①②③⑥⑦
【解析】 ①②③⑦装置中具有自发的氧化还原反应,且形成闭合回路,存在能导电的电解质溶液,所以它们能形成工作状态的原电池。装置④不能形成闭合回路。装置⑤中只有一个电极。装置⑥中酒精不是电解质溶液。
3.下列关于下图装置的叙述,错误的是( A )
A.石墨电极的反应为O2+4H++4e-===2H2O
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入盐酸,石墨电极反应式为2H++2e-===H2↑
【解析】 这可以看成是模拟钢铁腐蚀的实验,石墨上的电极反应为O2+2H2O+4e-===4OH-。
4.(2021扬州高一期末)下图为某原电池的示意图,下列有关说法正确的是( D )
A.电子由铜棒流出
B.能量由电能转化为化学能
C.反应一段时间后,溶液变蓝
D.锌片上发生氧化反应
5.某实验兴趣小组按下图装置实验后,所记录内容合理的是( B )
实验记录 ① Cu为正极,Zn为负极② Zn质量减少,Cu质量增加③ SO向Cu极移动④ 电子流动方向是:由Zn经导线流入Cu片⑤ Zn电极发生还原反应⑥ 正极反应式:Cu2++2e-===Cu
A.②③④ B.①②④⑥
C.①②④⑤ D.②③⑤⑥
【解析】 ① Zn比Cu活泼,Zn为负极,Cu为正极,故①正确。② 铜为正极,发生反应Cu2++2e-===Cu,铜极质量增大,故②正确。③ 原电池工作时,阴离子向负极移动,故③错误。④ 电子由负极流向正极,即电子由Zn电极流向Cu电极,故④正确。⑤ Zn电极发生氧化反应,故⑤错误。⑥ 正极发生还原反应,电极反应式为Cu2++2e-===Cu,故⑥正确。
6.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 装置一 装置二 装置三 装置四
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( C )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
【解析】 装置一构成了工作状态的原电池,a极质量减小,说明a极的金属易失去电子,所以a极的金属比b极的金属活泼。装置二没有形成工作状态的原电池,可知b位于金属活动性顺序表中氢的前面,c位于氢的后面。装置三和四均形成了工作状态的原电池,推知d比c活泼,d比a活泼。因此四种金属的活动性顺序为d>a>b>c。
7.某兴趣小组设计的水果电池装置如下图所示。该电池工作时,下列说法正确的是( D )
A.铜片作负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
8.下图为钢铁生锈的原理示意图,下列有关说法错误的是( C )
A.转化过程中由化学能转化为电能
B.铁锈的主要成分是Fe2O3·xH2O
C.正极的电极反应式为Fe-2e-===Fe2+
D.发生电化学反应的总反应式为2Fe+O2+2H2O===2Fe(OH)2
【解析】 由图可知,转化过程中由化学能转化为电能,A项正确。铁锈的主要成分是Fe2O3·xH2O, B项正确。正极氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O===4OH-, C项错误。该电池中Fe失去电子变成Fe2+,和正极生成的OH-结合生成Fe(OH)2,发生电化学反应的总反应式为2Fe+O2+2H2O===2Fe(OH)2, D项正确。
9.如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡,小心地往烧杯中央滴入CuSO4溶液。
(1) 片刻后可观察到的现象是(指悬吊的金属圈)__D__(填字母)。
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
(2) 产生上述现象的原因是__烧杯中的CuSO4溶液、Fe、_Ag三者构成了工作状态的原电池,发生反应Fe+CuSO4===FeSO4+Cu。铁较活泼,作负极,失电子而溶解,质量减轻。Cu2+在银圈上得到电子,生成Cu沉积在银圈上,质量增加__。
10.现有如下两个反应:①NaOH+HCl===NaCl+H2O, ②Cu+2Ag+===2Ag+Cu2+。其中能设计成原电池的是__②__(填序号),并填空。
负极材料:__Cu__,电极反应式:__Cu-2e-===Cu2+__,反应类型:__氧化反应__。
正极材料:__碳棒(或铂、银等)__,电极反应式:__2Ag++2e-===2Ag__,反应类型:__还原反应__。
11.某兴趣小组模拟纸电池进行实验(如右下图),下列有关说法正确的是( D )
A.Zn为正极
B.工作时,Cu电极发生氧化反应
C.工作时,电子经外电路由Cu电极流向Zn电极
D.工作一段时间后,Cu电极的质量增加
【解析】 本题是教材中铜锌原电池的变式。由于Zn比Cu活泼,故Zn作负极,电极反应式为Zn-2e-===Zn2+。 Cu作正极,CuSO4溶液作电解质溶液,故正极反应式为Cu2++2e-===Cu。原电池中的电子由负极经外电路导线流向正极。
12.运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O===2H2SO4,装置如下图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
(1) 该电池的负极是__电极a__(填“电极a”或“电极b”)。
(2) 通入O2的电极反应式是__O2+4H++4e-===2H2O__。
【解析】 (1)在原电池中,负极上的电极反应是氧化反应,根据总反应2SO2+O2+2H2O===2H2SO4可以判断SO2在反应中被氧化,所以电极a是负极。(2)O2在反应中得电子,与H+结合生成水,所以电极反应式是O2+4H++4e-===2H2O。
