2022—2023学年化学人教版九年级下册第11单元 盐 化肥 练习(含答案)
文档属性
| 名称 | 2022—2023学年化学人教版九年级下册第11单元 盐 化肥 练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 495.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 07:45:31 | ||
图片预览



文档简介
2022—2023学年化学人教版九年级下册第11单元 盐 化肥 练习含答案
人教版第11单元 盐 化肥
一、选择题。
1、对盐的组成叙述正确的是( )
A.都含有原子团 B.都含有金属元素
C.都不含有氢元素 D.都含有非金属元素
2、下面各组物质在水溶液中能大量共存的是( )
A.NaCl、HCl、Na2CO3、NaOH B.H2SO4、BaCl2、KNO3、NaOH
C.CuSO4、Na2CO3、NaOH、KCl D.NaCl、KCl、HCl、NaNO3
3、下列实验中无明显现象的是( )
A. 向H2SO4溶液中滴加Ba(OH)2溶液
B. 向Mg(NO3)2溶液中滴加Na2SO4溶液
C. 将浓硫酸加入蒸馏水中并不断搅拌
D. 向灼热的氧化铜中通入一氧化碳气体
4、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈
B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液
D. 纯碱除油污
5、含有硫酸根离子的盐称为硫酸盐,下列物质属于硫酸盐的是( )
A. H2SO4 B. Na2S C. K2SO4 D. SO2
6、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
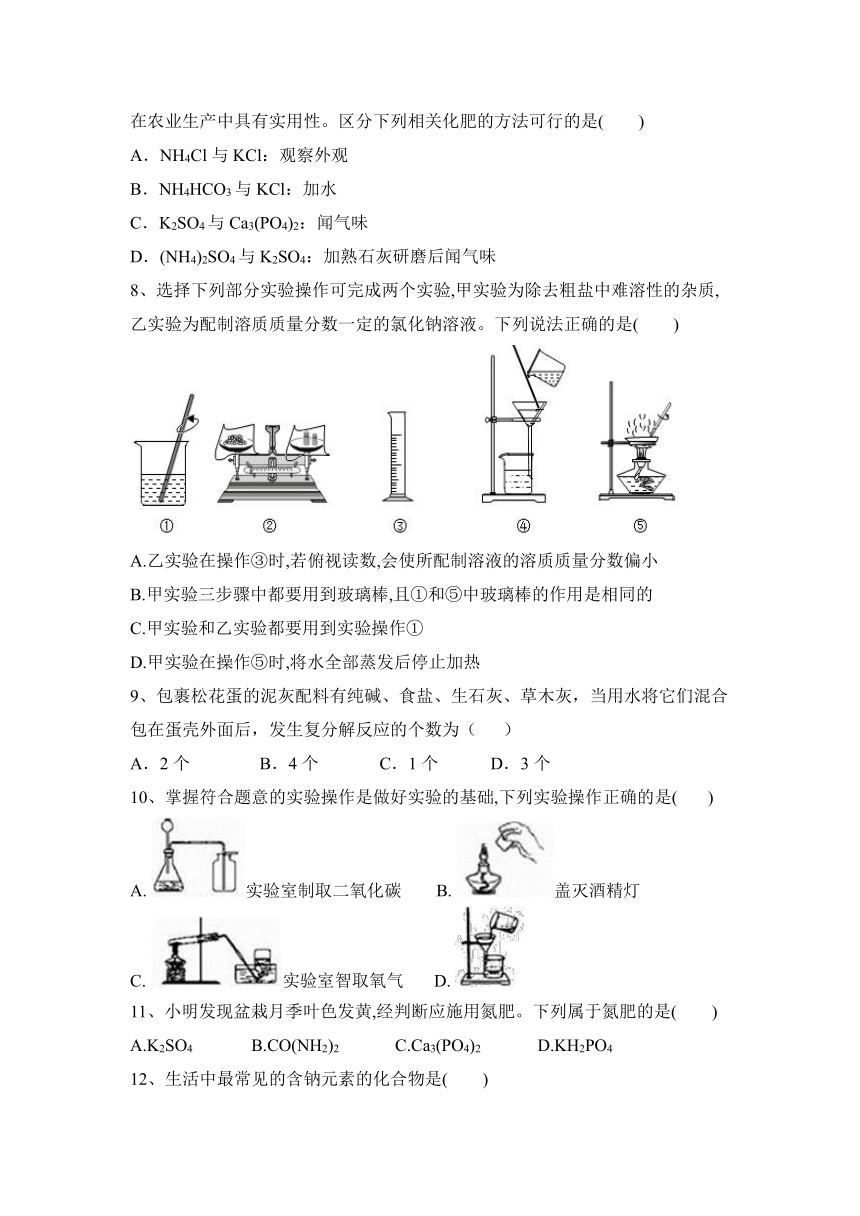
8、选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数一定的氯化钠溶液。下列说法正确的是( )
A.乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
B.甲实验三步骤中都要用到玻璃棒,且①和⑤中玻璃棒的作用是相同的
C.甲实验和乙实验都要用到实验操作①
D.甲实验在操作⑤时,将水全部蒸发后停止加热
9、包裹松花蛋的泥灰配料有纯碱、食盐、生石灰、草木灰,当用水将它们混合包在蛋壳外面后,发生复分解反应的个数为( )
A.2个 B.4个 C.1个 D.3个
10、掌握符合题意的实验操作是做好实验的基础,下列实验操作正确的是( )
A. 实验室制取二氧化碳 B. 盖灭酒精灯
C. 实验室智取氧气 D.
11、小明发现盆栽月季叶色发黄,经判断应施用氮肥。下列属于氮肥的是( )
A.K2SO4 B.CO(NH2)2 C.Ca3(PO4)2 D.KH2PO4
12、生活中最常见的含钠元素的化合物是( )
A. NaOH B. NaCl C. Na2CO3 D. NaHCO3
*13、下列各选项中物质的名称或俗名与括号内的化学式一致的是( )
A. 高锰酸钾(KMnO4) B. 熟石灰(CaO)
C. 硫酸铁(FeSO4) D. 烧碱(Na2CO3)
14、化学肥料是农作物的“粮食”。下列关于化学肥料的说法正确的是( )
A.尿素[CO(NH2)2]属于复合肥料
B.大量施用化肥以提高农作物产量
C.铵态氮肥与草木灰混用,会降低肥效
D.棉花叶片枯黄,应施用硫酸钾等钾肥
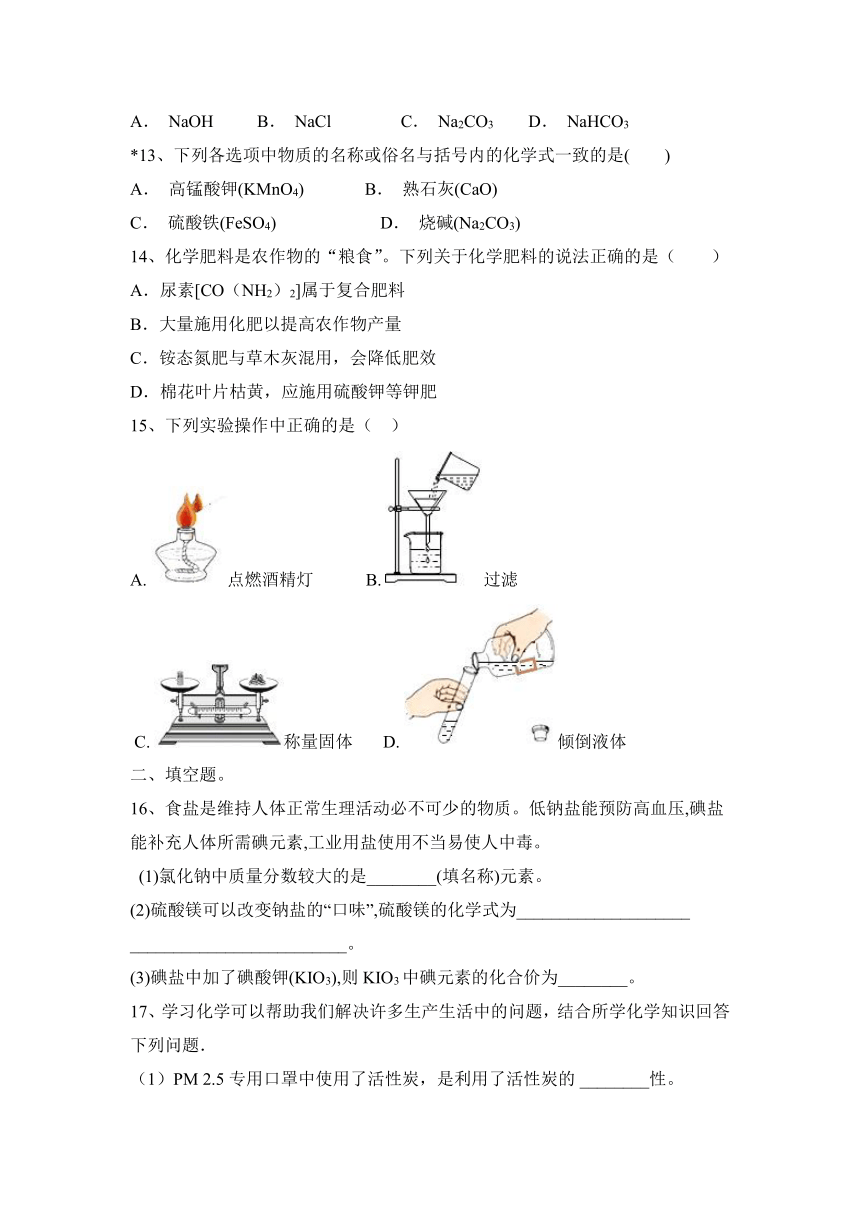
15、下列实验操作中正确的是( )
A. 点燃酒精灯 B. 过滤
C. 称量固体 D. 倾倒液体
二、填空题。
16、食盐是维持人体正常生理活动必不可少的物质。低钠盐能预防高血压,碘盐能补充人体所需碘元素,工业用盐使用不当易使人中毒。
(1)氯化钠中质量分数较大的是________(填名称)元素。
(2)硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为____________________
_________________________。
(3)碘盐中加了碘酸钾(KIO3),则KIO3中碘元素的化合价为________。
17、学习化学可以帮助我们解决许多生产生活中的问题,结合所学化学知识回答下列问题.
(1)PM 2.5专用口罩中使用了活性炭,是利用了活性炭的 ________性。
(2)“沙里淘金”说明黄金在自然界中能够以 ________(填“单质”或“化合物”)形式存在。
(3)家庭装修时,在卫生间安装太阳能沐浴器,它是把太阳能转化为 ________能。
(4)硝酸钾是农业生产中常用的肥料,硝酸钾属于 ________肥。
18、在电解水的实验中,在与电源正极相连的玻璃管内产生气体是________,与电源负极相连的玻璃管内产生气体是________,正极产生的气体与负极产生的气体体积比约为________。写出电解水的化学方程式________ 。
19、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
20、如图所示,两椭圆相交处表示两种化合物的共性,椭圆其余部分表示两物质的个性,“→”表示某种物质通过一步反应可转化为另一种物质,回答下列问题:
(1)碳酸钠溶液呈________(填“酸性”“中性”或“碱性”)。
(2)若甲物质和碳酸钠属于同类别的化合物,写出“碳酸钠→甲”的化学方程式:__________________________(写一个)。
(3)若乙物质和碳酸钠属于不同类别的化合物,则乙物质的名称是__________,常温下的状态是________(填“固态”“液态”或“气态”),写出“碳酸钠→乙”的化学方程式:___________________________________________ (写一个)。
(4)写出乙物质与丙物质反应的化学方程式____________ (写一个)。
21、无土栽培是利用营养液栽培作物的一种方法.如表中是栽培绿叶菜营养液配方。
肥料成份名称 用量(毫克∕升)
硝酸钙 1260
硫酸钾 250
磷酸二氢钾 350
硫酸镁 537
硫酸铵 237
(1)化学肥料成份中属于复合肥的肥料名称是________ 。
(2)该营养液中存在的一种金属离子符号________。
(3)硫酸镁的化学式是:________。
22、水是生命之源,根据所学知识回答下列问题:
(1)鉴别硬水和软水用________,鉴别出软水的现象为________ ;
(2)在电解水实验中,产生氢气和氧气的质量比为________;
(3)在实验室中,要得到纯净物水的方法是________。
三、实验题。
23、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
24、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
四、计算题。
25、对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如下图所示。(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2=BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
XX牌钾肥主要成分:K2SO4((K2SO4含量≥86%)净重: 50KgXX化工有限公司
2022—2023学年化学人教版九年级下册第11单元 盐 化肥 练习含答案
人教版第11单元 盐 化肥
一、选择题。
1、对盐的组成叙述正确的是( )
A.都含有原子团 B.都含有金属元素
C.都不含有氢元素 D.都含有非金属元素
【答案】D
2、下面各组物质在水溶液中能大量共存的是( )
A.NaCl、HCl、Na2CO3、NaOH B.H2SO4、BaCl2、KNO3、NaOH
C.CuSO4、Na2CO3、NaOH、KCl D.NaCl、KCl、HCl、NaNO3
【答案】D
3、下列实验中无明显现象的是( )
A. 向H2SO4溶液中滴加Ba(OH)2溶液
B. 向Mg(NO3)2溶液中滴加Na2SO4溶液
C. 将浓硫酸加入蒸馏水中并不断搅拌
D. 向灼热的氧化铜中通入一氧化碳气体
【答案】B
4、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈
B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液
D. 纯碱除油污
【答案】B
5、含有硫酸根离子的盐称为硫酸盐,下列物质属于硫酸盐的是( )
A. H2SO4 B. Na2S C. K2SO4 D. SO2
【答案】C
6、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
【答案】A
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
【答案】D
8、选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数一定的氯化钠溶液。下列说法正确的是( )
A.乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
B.甲实验三步骤中都要用到玻璃棒,且①和⑤中玻璃棒的作用是相同的
C.甲实验和乙实验都要用到实验操作①
D.甲实验在操作⑤时,将水全部蒸发后停止加热
【答案】C
9、包裹松花蛋的泥灰配料有纯碱、食盐、生石灰、草木灰,当用水将它们混合包在蛋壳外面后,发生复分解反应的个数为( )
A.2个 B.4个 C.1个 D.3个
【答案】C
10、掌握符合题意的实验操作是做好实验的基础,下列实验操作正确的是( )
A. 实验室制取二氧化碳 B. 盖灭酒精灯
C. 实验室智取氧气 D.
【答案】B
11、小明发现盆栽月季叶色发黄,经判断应施用氮肥。下列属于氮肥的是( )
A.K2SO4 B.CO(NH2)2 C.Ca3(PO4)2 D.KH2PO4
【答案】B
12、生活中最常见的含钠元素的化合物是( )
A. NaOH B. NaCl C. Na2CO3 D. NaHCO3
【答案】B
*13、下列各选项中物质的名称或俗名与括号内的化学式一致的是( )
A. 高锰酸钾(KMnO4) B. 熟石灰(CaO)
C. 硫酸铁(FeSO4) D. 烧碱(Na2CO3)
【答案】A
14、化学肥料是农作物的“粮食”。下列关于化学肥料的说法正确的是( )
A.尿素[CO(NH2)2]属于复合肥料
B.大量施用化肥以提高农作物产量
C.铵态氮肥与草木灰混用,会降低肥效
D.棉花叶片枯黄,应施用硫酸钾等钾肥
【答案】C。
15、下列实验操作中正确的是( )
A. 点燃酒精灯 B. 过滤
C. 称量固体 D. 倾倒液体
【答案】A
二、填空题。
16、食盐是维持人体正常生理活动必不可少的物质。低钠盐能预防高血压,碘盐能补充人体所需碘元素,工业用盐使用不当易使人中毒。
(1)氯化钠中质量分数较大的是________(填名称)元素。
(2)硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为____________________
_________________________。
(3)碘盐中加了碘酸钾(KIO3),则KIO3中碘元素的化合价为________。
【答案】(1)氯 (2)MgSO4 (3)+5
17、学习化学可以帮助我们解决许多生产生活中的问题,结合所学化学知识回答下列问题.
(1)PM 2.5专用口罩中使用了活性炭,是利用了活性炭的 ________性。
(2)“沙里淘金”说明黄金在自然界中能够以 ________(填“单质”或“化合物”)形式存在。
(3)家庭装修时,在卫生间安装太阳能沐浴器,它是把太阳能转化为 ________能。
(4)硝酸钾是农业生产中常用的肥料,硝酸钾属于 ________肥。
【答案】(1)吸附; (2)单质; (3)热; (4)复合
18、在电解水的实验中,在与电源正极相连的玻璃管内产生气体是________,与电源负极相连的玻璃管内产生气体是________,正极产生的气体与负极产生的气体体积比约为________。写出电解水的化学方程式________ 。
【答案】 氧气;氢气;1:2;2H2O 2H2↑+O2↑
19、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
【答案】
(1) 大量晶体析出
(2)H2O (3)Na2SO4 NaCl
20、如图所示,两椭圆相交处表示两种化合物的共性,椭圆其余部分表示两物质的个性,“→”表示某种物质通过一步反应可转化为另一种物质,回答下列问题:
(1)碳酸钠溶液呈________(填“酸性”“中性”或“碱性”)。
(2)若甲物质和碳酸钠属于同类别的化合物,写出“碳酸钠→甲”的化学方程式:__________________________(写一个)。
(3)若乙物质和碳酸钠属于不同类别的化合物,则乙物质的名称是__________,常温下的状态是________(填“固态”“液态”或“气态”),写出“碳酸钠→乙”的化学方程式:___________________________________________ (写一个)。
(4)写出乙物质与丙物质反应的化学方程式____________ (写一个)。
【答案】(1)碱性 (2)Na2CO3+Ca(OH)2 CaCO3↓+2NaOH(合理即可)
(3)二氧化碳 气态 Na2CO3+2HCl2NaCl+H2O+CO2↑(合理即可)
(4)CO2+Ca(OH)2CaCO3↓+H2O(合理即可)
21、无土栽培是利用营养液栽培作物的一种方法.如表中是栽培绿叶菜营养液配方。
肥料成份名称 用量(毫克∕升)
硝酸钙 1260
硫酸钾 250
磷酸二氢钾 350
硫酸镁 537
硫酸铵 237
(1)化学肥料成份中属于复合肥的肥料名称是________ 。
(2)该营养液中存在的一种金属离子符号________。
(3)硫酸镁的化学式是:________。
【答案】(1)磷酸二氢钾 (2)K+ ( Ca2+ , Mg2+) (3)MgSO4
22、水是生命之源,根据所学知识回答下列问题:
(1)鉴别硬水和软水用________,鉴别出软水的现象为________ ;
(2)在电解水实验中,产生氢气和氧气的质量比为________;
(3)在实验室中,要得到纯净物水的方法是________。
【答案】(1)肥皂水;浮渣少,泡沫多 (2)1:8 (3)蒸馏
三、实验题。
23、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
【答案】(1)往左盘加树碱至天平平衡 (2)胶头滴管 (3)搅拌,加速溶解 (4)13.8% (5)偏小
24、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
【答案】
(1)①大部分物质的溶解度随温度的升高而增大 ②各物质的解度不一定相同
(2)③K2SO4 ④没有
(3)【猜想】苯甲酸、氯化钾
【实验探究】
四、计算题。
25、对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如下图所示。(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2=BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
XX牌钾肥主要成分:K2SO4((K2SO4含量≥86%)净重: 50KgXX化工有限公司
【答案】(1)② (2)35%
(3)硝酸铵能与碱性物质反应产生氨气,降低肥效 (4)有机物
【解析】设4.0g钾肥样品中含有硫酸钾的质量为x。
Ba(OH)2+K2SO4=BaSO4↓+2KOH
174 233
X 4.66g
174:233=x:4.66g
X=3.48g
则这种钾肥样品中硫酸钾的质量分数为:87%
由于87%>86%,该钾肥中硫酸钾的质量分数符合产品包装说明。
人教版第11单元 盐 化肥
一、选择题。
1、对盐的组成叙述正确的是( )
A.都含有原子团 B.都含有金属元素
C.都不含有氢元素 D.都含有非金属元素
2、下面各组物质在水溶液中能大量共存的是( )
A.NaCl、HCl、Na2CO3、NaOH B.H2SO4、BaCl2、KNO3、NaOH
C.CuSO4、Na2CO3、NaOH、KCl D.NaCl、KCl、HCl、NaNO3
3、下列实验中无明显现象的是( )
A. 向H2SO4溶液中滴加Ba(OH)2溶液
B. 向Mg(NO3)2溶液中滴加Na2SO4溶液
C. 将浓硫酸加入蒸馏水中并不断搅拌
D. 向灼热的氧化铜中通入一氧化碳气体
4、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈
B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液
D. 纯碱除油污
5、含有硫酸根离子的盐称为硫酸盐,下列物质属于硫酸盐的是( )
A. H2SO4 B. Na2S C. K2SO4 D. SO2
6、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
8、选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数一定的氯化钠溶液。下列说法正确的是( )
A.乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
B.甲实验三步骤中都要用到玻璃棒,且①和⑤中玻璃棒的作用是相同的
C.甲实验和乙实验都要用到实验操作①
D.甲实验在操作⑤时,将水全部蒸发后停止加热
9、包裹松花蛋的泥灰配料有纯碱、食盐、生石灰、草木灰,当用水将它们混合包在蛋壳外面后,发生复分解反应的个数为( )
A.2个 B.4个 C.1个 D.3个
10、掌握符合题意的实验操作是做好实验的基础,下列实验操作正确的是( )
A. 实验室制取二氧化碳 B. 盖灭酒精灯
C. 实验室智取氧气 D.
11、小明发现盆栽月季叶色发黄,经判断应施用氮肥。下列属于氮肥的是( )
A.K2SO4 B.CO(NH2)2 C.Ca3(PO4)2 D.KH2PO4
12、生活中最常见的含钠元素的化合物是( )
A. NaOH B. NaCl C. Na2CO3 D. NaHCO3
*13、下列各选项中物质的名称或俗名与括号内的化学式一致的是( )
A. 高锰酸钾(KMnO4) B. 熟石灰(CaO)
C. 硫酸铁(FeSO4) D. 烧碱(Na2CO3)
14、化学肥料是农作物的“粮食”。下列关于化学肥料的说法正确的是( )
A.尿素[CO(NH2)2]属于复合肥料
B.大量施用化肥以提高农作物产量
C.铵态氮肥与草木灰混用,会降低肥效
D.棉花叶片枯黄,应施用硫酸钾等钾肥
15、下列实验操作中正确的是( )
A. 点燃酒精灯 B. 过滤
C. 称量固体 D. 倾倒液体
二、填空题。
16、食盐是维持人体正常生理活动必不可少的物质。低钠盐能预防高血压,碘盐能补充人体所需碘元素,工业用盐使用不当易使人中毒。
(1)氯化钠中质量分数较大的是________(填名称)元素。
(2)硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为____________________
_________________________。
(3)碘盐中加了碘酸钾(KIO3),则KIO3中碘元素的化合价为________。
17、学习化学可以帮助我们解决许多生产生活中的问题,结合所学化学知识回答下列问题.
(1)PM 2.5专用口罩中使用了活性炭,是利用了活性炭的 ________性。
(2)“沙里淘金”说明黄金在自然界中能够以 ________(填“单质”或“化合物”)形式存在。
(3)家庭装修时,在卫生间安装太阳能沐浴器,它是把太阳能转化为 ________能。
(4)硝酸钾是农业生产中常用的肥料,硝酸钾属于 ________肥。
18、在电解水的实验中,在与电源正极相连的玻璃管内产生气体是________,与电源负极相连的玻璃管内产生气体是________,正极产生的气体与负极产生的气体体积比约为________。写出电解水的化学方程式________ 。
19、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
20、如图所示,两椭圆相交处表示两种化合物的共性,椭圆其余部分表示两物质的个性,“→”表示某种物质通过一步反应可转化为另一种物质,回答下列问题:
(1)碳酸钠溶液呈________(填“酸性”“中性”或“碱性”)。
(2)若甲物质和碳酸钠属于同类别的化合物,写出“碳酸钠→甲”的化学方程式:__________________________(写一个)。
(3)若乙物质和碳酸钠属于不同类别的化合物,则乙物质的名称是__________,常温下的状态是________(填“固态”“液态”或“气态”),写出“碳酸钠→乙”的化学方程式:___________________________________________ (写一个)。
(4)写出乙物质与丙物质反应的化学方程式____________ (写一个)。
21、无土栽培是利用营养液栽培作物的一种方法.如表中是栽培绿叶菜营养液配方。
肥料成份名称 用量(毫克∕升)
硝酸钙 1260
硫酸钾 250
磷酸二氢钾 350
硫酸镁 537
硫酸铵 237
(1)化学肥料成份中属于复合肥的肥料名称是________ 。
(2)该营养液中存在的一种金属离子符号________。
(3)硫酸镁的化学式是:________。
22、水是生命之源,根据所学知识回答下列问题:
(1)鉴别硬水和软水用________,鉴别出软水的现象为________ ;
(2)在电解水实验中,产生氢气和氧气的质量比为________;
(3)在实验室中,要得到纯净物水的方法是________。
三、实验题。
23、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
24、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
四、计算题。
25、对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如下图所示。(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2=BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
XX牌钾肥主要成分:K2SO4((K2SO4含量≥86%)净重: 50KgXX化工有限公司
2022—2023学年化学人教版九年级下册第11单元 盐 化肥 练习含答案
人教版第11单元 盐 化肥
一、选择题。
1、对盐的组成叙述正确的是( )
A.都含有原子团 B.都含有金属元素
C.都不含有氢元素 D.都含有非金属元素
【答案】D
2、下面各组物质在水溶液中能大量共存的是( )
A.NaCl、HCl、Na2CO3、NaOH B.H2SO4、BaCl2、KNO3、NaOH
C.CuSO4、Na2CO3、NaOH、KCl D.NaCl、KCl、HCl、NaNO3
【答案】D
3、下列实验中无明显现象的是( )
A. 向H2SO4溶液中滴加Ba(OH)2溶液
B. 向Mg(NO3)2溶液中滴加Na2SO4溶液
C. 将浓硫酸加入蒸馏水中并不断搅拌
D. 向灼热的氧化铜中通入一氧化碳气体
【答案】B
4、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈
B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液
D. 纯碱除油污
【答案】B
5、含有硫酸根离子的盐称为硫酸盐,下列物质属于硫酸盐的是( )
A. H2SO4 B. Na2S C. K2SO4 D. SO2
【答案】C
6、图 中“●”和“○”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )
A. B. C. D.
【答案】A
7、氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区分三种化肥,在农业生产中具有实用性。区分下列相关化肥的方法可行的是( )
A.NH4Cl与KCl:观察外观
B.NH4HCO3与KCl:加水
C.K2SO4与Ca3(PO4)2:闻气味
D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味
【答案】D
8、选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数一定的氯化钠溶液。下列说法正确的是( )
A.乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
B.甲实验三步骤中都要用到玻璃棒,且①和⑤中玻璃棒的作用是相同的
C.甲实验和乙实验都要用到实验操作①
D.甲实验在操作⑤时,将水全部蒸发后停止加热
【答案】C
9、包裹松花蛋的泥灰配料有纯碱、食盐、生石灰、草木灰,当用水将它们混合包在蛋壳外面后,发生复分解反应的个数为( )
A.2个 B.4个 C.1个 D.3个
【答案】C
10、掌握符合题意的实验操作是做好实验的基础,下列实验操作正确的是( )
A. 实验室制取二氧化碳 B. 盖灭酒精灯
C. 实验室智取氧气 D.
【答案】B
11、小明发现盆栽月季叶色发黄,经判断应施用氮肥。下列属于氮肥的是( )
A.K2SO4 B.CO(NH2)2 C.Ca3(PO4)2 D.KH2PO4
【答案】B
12、生活中最常见的含钠元素的化合物是( )
A. NaOH B. NaCl C. Na2CO3 D. NaHCO3
【答案】B
*13、下列各选项中物质的名称或俗名与括号内的化学式一致的是( )
A. 高锰酸钾(KMnO4) B. 熟石灰(CaO)
C. 硫酸铁(FeSO4) D. 烧碱(Na2CO3)
【答案】A
14、化学肥料是农作物的“粮食”。下列关于化学肥料的说法正确的是( )
A.尿素[CO(NH2)2]属于复合肥料
B.大量施用化肥以提高农作物产量
C.铵态氮肥与草木灰混用,会降低肥效
D.棉花叶片枯黄,应施用硫酸钾等钾肥
【答案】C。
15、下列实验操作中正确的是( )
A. 点燃酒精灯 B. 过滤
C. 称量固体 D. 倾倒液体
【答案】A
二、填空题。
16、食盐是维持人体正常生理活动必不可少的物质。低钠盐能预防高血压,碘盐能补充人体所需碘元素,工业用盐使用不当易使人中毒。
(1)氯化钠中质量分数较大的是________(填名称)元素。
(2)硫酸镁可以改变钠盐的“口味”,硫酸镁的化学式为____________________
_________________________。
(3)碘盐中加了碘酸钾(KIO3),则KIO3中碘元素的化合价为________。
【答案】(1)氯 (2)MgSO4 (3)+5
17、学习化学可以帮助我们解决许多生产生活中的问题,结合所学化学知识回答下列问题.
(1)PM 2.5专用口罩中使用了活性炭,是利用了活性炭的 ________性。
(2)“沙里淘金”说明黄金在自然界中能够以 ________(填“单质”或“化合物”)形式存在。
(3)家庭装修时,在卫生间安装太阳能沐浴器,它是把太阳能转化为 ________能。
(4)硝酸钾是农业生产中常用的肥料,硝酸钾属于 ________肥。
【答案】(1)吸附; (2)单质; (3)热; (4)复合
18、在电解水的实验中,在与电源正极相连的玻璃管内产生气体是________,与电源负极相连的玻璃管内产生气体是________,正极产生的气体与负极产生的气体体积比约为________。写出电解水的化学方程式________ 。
【答案】 氧气;氢气;1:2;2H2O 2H2↑+O2↑
19、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
【答案】
(1) 大量晶体析出
(2)H2O (3)Na2SO4 NaCl
20、如图所示,两椭圆相交处表示两种化合物的共性,椭圆其余部分表示两物质的个性,“→”表示某种物质通过一步反应可转化为另一种物质,回答下列问题:
(1)碳酸钠溶液呈________(填“酸性”“中性”或“碱性”)。
(2)若甲物质和碳酸钠属于同类别的化合物,写出“碳酸钠→甲”的化学方程式:__________________________(写一个)。
(3)若乙物质和碳酸钠属于不同类别的化合物,则乙物质的名称是__________,常温下的状态是________(填“固态”“液态”或“气态”),写出“碳酸钠→乙”的化学方程式:___________________________________________ (写一个)。
(4)写出乙物质与丙物质反应的化学方程式____________ (写一个)。
【答案】(1)碱性 (2)Na2CO3+Ca(OH)2 CaCO3↓+2NaOH(合理即可)
(3)二氧化碳 气态 Na2CO3+2HCl2NaCl+H2O+CO2↑(合理即可)
(4)CO2+Ca(OH)2CaCO3↓+H2O(合理即可)
21、无土栽培是利用营养液栽培作物的一种方法.如表中是栽培绿叶菜营养液配方。
肥料成份名称 用量(毫克∕升)
硝酸钙 1260
硫酸钾 250
磷酸二氢钾 350
硫酸镁 537
硫酸铵 237
(1)化学肥料成份中属于复合肥的肥料名称是________ 。
(2)该营养液中存在的一种金属离子符号________。
(3)硫酸镁的化学式是:________。
【答案】(1)磷酸二氢钾 (2)K+ ( Ca2+ , Mg2+) (3)MgSO4
22、水是生命之源,根据所学知识回答下列问题:
(1)鉴别硬水和软水用________,鉴别出软水的现象为________ ;
(2)在电解水实验中,产生氢气和氧气的质量比为________;
(3)在实验室中,要得到纯净物水的方法是________。
【答案】(1)肥皂水;浮渣少,泡沫多 (2)1:8 (3)蒸馏
三、实验题。
23、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
【答案】(1)往左盘加树碱至天平平衡 (2)胶头滴管 (3)搅拌,加速溶解 (4)13.8% (5)偏小
24、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
【答案】
(1)①大部分物质的溶解度随温度的升高而增大 ②各物质的解度不一定相同
(2)③K2SO4 ④没有
(3)【猜想】苯甲酸、氯化钾
【实验探究】
四、计算题。
25、对化肥的销售,国家规定了明确的质量要求。某农业科技人员对农民买来的钾肥进行了检测,称取4.0g样品放入小烧杯中,加入适量的水溶解后,与足量氢氧化钡溶液充分反应。产生沉淀的质量与所加入的氢氧化钡溶液质量的关系如下图所示。(假定杂质不参加反应,反应方程式为K2SO4+Ba(OH)2=BaSO4↓+2KOH)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?
XX牌钾肥主要成分:K2SO4((K2SO4含量≥86%)净重: 50KgXX化工有限公司
【答案】(1)② (2)35%
(3)硝酸铵能与碱性物质反应产生氨气,降低肥效 (4)有机物
【解析】设4.0g钾肥样品中含有硫酸钾的质量为x。
Ba(OH)2+K2SO4=BaSO4↓+2KOH
174 233
X 4.66g
174:233=x:4.66g
X=3.48g
则这种钾肥样品中硫酸钾的质量分数为:87%
由于87%>86%,该钾肥中硫酸钾的质量分数符合产品包装说明。
同课章节目录
