人教版九下9.3 溶液的浓度 课件(共26张PPT内嵌视频)
文档属性
| 名称 | 人教版九下9.3 溶液的浓度 课件(共26张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
9.3 溶液的浓度
死海中含有高浓度的盐分,为一般海水的8.6倍,致使水中没有生物存活,甚至连死海沿岸的陆地上也很少有除水草外的生物。
死海中的盐浓度怎样定量表示呢?
学习目标
1. 进一步分辨溶液、溶质、溶剂,理解溶质的质量分数的含义。
2. 能进行溶质的质量分数的简单运算。
3. 掌握溶液的稀释计算。
一、溶液的浓度
三种浓稀不同的硫酸铜溶液
一、溶液的浓度
实验 9-7
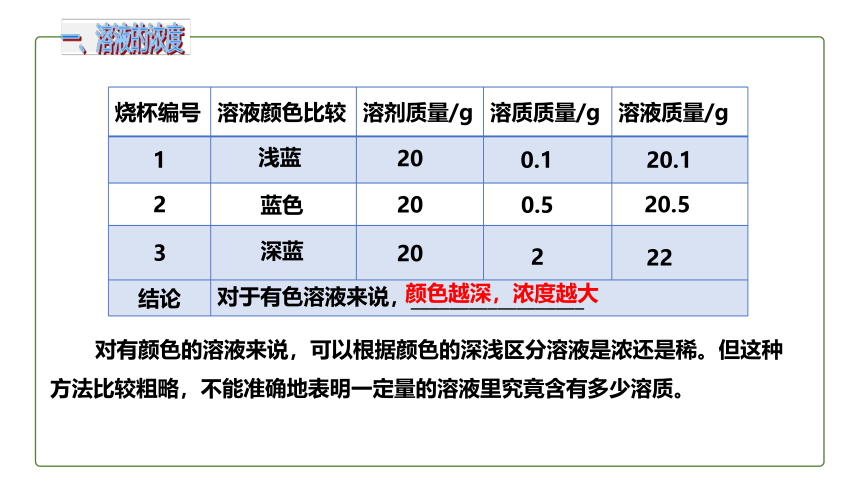
在室温下,向三个小烧杯中各加入20 mL水,然后分别加入0.1 g、0.5 g、2 g无水硫酸铜,振荡,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色。在这三种溶液中,哪种最浓?哪种溶液最稀?你判断的依据是什么?
一、溶液的浓度
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
结论 对于有色溶液来说,__________________
浅蓝
蓝色
深蓝
20
20
20
0.1
0.5
2
20.1
20.5
22
颜色越深,浓度越大
对有颜色的溶液来说,可以根据颜色的深浅区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
一、溶液的浓度
溶液的浓与稀只能粗略地表明一定量的溶液里所含溶质的多少,但在实际应用中,常常要准确知道一定量溶液里含有溶质的质量。因此需要准确知道溶液的组成。那如何表明溶液的组成呢?
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木
二、溶质的的质量分数
溶质质量分数
概念:溶质质量和溶液质量的比值叫做溶质的质量分数。
公式:溶质的质量分数
溶质的质量
= —————— × 100﹪
溶液的质量
溶质的质量
= ——————————— ×100﹪
溶质的质量+溶剂的质量
含义:在100份质量的溶液里有多少份质量的溶质。
二、溶质的的质量分数
溶质质量分数的含义
5 % 的食盐溶液
①5g食盐溶于95g水形成的溶液。
②食盐的质量占整个食盐溶液的5%。
③将100g食盐溶液蒸干可以得到食盐5g。
④组成:M(食盐):M(水):M(食盐溶液) =5 : 95 : 100
溶质质量
溶液质量
二、溶质的的质量分数
溶质的质量分数
溶质质量
溶液质量
×100%
溶质的质量=
溶液的质量=
溶质的质量
溶质的质量分数
溶液的质量×溶质的质量分数
变形公式
二、溶质的的质量分数
按下表所定的量配制氯化钠溶液并计算
实验9-8
在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度可看做1 g/cm )。
溶质质量/g 溶剂(水)质量/g 现 象 溶液中溶质的质量分数
10 90
20 80
二、溶质的的质量分数
质量分数与溶解度的关系
已知20℃时,氯化钠的溶解度是36 g。有人说“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
温度 溶质的质量 溶剂的质量 溶液的质量
20℃
36 g
100 g
100 g+36 g
二、溶质的的质量分数
溶解度与溶质质量分数的比较
区别 溶解度 溶质的质量分数
概念 一定温度时,100 g溶剂中最多溶解溶质的质量 任意溶液中,溶质质量与溶液质量之比
表示意义 某物质溶解能力的大小 任一溶液的浓度大小
条件 一定温度 不定温度
状态 饱和状态 可饱和,可不饱和
单位 g 无单位
三、有关溶液的计算
饱和溶液溶质质量分数的计算
T℃时饱和溶液
的溶质质量分数 =
溶解度(g)
100 g+溶解度(g)
某温度下某物质的溶解度为a g,则同温下它的饱和溶液中溶质质量分数_____a%(填大于,小于或等于)
小于
×100%
三、有关溶液的计算
1. 计算所需溶质和溶剂的质量
例1. 在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
解:溶质质量=溶液质量×溶质的质量分数
= 150 kg×16% = 24 kg
溶剂质量 = 溶液质量 — 溶质质量
= 150 kg— 24 kg
=126 kg
答:需要24 kg氯化钠,126 kg的水。
三、有关溶液的计算
溶液稀释问题的计算
1.计算原理在溶液稀释与浓缩的过程中,溶质的质量不会发生变化。
2.溶液稀释的方法与计算公式
(1)加水稀释:A为浓溶液质量,a%为浓溶液溶质的质量分数;B为稀释后溶液质量,b%表示稀释后溶质质量分数;M水表示加入水的质量。
A·a%=B·b%或A·a%=(A+M水)·b%
(2)加入稀溶液稀释浓溶液:A为浓溶液质量,a%为浓溶液溶质的质量分数;B为稀溶液质量,b%表示稀溶液溶质质量分数;c%代表混合后所得溶液的溶质质量分数。
A·a%+B·b%=(A+B)·c%
三、有关溶液的计算
例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?
三、有关溶液的计算
解:设稀释后溶液的质量为x。因为溶液稀释前后溶质的质量不变,所以:
50 g×98%= x ×20%
x =
50 g×98%
20%
=245 g
需要水的质量为:245 g-50 g=195 g
答:稀释需要水的质量为195 g。
三、有关溶液的计算
例题3:现有100 g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
答:蒸发掉水的质量为50 g。
解:设蒸发掉水的质量为x。
x =50 g
100g×10%
= 20%
100g-x
×100%
三、有关溶液的计算
将溶质的质量分数运用于化学方程式的计算
【例题4】 100 g某硫酸溶液恰好与13 g锌完全反应,试计算这种硫酸中溶质的质量分数。
解:设这种硫酸中溶质的质量为x 。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13 g x
13 g x
65 98
x = 19.6 g
溶质的质量分数 = × 100% =19.6%
19.6 g
100 g
答:这种硫酸溶液中溶质的质量分数为19.6%。
三、有关溶液的计算
体积分数
体积分数也是一种表示溶液组成的方法。
白酒包装上面都标有“度数”,如53度(53°)的茅台酒。白酒的“度”实际上是白酒中酒精的含量,这里的含量不是质量分数,而是体积分数,即酒精和水的体积比为53:47。
品牌 53度茅台
卫生许可证 QS110015010349
净重 500(ml)
酒精含量 53(%)
生产厂家 贵州茅台股份有限公司
课堂练习
1.在10%的硫酸铜溶液中,溶质、溶剂、溶液的质量之比为( )
A.溶质:溶剂=1:10 B.溶质:溶液=1:10
C.溶剂:溶液=9:11 D.溶质:溶液=1:11
2. 20℃时,在 100 克食盐溶液中,加入 5 克食盐,加入食盐后的溶液中,质量一定不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶质、溶剂、溶液的质量
B
A
课堂练习
3.某温度时,蒸干40 g氯化钠溶液,得到8 g氯化钠,求该溶液中溶质的质量分数?
解:溶质质量分数
= ×100%
=20%
答:溶质质量分数为20%。
课堂练习
4.用400 g溶质质量分数为20%的氢氧化钠溶液,配制成溶质质量分数为10%的氢氧化钠溶液,需要加入水的质量为多少克?
解:需要加入水的质量为x。
400 g×20%=(400 g+ x )×10%
x =400 g
答:需要加入水的质量为400 g。
课堂小结
一、溶质的质量分数
1. 概念:溶质质量与溶液质量之比。
2. 计算公式:
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶质质量+溶剂质量
100%
t℃时,某物质的溶解度为S g,则t℃,该物质饱和溶液中
溶质的质量分数
S g
S g +100 g
100%
二、有关溶质质量分数的计算
布置作业
完成配套课后练习。
9.3 溶液的浓度
死海中含有高浓度的盐分,为一般海水的8.6倍,致使水中没有生物存活,甚至连死海沿岸的陆地上也很少有除水草外的生物。
死海中的盐浓度怎样定量表示呢?
学习目标
1. 进一步分辨溶液、溶质、溶剂,理解溶质的质量分数的含义。
2. 能进行溶质的质量分数的简单运算。
3. 掌握溶液的稀释计算。
一、溶液的浓度
三种浓稀不同的硫酸铜溶液
一、溶液的浓度
实验 9-7
在室温下,向三个小烧杯中各加入20 mL水,然后分别加入0.1 g、0.5 g、2 g无水硫酸铜,振荡,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色。在这三种溶液中,哪种最浓?哪种溶液最稀?你判断的依据是什么?
一、溶液的浓度
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
结论 对于有色溶液来说,__________________
浅蓝
蓝色
深蓝
20
20
20
0.1
0.5
2
20.1
20.5
22
颜色越深,浓度越大
对有颜色的溶液来说,可以根据颜色的深浅区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
一、溶液的浓度
溶液的浓与稀只能粗略地表明一定量的溶液里所含溶质的多少,但在实际应用中,常常要准确知道一定量溶液里含有溶质的质量。因此需要准确知道溶液的组成。那如何表明溶液的组成呢?
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木
二、溶质的的质量分数
溶质质量分数
概念:溶质质量和溶液质量的比值叫做溶质的质量分数。
公式:溶质的质量分数
溶质的质量
= —————— × 100﹪
溶液的质量
溶质的质量
= ——————————— ×100﹪
溶质的质量+溶剂的质量
含义:在100份质量的溶液里有多少份质量的溶质。
二、溶质的的质量分数
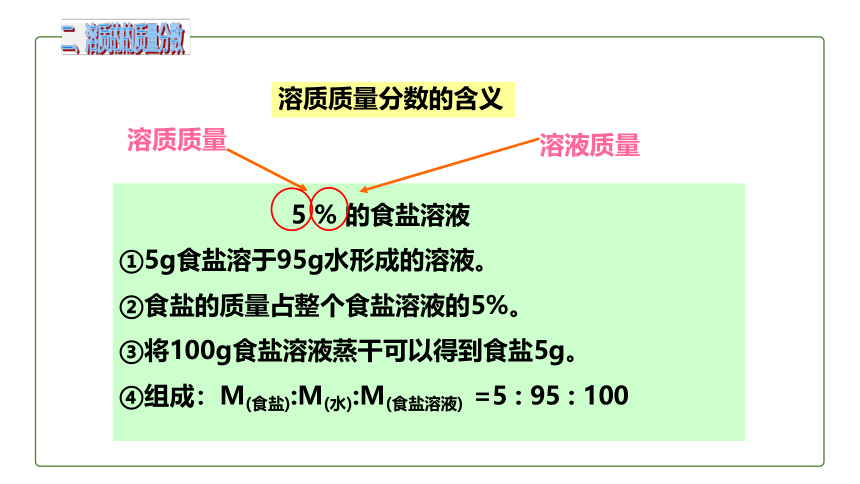
溶质质量分数的含义
5 % 的食盐溶液
①5g食盐溶于95g水形成的溶液。
②食盐的质量占整个食盐溶液的5%。
③将100g食盐溶液蒸干可以得到食盐5g。
④组成:M(食盐):M(水):M(食盐溶液) =5 : 95 : 100
溶质质量
溶液质量
二、溶质的的质量分数
溶质的质量分数
溶质质量
溶液质量
×100%
溶质的质量=
溶液的质量=
溶质的质量
溶质的质量分数
溶液的质量×溶质的质量分数
变形公式
二、溶质的的质量分数
按下表所定的量配制氯化钠溶液并计算
实验9-8
在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度可看做1 g/cm )。
溶质质量/g 溶剂(水)质量/g 现 象 溶液中溶质的质量分数
10 90
20 80
二、溶质的的质量分数
质量分数与溶解度的关系
已知20℃时,氯化钠的溶解度是36 g。有人说“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
温度 溶质的质量 溶剂的质量 溶液的质量
20℃
36 g
100 g
100 g+36 g
二、溶质的的质量分数
溶解度与溶质质量分数的比较
区别 溶解度 溶质的质量分数
概念 一定温度时,100 g溶剂中最多溶解溶质的质量 任意溶液中,溶质质量与溶液质量之比
表示意义 某物质溶解能力的大小 任一溶液的浓度大小
条件 一定温度 不定温度
状态 饱和状态 可饱和,可不饱和
单位 g 无单位
三、有关溶液的计算
饱和溶液溶质质量分数的计算
T℃时饱和溶液
的溶质质量分数 =
溶解度(g)
100 g+溶解度(g)
某温度下某物质的溶解度为a g,则同温下它的饱和溶液中溶质质量分数_____a%(填大于,小于或等于)
小于
×100%
三、有关溶液的计算
1. 计算所需溶质和溶剂的质量
例1. 在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
解:溶质质量=溶液质量×溶质的质量分数
= 150 kg×16% = 24 kg
溶剂质量 = 溶液质量 — 溶质质量
= 150 kg— 24 kg
=126 kg
答:需要24 kg氯化钠,126 kg的水。
三、有关溶液的计算
溶液稀释问题的计算
1.计算原理在溶液稀释与浓缩的过程中,溶质的质量不会发生变化。
2.溶液稀释的方法与计算公式
(1)加水稀释:A为浓溶液质量,a%为浓溶液溶质的质量分数;B为稀释后溶液质量,b%表示稀释后溶质质量分数;M水表示加入水的质量。
A·a%=B·b%或A·a%=(A+M水)·b%
(2)加入稀溶液稀释浓溶液:A为浓溶液质量,a%为浓溶液溶质的质量分数;B为稀溶液质量,b%表示稀溶液溶质质量分数;c%代表混合后所得溶液的溶质质量分数。
A·a%+B·b%=(A+B)·c%
三、有关溶液的计算
例题2:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液需要多少克水?
三、有关溶液的计算
解:设稀释后溶液的质量为x。因为溶液稀释前后溶质的质量不变,所以:
50 g×98%= x ×20%
x =
50 g×98%
20%
=245 g
需要水的质量为:245 g-50 g=195 g
答:稀释需要水的质量为195 g。
三、有关溶液的计算
例题3:现有100 g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
答:蒸发掉水的质量为50 g。
解:设蒸发掉水的质量为x。
x =50 g
100g×10%
= 20%
100g-x
×100%
三、有关溶液的计算
将溶质的质量分数运用于化学方程式的计算
【例题4】 100 g某硫酸溶液恰好与13 g锌完全反应,试计算这种硫酸中溶质的质量分数。
解:设这种硫酸中溶质的质量为x 。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13 g x
13 g x
65 98
x = 19.6 g
溶质的质量分数 = × 100% =19.6%
19.6 g
100 g
答:这种硫酸溶液中溶质的质量分数为19.6%。
三、有关溶液的计算
体积分数
体积分数也是一种表示溶液组成的方法。
白酒包装上面都标有“度数”,如53度(53°)的茅台酒。白酒的“度”实际上是白酒中酒精的含量,这里的含量不是质量分数,而是体积分数,即酒精和水的体积比为53:47。
品牌 53度茅台
卫生许可证 QS110015010349
净重 500(ml)
酒精含量 53(%)
生产厂家 贵州茅台股份有限公司
课堂练习
1.在10%的硫酸铜溶液中,溶质、溶剂、溶液的质量之比为( )
A.溶质:溶剂=1:10 B.溶质:溶液=1:10
C.溶剂:溶液=9:11 D.溶质:溶液=1:11
2. 20℃时,在 100 克食盐溶液中,加入 5 克食盐,加入食盐后的溶液中,质量一定不发生变化的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶质、溶剂、溶液的质量
B
A
课堂练习
3.某温度时,蒸干40 g氯化钠溶液,得到8 g氯化钠,求该溶液中溶质的质量分数?
解:溶质质量分数
= ×100%
=20%
答:溶质质量分数为20%。
课堂练习
4.用400 g溶质质量分数为20%的氢氧化钠溶液,配制成溶质质量分数为10%的氢氧化钠溶液,需要加入水的质量为多少克?
解:需要加入水的质量为x。
400 g×20%=(400 g+ x )×10%
x =400 g
答:需要加入水的质量为400 g。
课堂小结
一、溶质的质量分数
1. 概念:溶质质量与溶液质量之比。
2. 计算公式:
溶质的质量分数
溶质质量
溶液质量
100%
溶质质量
溶质质量+溶剂质量
100%
t℃时,某物质的溶解度为S g,则t℃,该物质饱和溶液中
溶质的质量分数
S g
S g +100 g
100%
二、有关溶质质量分数的计算
布置作业
完成配套课后练习。
同课章节目录
