专题6 第3单元 第1课时 化学能转化为电能 课件(共13张PPT)
文档属性
| 名称 | 专题6 第3单元 第1课时 化学能转化为电能 课件(共13张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 440.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 00:00:00 | ||
图片预览





文档简介
(共13张PPT)
第三单元 化学能与电能的转化
专题6 化学反应与能量变化
第1课时 化学能转化为电能
目
录
Contents
问题导学
举题说法
问题导学
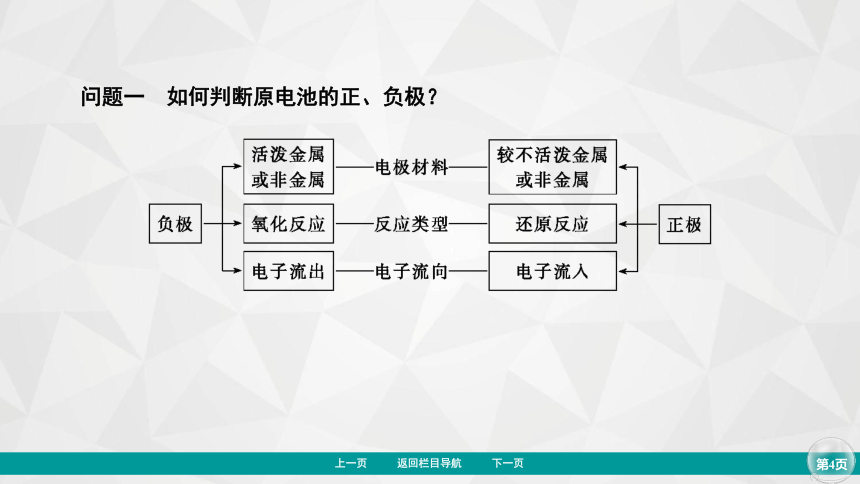
问题一 如何判断原电池的正、负极?
问题二 如何正确书写原电池的电极反应式?
问题三 钢铁在空气中是如何被腐蚀的?
1.电化学腐蚀:不纯的金属与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化。
2.钢铁在潮湿的空气中发生电化学腐蚀:
负极(铁):2Fe - 4e-===2Fe2+
正极(碳):2H2O+O2+4e-===4OH-
正、负极产物结合成Fe(OH)2,会进一步被O2氧化为Fe(OH)3。反应的化学方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
举题说法
某同学用如下图所示装置探究原电池的工作原理,并推出下列结论,其中错误的是 ( )
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中的H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4===ZnSO4+H2↑
【解析】 锌片作负极,发生反应Zn-2e-===Zn2+;铜片作正极,发生反应2H++2e-===H2↑。原电池是将化学能转化为电能的装置,该装置中发生的总反应是Zn+H2SO4===ZnSO4+H2↑。
1
C
原电池中的常见考点
(1) 能量转化方式:化学能转化为电能。
(2) 电子的流动方向:负极→外电路→正极。
(3) 电流的方向:正极→外电路→负极。
(4) 离子的移动方向:阳离子→正极;阴离子→负极。
(5) 电极反应的特征:负极上发生氧化反应;正极上发生还原反应。
下列各个装置中能组成原电池的是 ( )
【解析】 酒精溶液不能导电,故不能组成原电池,A项错误。两种金属没有活泼性差异,故不会产生电流,B项错误。没有形成闭合回路,不会产生电流,D项错误。
2
C
*选做强化题 物质中的化学能在一定条件下可转化为电能。
(1) 将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是_______________ ____________。
Zn+2H+===
Zn2++H2↑
(2) 将锌片、铜片按照右图所示装置连接,能证明化学能转化为电能的实验现象是铜片上有气泡产生、______________________。
(3) 稀硫酸在右图所示装置中的作用是传导离子、_______________。
电流计指针发生偏转
作为正极反应物
【解析】 (2) 原电池工作时,会产生电流,电流计指针也就会发生偏转。 (3) 正极的反应为2H++2e-===H2↑,硫酸作为正极反应物提供H+。(4) 原电池工作时,存在电子的定向转移,这就通常需要存在自发的氧化还原反应。
②③
第三单元 化学能与电能的转化
专题6 化学反应与能量变化
第1课时 化学能转化为电能
目
录
Contents
问题导学
举题说法
问题导学
问题一 如何判断原电池的正、负极?
问题二 如何正确书写原电池的电极反应式?
问题三 钢铁在空气中是如何被腐蚀的?
1.电化学腐蚀:不纯的金属与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化。
2.钢铁在潮湿的空气中发生电化学腐蚀:
负极(铁):2Fe - 4e-===2Fe2+
正极(碳):2H2O+O2+4e-===4OH-
正、负极产物结合成Fe(OH)2,会进一步被O2氧化为Fe(OH)3。反应的化学方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
举题说法
某同学用如下图所示装置探究原电池的工作原理,并推出下列结论,其中错误的是 ( )
A.锌片不断溶解,说明Zn失去电子
B.铜片上产生气泡,说明溶液中的H+在其表面得到电子
C.电流计指针发生偏转,说明该装置将电能转换为化学能
D.该装置中发生的总反应为Zn+H2SO4===ZnSO4+H2↑
【解析】 锌片作负极,发生反应Zn-2e-===Zn2+;铜片作正极,发生反应2H++2e-===H2↑。原电池是将化学能转化为电能的装置,该装置中发生的总反应是Zn+H2SO4===ZnSO4+H2↑。
1
C
原电池中的常见考点
(1) 能量转化方式:化学能转化为电能。
(2) 电子的流动方向:负极→外电路→正极。
(3) 电流的方向:正极→外电路→负极。
(4) 离子的移动方向:阳离子→正极;阴离子→负极。
(5) 电极反应的特征:负极上发生氧化反应;正极上发生还原反应。
下列各个装置中能组成原电池的是 ( )
【解析】 酒精溶液不能导电,故不能组成原电池,A项错误。两种金属没有活泼性差异,故不会产生电流,B项错误。没有形成闭合回路,不会产生电流,D项错误。
2
C
*选做强化题 物质中的化学能在一定条件下可转化为电能。
(1) 将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是_______________ ____________。
Zn+2H+===
Zn2++H2↑
(2) 将锌片、铜片按照右图所示装置连接,能证明化学能转化为电能的实验现象是铜片上有气泡产生、______________________。
(3) 稀硫酸在右图所示装置中的作用是传导离子、_______________。
电流计指针发生偏转
作为正极反应物
【解析】 (2) 原电池工作时,会产生电流,电流计指针也就会发生偏转。 (3) 正极的反应为2H++2e-===H2↑,硫酸作为正极反应物提供H+。(4) 原电池工作时,存在电子的定向转移,这就通常需要存在自发的氧化还原反应。
②③
