人教版九下9.3 溶液的浓度 作业(含解析)
文档属性
| 名称 | 人教版九下9.3 溶液的浓度 作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 134.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 22:37:13 | ||
图片预览


文档简介
9.3 溶液的浓度
一、选择题
1.从100克10%的氯化钠溶液中取出10克,则这10克溶液中溶质的质量分数是( )A.1% B.0.1% C.10% D.无法判断
2.将20 g溶质质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法错误的是( )
A.实验步骤:计算、量取、稀释、装瓶存放
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.溶液稀释:稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.事故处理:浓硫酸不慎沾到皮肤上,立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
3.盐湖地区人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl 和 Na2CO3。结合溶解度曲线判断,下列说法错误的是( )
A.NaCl 的溶解度随温度变化不大
B.44 ℃时 Na2CO3饱和溶液的质量分数50%
C.“夏天晒盐”的原理是让湖水蒸发结晶得到NaCl
D.“冬天捞碱”的原理是让湖水降温结晶得到Na2CO3
4.下列操作不会改变溶液的质量分数的有( )
A.对不饱和溶液蒸发溶剂
B.对硝酸钾溶液降温有晶体析出
C.对饱和硝酸钾溶液降温
D.对某固体物质的饱和溶液恒温蒸发溶剂
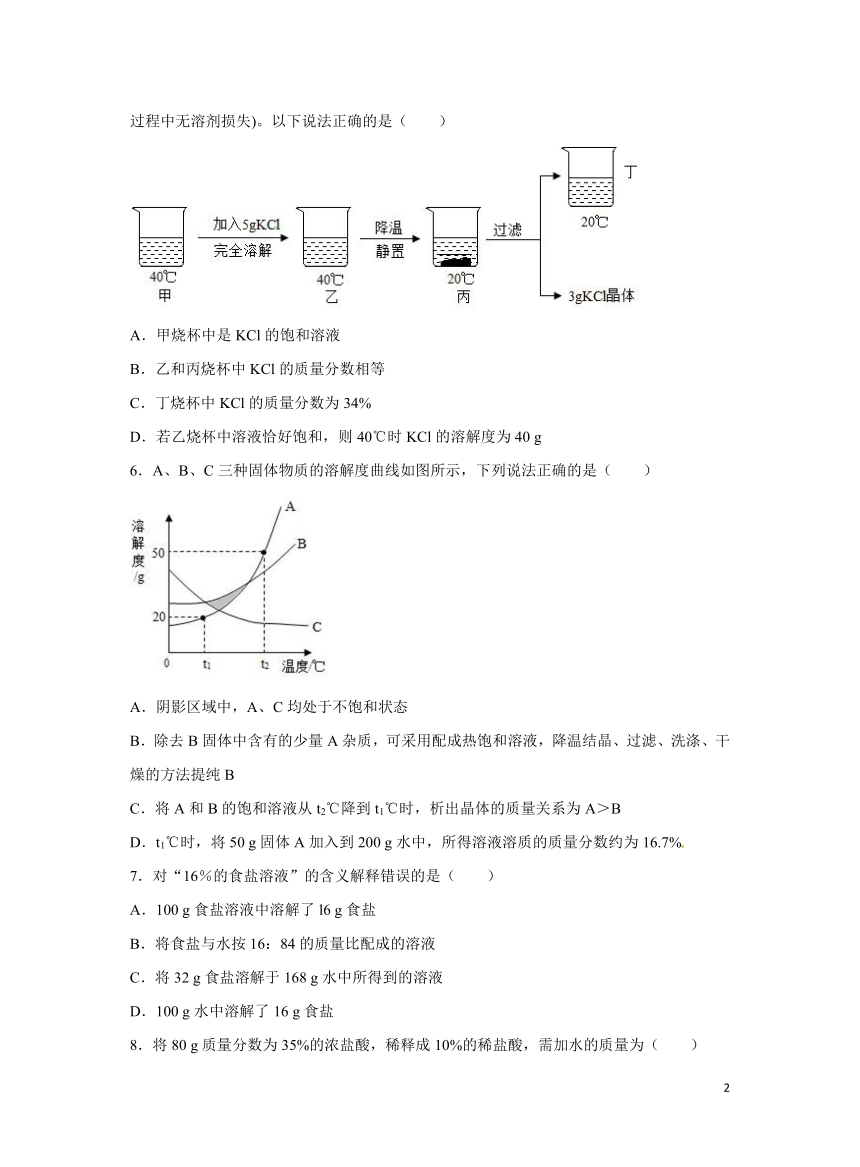
5.20℃时KCl的溶解度是34 g。取65 gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40 g
6.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50 g固体A加入到200 g水中,所得溶液溶质的质量分数约为16.7%
7.对“16%的食盐溶液”的含义解释错误的是( )
A.100 g食盐溶液中溶解了l6 g食盐
B.将食盐与水按16:84的质量比配成的溶液
C.将32 g食盐溶解于168 g水中所得到的溶液
D.100 g水中溶解了16 g食盐
8.将80 g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
A.80 g B.100 g C.200 g D.280 g
9.若要将10%的某物质的溶液中溶质的质量分数增大一倍,可以采用的方法是( )
A.将溶剂蒸发掉一半 B.将溶质的质量增加一倍
C.溶质和溶剂的质量减少一半 D.将溶剂蒸发掉原溶液质量的一半
10.压强为101 kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
二、综合题
11.用4 g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是______________g,这些酒精的体积为_______________mL(酒精的密度为0.8 g/mL)。
12.已知:20℃时硝酸钾的溶解度为31.6 g,则20℃时硝酸钾的饱和溶液中溶质的质量分数为 (结果精确到0.1%);20%的硫酸铜溶液中溶质与溶剂的质量比为 。
13.溶质的质量分数为15%的蔗糖溶液150 g。
(1)将溶质的质量分数降低到10%,应加水 ,最后所得溶液中溶质的质量为 。
(2)若使溶质的质量分数增加到30%,应加入 蔗糖(保留小数点后一位数)。
参考答案与解析
1.【答案】C
【解析】溶液具有均一性,故溶质质量分数不变,仍然是10%。
2.【答案】C
【解答】A.将20 g溶质质量分数为98%的浓硫酸稀释为25%的稀硫酸,采用的加水稀释的方法,其操作步骤是计算、量取、混匀(稀释)、装瓶存放,故选项说法正确;
B.实验步骤是计算、量取、稀释、装瓶存放,量筒和胶头滴管用于量取浓硫酸和水,烧杯、玻璃棒用于进行稀释操作,试剂瓶用于盛放稀硫酸,则实验仪器是量筒、胶头滴管、烧杯、玻璃棒、细口瓶,故选项说法正确;
C.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;切不可把水注入浓硫酸中,这是因为浓硫酸的密度比水大,如果添加顺序颠倒,那么水会浮在浓硫酸上,又由于浓硫酸溶于水放出大量的热,能使水沸腾,容易造成酸液飞溅,故选项说法错误;
D.浓硫酸具有较强的腐蚀性,不慎沾到皮肤上,应立即用大量水冲洗,后涂上3%~5%的碳酸氢钠溶液,故选项说法正确。
3.【答案】B
【解析】A.从溶解度曲线图知道,NaCl 的溶解度随温度变化不大,不符合题意;
B.44 ℃时,Na2CO3的溶解度是50 g,则此时饱和溶液的质量分数为: ,符合题意;
C.“夏天晒盐”的原理是让湖水蒸发结晶得到 NaCl,因为氯化钠的溶解度随温度的变化,影响不大,所以适合用蒸发结晶的方式,不符合题意;
D.“冬天捞碱”的原理是让湖水降温结晶得到 Na2CO3,碳酸钠的溶解度在40 ℃以下是随温度的降低,溶解度降低,因为冬天温度低,所以降低温度能够得到碳酸钠的晶体,不符合题意。故选B。
4.【答案】D
5.【答案】D
【解析】A.由于甲中加入5 g氯化钾完全溶解,说明甲烧杯中是氯化钾的不饱和溶液,故错误;
B.丙烧杯中有晶体析出,则乙和丙烧杯中KCl的质量分数不相等,故错误;
C.丁烧杯中KCl溶液是饱和溶液,其质量分数可用该温度下的溶解度进行计算,为,故错误;
D.65 gKCl溶液放入5 g氯化钾得到70 g溶液,丙过滤后得到饱和的丁和滤渣3 g,则丁烧杯中是67 g的氯化钾饱和溶液,由于20℃时KCl的溶解度是34 g,则表示该温度下100 g水中能溶解34 g氯化钾达到饱和,那么67 g的氯化钾饱和溶液中溶质为17 g,溶剂为50 g,则甲中溶质为15 g,乙中溶质为20 g,因此40℃时,100 g水中能溶解40 g氯化钾达到饱和,故正确。
6.【答案】D
【解析】A.阴影区域中,A、C均处于饱和状态,该选项说法不正确;
B.A溶解度受温度变化影响较大,B溶解度受温度变化影响较小,除去B固体中含有的少量A杂质,可采用蒸发结晶的方法提纯B,该选项说法不正确;
C.将A和B的饱和溶液从t2℃降到t1℃时,不能比较析出晶体的质量大小,是因为不知道饱和溶液的质量,该选项说法不正确;
D.t1℃时A溶解度是20 g,将50 g固体A加入到200 g水中,能够溶解40 g,所得溶液溶质的质量分数约为:×100%=16.7%,该选项说法正确。
故选D。
7.【答案】D
【解析】16%的含义是每100份溶液,有16份溶质,84份溶剂。D中是84 g水中溶解了16 g的食盐,而不是100 g水中,故选D。
8.【答案】C
【解析】设需要加水的质量为x;80 g×35%=(80 g+x)×10%;x=200 g。故选C。
9.【答案】D
10.【答案】C
【解析】A.由表中的数据可知,硝酸钾的溶解度均随温度升高而增大,氨气的溶解度均随温度升高而减小,故A错误;
B.20℃时,KNO3的溶解度是31.6 g,饱和溶液中溶质的质量分数为:≈24%,故B错误;
C.由于硝酸钾的溶解度随温度的升高而增大,所以60℃的KNO3饱和溶液降温至30℃,有晶体析出,故C正确;
D.NH3是气体,NH3的溶解度随压强增大而增大,故D错误。
二、综合题
11.【答案】(1)96 (2)120
【解析】设需要酒精质量为x,则 ,酒精体积: ,故填:96;120。
12.【答案】24.0%;1:4。
【解析】解:20℃时硝酸钾的溶解度为31.6 g,则20℃时硝酸钾的饱和溶液中溶质的质量分数为×100%≈24.0%。
20%的硫酸铜溶液的含义是每100份质量的硫酸铜溶液中,含义20份质量的硫酸铜,20%的硫酸铜溶液中溶质与溶剂的质量比为20%:(1﹣20%)=1:4。
13.【答案】(1)75 g; 22.5 g; (2)32.1 g。
【解析】解:(1)设应加水x g,可得:15%×150 g=(150 g+x g)×10%,
解得:x=75,
答:应加水75 g,
所得溶液中溶质的质量为:15%×150 g=22.5 g,
(2)设应加入y g蔗糖,可得:15%×150 g+yg=(150 g+y g)×30%,
解得:y≈32.1
1
一、选择题
1.从100克10%的氯化钠溶液中取出10克,则这10克溶液中溶质的质量分数是( )A.1% B.0.1% C.10% D.无法判断
2.将20 g溶质质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法错误的是( )
A.实验步骤:计算、量取、稀释、装瓶存放
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.溶液稀释:稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.事故处理:浓硫酸不慎沾到皮肤上,立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
3.盐湖地区人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl 和 Na2CO3。结合溶解度曲线判断,下列说法错误的是( )
A.NaCl 的溶解度随温度变化不大
B.44 ℃时 Na2CO3饱和溶液的质量分数50%
C.“夏天晒盐”的原理是让湖水蒸发结晶得到NaCl
D.“冬天捞碱”的原理是让湖水降温结晶得到Na2CO3
4.下列操作不会改变溶液的质量分数的有( )
A.对不饱和溶液蒸发溶剂
B.对硝酸钾溶液降温有晶体析出
C.对饱和硝酸钾溶液降温
D.对某固体物质的饱和溶液恒温蒸发溶剂
5.20℃时KCl的溶解度是34 g。取65 gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40 g
6.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.阴影区域中,A、C均处于不饱和状态
B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯B
C.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>B
D.t1℃时,将50 g固体A加入到200 g水中,所得溶液溶质的质量分数约为16.7%
7.对“16%的食盐溶液”的含义解释错误的是( )
A.100 g食盐溶液中溶解了l6 g食盐
B.将食盐与水按16:84的质量比配成的溶液
C.将32 g食盐溶解于168 g水中所得到的溶液
D.100 g水中溶解了16 g食盐
8.将80 g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
A.80 g B.100 g C.200 g D.280 g
9.若要将10%的某物质的溶液中溶质的质量分数增大一倍,可以采用的方法是( )
A.将溶剂蒸发掉一半 B.将溶质的质量增加一倍
C.溶质和溶剂的质量减少一半 D.将溶剂蒸发掉原溶液质量的一半
10.压强为101 kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是( )
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
二、综合题
11.用4 g酚酞与酒精配制溶质质量分数为4%的酚酞溶液,需要酒精的质量是______________g,这些酒精的体积为_______________mL(酒精的密度为0.8 g/mL)。
12.已知:20℃时硝酸钾的溶解度为31.6 g,则20℃时硝酸钾的饱和溶液中溶质的质量分数为 (结果精确到0.1%);20%的硫酸铜溶液中溶质与溶剂的质量比为 。
13.溶质的质量分数为15%的蔗糖溶液150 g。
(1)将溶质的质量分数降低到10%,应加水 ,最后所得溶液中溶质的质量为 。
(2)若使溶质的质量分数增加到30%,应加入 蔗糖(保留小数点后一位数)。
参考答案与解析
1.【答案】C
【解析】溶液具有均一性,故溶质质量分数不变,仍然是10%。
2.【答案】C
【解答】A.将20 g溶质质量分数为98%的浓硫酸稀释为25%的稀硫酸,采用的加水稀释的方法,其操作步骤是计算、量取、混匀(稀释)、装瓶存放,故选项说法正确;
B.实验步骤是计算、量取、稀释、装瓶存放,量筒和胶头滴管用于量取浓硫酸和水,烧杯、玻璃棒用于进行稀释操作,试剂瓶用于盛放稀硫酸,则实验仪器是量筒、胶头滴管、烧杯、玻璃棒、细口瓶,故选项说法正确;
C.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;切不可把水注入浓硫酸中,这是因为浓硫酸的密度比水大,如果添加顺序颠倒,那么水会浮在浓硫酸上,又由于浓硫酸溶于水放出大量的热,能使水沸腾,容易造成酸液飞溅,故选项说法错误;
D.浓硫酸具有较强的腐蚀性,不慎沾到皮肤上,应立即用大量水冲洗,后涂上3%~5%的碳酸氢钠溶液,故选项说法正确。
3.【答案】B
【解析】A.从溶解度曲线图知道,NaCl 的溶解度随温度变化不大,不符合题意;
B.44 ℃时,Na2CO3的溶解度是50 g,则此时饱和溶液的质量分数为: ,符合题意;
C.“夏天晒盐”的原理是让湖水蒸发结晶得到 NaCl,因为氯化钠的溶解度随温度的变化,影响不大,所以适合用蒸发结晶的方式,不符合题意;
D.“冬天捞碱”的原理是让湖水降温结晶得到 Na2CO3,碳酸钠的溶解度在40 ℃以下是随温度的降低,溶解度降低,因为冬天温度低,所以降低温度能够得到碳酸钠的晶体,不符合题意。故选B。
4.【答案】D
5.【答案】D
【解析】A.由于甲中加入5 g氯化钾完全溶解,说明甲烧杯中是氯化钾的不饱和溶液,故错误;
B.丙烧杯中有晶体析出,则乙和丙烧杯中KCl的质量分数不相等,故错误;
C.丁烧杯中KCl溶液是饱和溶液,其质量分数可用该温度下的溶解度进行计算,为,故错误;
D.65 gKCl溶液放入5 g氯化钾得到70 g溶液,丙过滤后得到饱和的丁和滤渣3 g,则丁烧杯中是67 g的氯化钾饱和溶液,由于20℃时KCl的溶解度是34 g,则表示该温度下100 g水中能溶解34 g氯化钾达到饱和,那么67 g的氯化钾饱和溶液中溶质为17 g,溶剂为50 g,则甲中溶质为15 g,乙中溶质为20 g,因此40℃时,100 g水中能溶解40 g氯化钾达到饱和,故正确。
6.【答案】D
【解析】A.阴影区域中,A、C均处于饱和状态,该选项说法不正确;
B.A溶解度受温度变化影响较大,B溶解度受温度变化影响较小,除去B固体中含有的少量A杂质,可采用蒸发结晶的方法提纯B,该选项说法不正确;
C.将A和B的饱和溶液从t2℃降到t1℃时,不能比较析出晶体的质量大小,是因为不知道饱和溶液的质量,该选项说法不正确;
D.t1℃时A溶解度是20 g,将50 g固体A加入到200 g水中,能够溶解40 g,所得溶液溶质的质量分数约为:×100%=16.7%,该选项说法正确。
故选D。
7.【答案】D
【解析】16%的含义是每100份溶液,有16份溶质,84份溶剂。D中是84 g水中溶解了16 g的食盐,而不是100 g水中,故选D。
8.【答案】C
【解析】设需要加水的质量为x;80 g×35%=(80 g+x)×10%;x=200 g。故选C。
9.【答案】D
10.【答案】C
【解析】A.由表中的数据可知,硝酸钾的溶解度均随温度升高而增大,氨气的溶解度均随温度升高而减小,故A错误;
B.20℃时,KNO3的溶解度是31.6 g,饱和溶液中溶质的质量分数为:≈24%,故B错误;
C.由于硝酸钾的溶解度随温度的升高而增大,所以60℃的KNO3饱和溶液降温至30℃,有晶体析出,故C正确;
D.NH3是气体,NH3的溶解度随压强增大而增大,故D错误。
二、综合题
11.【答案】(1)96 (2)120
【解析】设需要酒精质量为x,则 ,酒精体积: ,故填:96;120。
12.【答案】24.0%;1:4。
【解析】解:20℃时硝酸钾的溶解度为31.6 g,则20℃时硝酸钾的饱和溶液中溶质的质量分数为×100%≈24.0%。
20%的硫酸铜溶液的含义是每100份质量的硫酸铜溶液中,含义20份质量的硫酸铜,20%的硫酸铜溶液中溶质与溶剂的质量比为20%:(1﹣20%)=1:4。
13.【答案】(1)75 g; 22.5 g; (2)32.1 g。
【解析】解:(1)设应加水x g,可得:15%×150 g=(150 g+x g)×10%,
解得:x=75,
答:应加水75 g,
所得溶液中溶质的质量为:15%×150 g=22.5 g,
(2)设应加入y g蔗糖,可得:15%×150 g+yg=(150 g+y g)×30%,
解得:y≈32.1
1
同课章节目录
