人教版九下10.1 常见的酸和碱(第2课时) 作业(含解析)
文档属性
| 名称 | 人教版九下10.1 常见的酸和碱(第2课时) 作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 246.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 22:39:01 | ||
图片预览



文档简介
10.1 常见的酸和碱(第2课时)
一、选择题
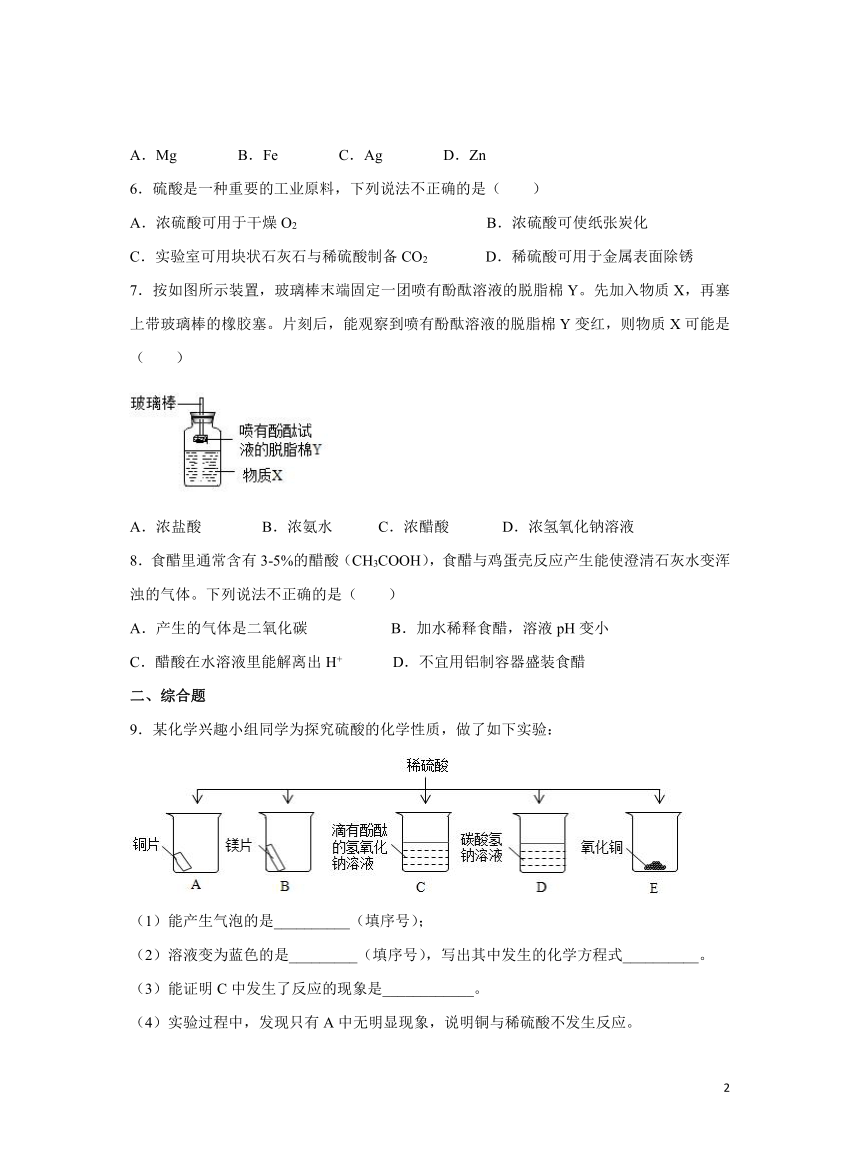
1.(2021年浙江省台州市)盐酸在生产和生活中的用途很广,能与多种物质发生反应。下列物质与盐酸反应时,能观察到白色沉淀的是( )
A. B.
C. D.
2.关于硫酸的说法错误的是( )
A.稀硫酸与锌反应可制得氢气 B.稀硫酸可用于除铁锈
C.可将水注入浓硫酸中进行稀释 D.浓硫酸可用来干燥氢气
3.以下物质中可由金属与酸直接反应制得的是( )
A.FeCl3 B.MgSO4 C.AgCl D.CuCl2
4.下列有关酸的说法中,正确的是( )
A.酸的组成中一定含有氢元素
B.能够导电的溶液是酸
C.滴加无色酚酞不变色的溶液是酸
D.能与碱发生反应的物质是酸
5.如图是包含物质a、b、c、d和盐酸卡片的“化学拼图”相邻两张卡片所标的物质(或其溶液)间能发生化学反应。单质a不可能是( )
A.Mg B.Fe C.Ag D.Zn
6.硫酸是一种重要的工业原料,下列说法不正确的是( )
A.浓硫酸可用于干燥O2 B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备CO2 D.稀硫酸可用于金属表面除锈
7.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
8.食醋里通常含有3-5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法不正确的是( )
A.产生的气体是二氧化碳 B.加水稀释食醋,溶液pH变小
C.醋酸在水溶液里能解离出H+ D.不宜用铝制容器盛装食醋
二、综合题
9.某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验:
(1)能产生气泡的是__________(填序号);
(2)溶液变为蓝色的是_________(填序号),写出其中发生的化学方程式__________。
(3)能证明C中发生了反应的现象是____________。
(4)实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。
【提出问题】铜与硫酸真的不能反应吗?
【查阅资料】
①铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;
②SO2能使品红溶液褪色;
③SO2能与碱溶液反应;
④SO2能溶于水,但不溶于饱和NaHSO3溶液
【进行实验】
同学们在老师的帮助下用如图所示装置进行实验:
请回答下列问题:
(5)实验开始时,打开开关K,发现D中品红溶液褪色,装置D中试管口放置的棉花上浸有浓氢氧化钠溶液,其作用是__________。
(6)装置B的作用是收集贮存多余的气体,当D中有明显现象后,关闭K,移去酒精灯,但由于余热的作用,A有仍有气体产生,此时B中现象是:长颈漏斗内液面________(填“上升”或“下降”),则B中盛放的液体为_______(填序号)
A.水 B.氢氧化钠溶液 C.饱和石灰水 D.饱和NaHSO3溶液
10.【2021湖南长沙】为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】
实验一:按如图1所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3克Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊溶液变 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因 。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞) (用化学式表示)。
(4)请计算,实验四中理论上可以生成二氧化碳的质量为 克。
(可能用到的相对原子质量:H﹣1 C﹣12 O﹣16 Na﹣23 Cl﹣35.5)
【应用与拓展】
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜 。
(6)小明在征得老师的同意后,继续进行了如图2所示实验。
由上述实验可以得出氢氧化钙的哪些性质 。
参考答案与解析
一、选择题
1.【答案】C
【解析】A.稀盐酸显酸性,所以实验现象为紫色石蕊溶液变红色,故不选A项;
B.铁锈即为氧化铁,稀盐酸和氧化铁反应生成氯化铁和水,实验现象为铁锈溶解,溶液逐渐变黄,故不选B项;
C.稀盐酸和AgNO3溶液反应会生成AgCl,AgCl为白色沉淀,故选C项;
D.稀盐酸和NaOH溶液反应生成氯化钠和水,实验无明显现象,故不选D项。
综上所述,本题正确答案为C。
2.【答案】C
【解析】实验室用稀硫酸与锌反应可制得氢气;氧化铁能与稀硫酸反应生成能溶于水的硫酸铁和水,稀硫酸可用于除铁锈;稀释浓硫酸时不能把水直接注入浓硫酸中,防止局部产生沸腾;浓硫酸具有吸水性,且不与氢气反应,可用来干燥氢气。故选C。
3.【答案】B
【解析】金属与酸反应,金属必须是活泼金属。银是不活泼金属,故银不能直接和盐酸反应生成AgCl,故C选项不正确;金属铁与盐酸反应显+2价,故FeCl3不是由铁与盐酸反应直接生成的;铜是不活泼金属不能直接和酸反应生成CuCl2。故答案为B。
4.【答案】A
【解析】A.电离时,产生的阳离子全部是氢离子的化合物属于酸,所以酸中一定含有氢元素,故正确;
B.酸、碱、盐的水溶液都具有导电性,能导电的不一定是酸,故错误;
C.酸性溶液与中性溶液均不能使无色酚酞试液变色,故错误;
D.部分非金属氧化物也能与碱反应,如二氧化碳与氢氧化钠反应生成碳酸钠和水,故错误。
5.【答案】C
【解析】从图上可知a是能与盐酸反应的金属单质,所以必须是在金属活动性顺序表氢前的金属,而银在氢后,则不能与盐酸反应,故选C。
6.【答案】C
【解析】A.浓硫酸有吸水性,常作某些气体的干燥剂,可用于干燥O2,选项正确;
B.浓硫酸有脱水性,可将某些有机物中的氧、氢元素以原子个数比1:2(水)的形式脱出来,称为“炭化”,故可使纸张炭化,选项正确;
C.实验室不可用块状石灰石与稀硫酸制备CO2,因硫酸和碳酸钙反应生成的硫酸钙微溶于水,附着在石灰石的表面,会使反应逐渐停止,选项错误;
D.稀硫酸可用于金属表面除锈,因铁锈的主要成分是氧化铁,能和硫酸反应生成硫酸铁和水,选项正确。
7.【答案】B
【解析】A.浓盐酸具有挥发性,挥发出的氯化氢气体与Y中的水结合成盐酸,盐酸显酸性,不能使喷有酚酞溶液的脱脂棉Y变红,不符合题意;
B.浓氨水具有挥发性,挥发出的氨气与Y中的水结合成氨水,氨水显碱性,能使喷有酚酞溶液的脱脂棉Y变红,符合题意;
C.浓醋酸具有挥发性,但是醋酸显酸性,不能使喷有酚酞溶液的脱脂棉Y变红,不符合题意;
D.氢氧化钠显碱性,能使无色酚酞试液变红,但是浓氢氧化钠不具有挥发性,不能使喷有酚酞溶液的脱脂棉Y变红,不符合题意。
8.【答案】B
【解析】鸡蛋壳的主要成分是碳酸钙,碳酸钙与醋酸反应生成醋酸钙、水和二氧化碳;加水稀释食醋,溶液的酸性减弱,溶液pH变大;电离时产生的阳离子全部是氢离子的化合物属于酸,醋酸属于酸,在水溶液里能解离出H+;铝是活泼金属,能与醋酸反应生成醋酸铝和氢气,不宜用铝制容器盛装食醋。故选B。
二、综合题
9. 【答案】(1)BD;(2)E;(3);(4)酚酞试液由红色变为无色;(5)吸收二氧化硫,防止污染空气;(6)上升;(7)D
【解析】(1)镁可以与稀硫酸反应有氢气生成,碳酸氢钠可以与稀硫酸反应生成二氧化碳气体,铜不能与稀硫酸反应,氢氧化钠、氧化铜可以与稀硫酸反应,但没有气体生成,故填:BD。
(2)氧化铜可以与稀硫酸反应生成硫酸铜,溶液显蓝色,反应的方程式为:,故填:E;。
(3)烧杯C中氢氧化钠显与酚酞反应,溶液变为红色,当加入稀硫酸后,稀硫酸与氢氧化钠反应,当氢氧化钠反应完后,溶液由红色变为无色,故填:酚酞试液由红色变为无色。
【进行实验】(5)二氧化硫能导致空气污染,故在D装置中的试管口放一团浸有浓氢氧化钠的棉花,吸收二氧化硫气体,故填:吸收二氧化硫,防止污染空气。
(6)当A中因余热继续反应,K关闭后,B中二氧化硫气体含量增加,内压增加,故长颈漏斗内的液面将上升;水、氢氧化钠溶液、饱和石灰水都可以与二氧化硫反应,不能用于收集二氧化硫气体,而饱和NaHSO3溶液不与二氧化硫反应,也不溶解二氧化硫气体,故选:D。
10. 【答案】(1)红。(2)氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完毕后,内部未生锈的铁与盐酸反应生成氢气,看到气泡产生。(3)NaCl或NaCl和HCl。(4)2.2。(5)混合固体加入足量盐酸,然后过滤、洗涤、干燥固体,得到纯净的铜。
(6)氢氧化钙溶于水,形成的溶液显碱性,遇到酚酞显红色,可与盐酸反应。
【解析】解:(1)盐酸为酸性溶液,遇到紫色石蕊溶液变红;
故答案为:红。
(2)生锈的铁钉包括氧化铁和铁,氧化铁先与盐酸接触反应生成了氯化铁,溶液显黄色,然后内部铁与盐酸反应生成了氢气,看到了气泡产生;
故答案为:氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完毕后,内部未生锈的铁与盐酸反应生成氢气,看到气泡产生。
(3)此时盐酸与氢氧化钠反应生成氯化钠和水,溶液变为无色,说明不再显碱性,因此溶质没有氢氧化钠,若只有氯化钠,则溶液显中性,若盐酸有剩余,则溶液显无色,都不会出现红色,所以溶质可能是只有氯化钠,也可以是氯化钠和氯化氢的混合物;
故答案为:NaCl或NaCl和HCl。
(4)设二氧化碳的质量为m,5.3 g×,m=2.2 g;
故答案为:2.2。
(5)铜不溶于酸,而氧化铜可与酸反应,因此可以将混合物加入足量盐酸,经过过滤、洗涤和干燥后得到纯铜;
故答案为:混合固体加入足量盐酸,然后过滤、洗涤、干燥固体,得到纯净的铜。
(6)加水后得固体溶液,说明氢氧化钙能溶于水,加入酚酞溶液变红,说明氢氧化钙溶液显碱性,遇到酚酞会变红,加入盐酸后红色消失,说明氢氧化钙可与盐酸反应;
故答案为:氢氧化钙溶于水,形成的溶液显碱性,遇到酚酞显红色,可与盐酸反应。
1
一、选择题
1.(2021年浙江省台州市)盐酸在生产和生活中的用途很广,能与多种物质发生反应。下列物质与盐酸反应时,能观察到白色沉淀的是( )
A. B.
C. D.
2.关于硫酸的说法错误的是( )
A.稀硫酸与锌反应可制得氢气 B.稀硫酸可用于除铁锈
C.可将水注入浓硫酸中进行稀释 D.浓硫酸可用来干燥氢气
3.以下物质中可由金属与酸直接反应制得的是( )
A.FeCl3 B.MgSO4 C.AgCl D.CuCl2
4.下列有关酸的说法中,正确的是( )
A.酸的组成中一定含有氢元素
B.能够导电的溶液是酸
C.滴加无色酚酞不变色的溶液是酸
D.能与碱发生反应的物质是酸
5.如图是包含物质a、b、c、d和盐酸卡片的“化学拼图”相邻两张卡片所标的物质(或其溶液)间能发生化学反应。单质a不可能是( )
A.Mg B.Fe C.Ag D.Zn
6.硫酸是一种重要的工业原料,下列说法不正确的是( )
A.浓硫酸可用于干燥O2 B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备CO2 D.稀硫酸可用于金属表面除锈
7.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是( )
A.浓盐酸 B.浓氨水 C.浓醋酸 D.浓氢氧化钠溶液
8.食醋里通常含有3-5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列说法不正确的是( )
A.产生的气体是二氧化碳 B.加水稀释食醋,溶液pH变小
C.醋酸在水溶液里能解离出H+ D.不宜用铝制容器盛装食醋
二、综合题
9.某化学兴趣小组同学为探究硫酸的化学性质,做了如下实验:
(1)能产生气泡的是__________(填序号);
(2)溶液变为蓝色的是_________(填序号),写出其中发生的化学方程式__________。
(3)能证明C中发生了反应的现象是____________。
(4)实验过程中,发现只有A中无明显现象,说明铜与稀硫酸不发生反应。
【提出问题】铜与硫酸真的不能反应吗?
【查阅资料】
①铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;
②SO2能使品红溶液褪色;
③SO2能与碱溶液反应;
④SO2能溶于水,但不溶于饱和NaHSO3溶液
【进行实验】
同学们在老师的帮助下用如图所示装置进行实验:
请回答下列问题:
(5)实验开始时,打开开关K,发现D中品红溶液褪色,装置D中试管口放置的棉花上浸有浓氢氧化钠溶液,其作用是__________。
(6)装置B的作用是收集贮存多余的气体,当D中有明显现象后,关闭K,移去酒精灯,但由于余热的作用,A有仍有气体产生,此时B中现象是:长颈漏斗内液面________(填“上升”或“下降”),则B中盛放的液体为_______(填序号)
A.水 B.氢氧化钠溶液 C.饱和石灰水 D.饱和NaHSO3溶液
10.【2021湖南长沙】为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】
实验一:按如图1所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3克Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊溶液变 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因 。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞) (用化学式表示)。
(4)请计算,实验四中理论上可以生成二氧化碳的质量为 克。
(可能用到的相对原子质量:H﹣1 C﹣12 O﹣16 Na﹣23 Cl﹣35.5)
【应用与拓展】
(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜 。
(6)小明在征得老师的同意后,继续进行了如图2所示实验。
由上述实验可以得出氢氧化钙的哪些性质 。
参考答案与解析
一、选择题
1.【答案】C
【解析】A.稀盐酸显酸性,所以实验现象为紫色石蕊溶液变红色,故不选A项;
B.铁锈即为氧化铁,稀盐酸和氧化铁反应生成氯化铁和水,实验现象为铁锈溶解,溶液逐渐变黄,故不选B项;
C.稀盐酸和AgNO3溶液反应会生成AgCl,AgCl为白色沉淀,故选C项;
D.稀盐酸和NaOH溶液反应生成氯化钠和水,实验无明显现象,故不选D项。
综上所述,本题正确答案为C。
2.【答案】C
【解析】实验室用稀硫酸与锌反应可制得氢气;氧化铁能与稀硫酸反应生成能溶于水的硫酸铁和水,稀硫酸可用于除铁锈;稀释浓硫酸时不能把水直接注入浓硫酸中,防止局部产生沸腾;浓硫酸具有吸水性,且不与氢气反应,可用来干燥氢气。故选C。
3.【答案】B
【解析】金属与酸反应,金属必须是活泼金属。银是不活泼金属,故银不能直接和盐酸反应生成AgCl,故C选项不正确;金属铁与盐酸反应显+2价,故FeCl3不是由铁与盐酸反应直接生成的;铜是不活泼金属不能直接和酸反应生成CuCl2。故答案为B。
4.【答案】A
【解析】A.电离时,产生的阳离子全部是氢离子的化合物属于酸,所以酸中一定含有氢元素,故正确;
B.酸、碱、盐的水溶液都具有导电性,能导电的不一定是酸,故错误;
C.酸性溶液与中性溶液均不能使无色酚酞试液变色,故错误;
D.部分非金属氧化物也能与碱反应,如二氧化碳与氢氧化钠反应生成碳酸钠和水,故错误。
5.【答案】C
【解析】从图上可知a是能与盐酸反应的金属单质,所以必须是在金属活动性顺序表氢前的金属,而银在氢后,则不能与盐酸反应,故选C。
6.【答案】C
【解析】A.浓硫酸有吸水性,常作某些气体的干燥剂,可用于干燥O2,选项正确;
B.浓硫酸有脱水性,可将某些有机物中的氧、氢元素以原子个数比1:2(水)的形式脱出来,称为“炭化”,故可使纸张炭化,选项正确;
C.实验室不可用块状石灰石与稀硫酸制备CO2,因硫酸和碳酸钙反应生成的硫酸钙微溶于水,附着在石灰石的表面,会使反应逐渐停止,选项错误;
D.稀硫酸可用于金属表面除锈,因铁锈的主要成分是氧化铁,能和硫酸反应生成硫酸铁和水,选项正确。
7.【答案】B
【解析】A.浓盐酸具有挥发性,挥发出的氯化氢气体与Y中的水结合成盐酸,盐酸显酸性,不能使喷有酚酞溶液的脱脂棉Y变红,不符合题意;
B.浓氨水具有挥发性,挥发出的氨气与Y中的水结合成氨水,氨水显碱性,能使喷有酚酞溶液的脱脂棉Y变红,符合题意;
C.浓醋酸具有挥发性,但是醋酸显酸性,不能使喷有酚酞溶液的脱脂棉Y变红,不符合题意;
D.氢氧化钠显碱性,能使无色酚酞试液变红,但是浓氢氧化钠不具有挥发性,不能使喷有酚酞溶液的脱脂棉Y变红,不符合题意。
8.【答案】B
【解析】鸡蛋壳的主要成分是碳酸钙,碳酸钙与醋酸反应生成醋酸钙、水和二氧化碳;加水稀释食醋,溶液的酸性减弱,溶液pH变大;电离时产生的阳离子全部是氢离子的化合物属于酸,醋酸属于酸,在水溶液里能解离出H+;铝是活泼金属,能与醋酸反应生成醋酸铝和氢气,不宜用铝制容器盛装食醋。故选B。
二、综合题
9. 【答案】(1)BD;(2)E;(3);(4)酚酞试液由红色变为无色;(5)吸收二氧化硫,防止污染空气;(6)上升;(7)D
【解析】(1)镁可以与稀硫酸反应有氢气生成,碳酸氢钠可以与稀硫酸反应生成二氧化碳气体,铜不能与稀硫酸反应,氢氧化钠、氧化铜可以与稀硫酸反应,但没有气体生成,故填:BD。
(2)氧化铜可以与稀硫酸反应生成硫酸铜,溶液显蓝色,反应的方程式为:,故填:E;。
(3)烧杯C中氢氧化钠显与酚酞反应,溶液变为红色,当加入稀硫酸后,稀硫酸与氢氧化钠反应,当氢氧化钠反应完后,溶液由红色变为无色,故填:酚酞试液由红色变为无色。
【进行实验】(5)二氧化硫能导致空气污染,故在D装置中的试管口放一团浸有浓氢氧化钠的棉花,吸收二氧化硫气体,故填:吸收二氧化硫,防止污染空气。
(6)当A中因余热继续反应,K关闭后,B中二氧化硫气体含量增加,内压增加,故长颈漏斗内的液面将上升;水、氢氧化钠溶液、饱和石灰水都可以与二氧化硫反应,不能用于收集二氧化硫气体,而饱和NaHSO3溶液不与二氧化硫反应,也不溶解二氧化硫气体,故选:D。
10. 【答案】(1)红。(2)氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完毕后,内部未生锈的铁与盐酸反应生成氢气,看到气泡产生。(3)NaCl或NaCl和HCl。(4)2.2。(5)混合固体加入足量盐酸,然后过滤、洗涤、干燥固体,得到纯净的铜。
(6)氢氧化钙溶于水,形成的溶液显碱性,遇到酚酞显红色,可与盐酸反应。
【解析】解:(1)盐酸为酸性溶液,遇到紫色石蕊溶液变红;
故答案为:红。
(2)生锈的铁钉包括氧化铁和铁,氧化铁先与盐酸接触反应生成了氯化铁,溶液显黄色,然后内部铁与盐酸反应生成了氢气,看到了气泡产生;
故答案为:氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完毕后,内部未生锈的铁与盐酸反应生成氢气,看到气泡产生。
(3)此时盐酸与氢氧化钠反应生成氯化钠和水,溶液变为无色,说明不再显碱性,因此溶质没有氢氧化钠,若只有氯化钠,则溶液显中性,若盐酸有剩余,则溶液显无色,都不会出现红色,所以溶质可能是只有氯化钠,也可以是氯化钠和氯化氢的混合物;
故答案为:NaCl或NaCl和HCl。
(4)设二氧化碳的质量为m,5.3 g×,m=2.2 g;
故答案为:2.2。
(5)铜不溶于酸,而氧化铜可与酸反应,因此可以将混合物加入足量盐酸,经过过滤、洗涤和干燥后得到纯铜;
故答案为:混合固体加入足量盐酸,然后过滤、洗涤、干燥固体,得到纯净的铜。
(6)加水后得固体溶液,说明氢氧化钙能溶于水,加入酚酞溶液变红,说明氢氧化钙溶液显碱性,遇到酚酞会变红,加入盐酸后红色消失,说明氢氧化钙可与盐酸反应;
故答案为:氢氧化钙溶于水,形成的溶液显碱性,遇到酚酞显红色,可与盐酸反应。
1
同课章节目录
