人教版九下8.2 金属的化学性质 作业(含解析)
文档属性
| 名称 | 人教版九下8.2 金属的化学性质 作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 166.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 22:54:30 | ||
图片预览



文档简介
8.2 金属的化学性质
一、选择题
1. 【2021湖南长沙】金属活动性顺序在工农业生产和科学研究中有重要作用。下列金属中活动性最强的是( )
A.镁(Mg) B.铝(Al) C.铁(Fe) D.铜(Cu)
2.铝抗腐蚀能力强的原因是( )
A.硬度、密度都较小 B.化学性质不活泼
C.常温下不与氧气反应 D.表面易形成致密的氧化膜
3.已知A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应;相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.D>C>A>B B.A>B>C>D C.B>A>C>D D.D>C>B>A
4.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
5.一定质量M、N两种金属,分别与相同且等量的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示。分析图象得到的以下结论中,不正确的是( )
A.两种金属的活动性:M>N
B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N
D.充分反应后,得到溶液的质量:M=N
6.已知金属M与硫酸铜溶液反应的化学反应方程式:则下列说法错误的是( )
A.M的金属活动性比Cu强 B.该反应属于置换反应
C.金属M可能是铝 D.该反应前后M的化合价发生了改变
7.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
8.向5.6 g含两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含杂质可能是( )
A.锌和铜 B.锌和镁 C.铝和镁 D.碳和铜
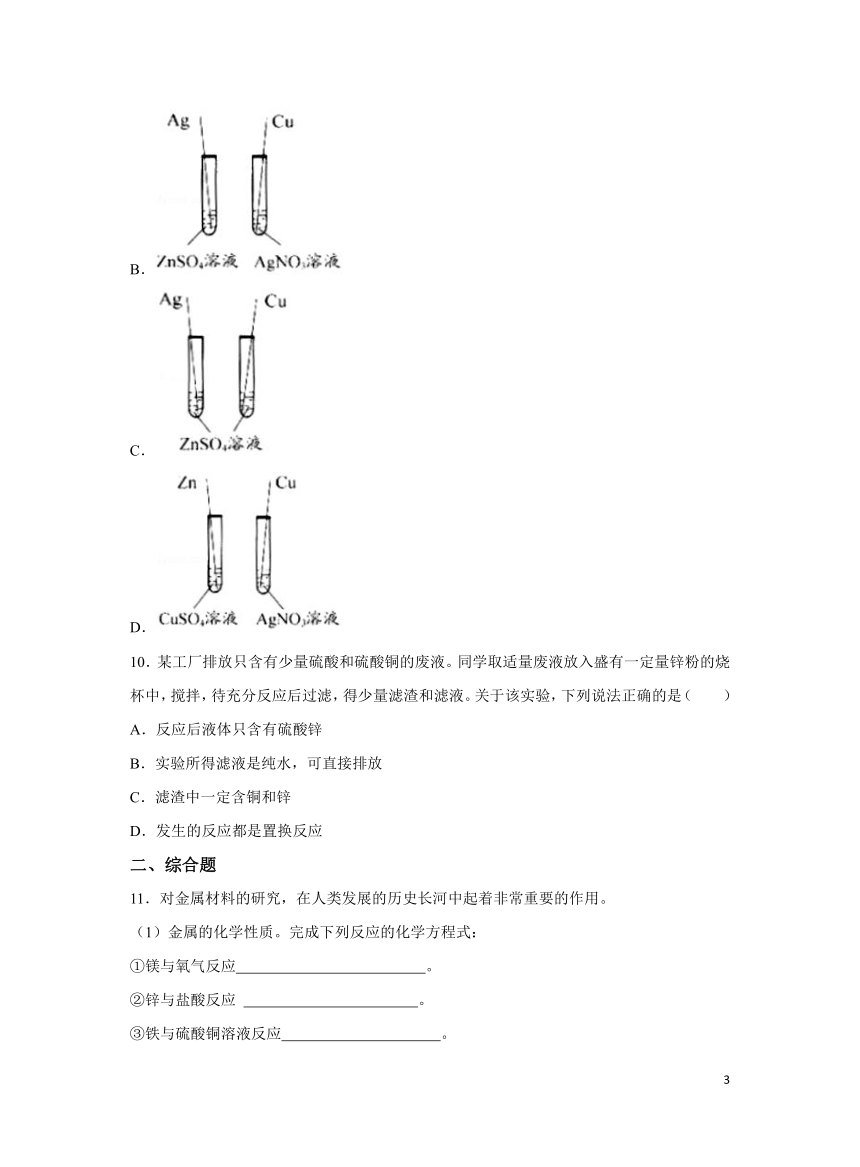
9.【2021年浙江省衢州市】小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )
A.
C.
D.
10.某工厂排放只含有少量硫酸和硫酸铜的废液。同学取适量废液放入盛有一定量锌粉的烧杯中,搅拌,待充分反应后过滤,得少量滤渣和滤液。关于该实验,下列说法正确的是( )
A.反应后液体只含有硫酸锌
B.实验所得滤液是纯水,可直接排放
C.滤渣中一定含铜和锌
D.发生的反应都是置换反应
二、综合题
11.对金属材料的研究,在人类发展的历史长河中起着非常重要的作用。
(1)金属的化学性质。完成下列反应的化学方程式:
①镁与氧气反应 。
②锌与盐酸反应 。
③铁与硫酸铜溶液反应 。
(2)①金属氧化物加热分解。加热氧化银得到银和氧气,写出该反应的化学方程式 。
②将铜丝团浸入硝酸银溶液中一段时间,可以观察到的现象有:铜丝团表面有白色固体生成,反应的化学方程式为____________, 该反应的基本反应类型是 。
12.农业生产中,波尔多液广泛用于消毒杀菌。配制、贮存、运输波尔多液不能使用铁制容器,用化学方程式解释其原因为_________。
13.将一定质量的铁粉和铜粉加入到Zn(NO3)2和AgNO3的混合溶液中,一定会发生的化学反应方程式为 。充分反应后过滤,向滤渣中滴加稀盐酸,有无色气体产生,则滤渣中一定含有____(填化学式),滤液中的溶质一定含有____(填化学式)。
14. A是目前世界年产量最高的金属,根据下图回答下列问题:
(1)B的名称是 。
(2)溶液C中溶质的化学式为______。
(3)D可用于制_______,③可证明铁的金属活动性比铜____(填“强”或“弱”)。
(4)②的基本反应类型是 。
参考答案与解析
一、选择题
1.【答案】A
【解答】常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au;在金属活动性顺序中,金属的位置越靠前,金属的活动性就越强,选项提供的四种金属中镁的位置最靠前,故四种金属中金属活动性最强的是镁。
2.【答案】D
3.【答案】A
【解析】A能置换出B,说明A比B活泼,C、D能与稀盐酸反应产生H2且D比C反应剧烈,而A不能,说明D比C活泼,C比 A活泼,故活动顺序为D>C>A>B,故选A。
4.【答案】B
【解析】A.金属与酸反应,反应越剧烈,金属活动性越强,对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱,A正确;
B.②稀盐酸和铁反应,生成氯化亚铁和氢气,说明金属活动性铁在氢前,④铜和硝酸银反应,生成硝酸铜和银,说明金属活动性铜大于银,不能判断出铁、铜的金属活动性强弱,B错,符合题意;
C.活动性强的金属,能和活动性弱的金属盐溶液反应,分析实验④的现象,能判断出铜和银的金属活动性强弱,C正确;
D.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱,镁>铁>氢,实验③铜和稀盐酸不反应,说明活动性氢>铜,活动性强的金属能和活动性弱的金属盐溶液反应,分析实验④的现象,活动性铜>银,故金属活动性,镁>铁>铜>银,D正确。
故选B。
5.【答案】D
【解答】A.由图像可知,在反应相同的时间内,M生成的氢气比N多,则两种金属的活动性:M>N,故A正确;
B.由图象可知,最终金属A和金属B生成的氢气质量相等,故B正确;
C.由图象可知,生成的氢气的质量相同,则参加反应的稀硫酸的质量也是相等的,故C正确;
D.由于两种金属的相对原子质量大小不能确定,充分反应后,得到溶液的质量也无法比较,故D错误。
故选D。
6.【答案】C
【解析】A.在金属活动性顺序中排在前面的金属能把排在后面的金属从它的化合物溶液中置换出来,因为金属M能把铜置换出来,所以M比铜活泼,故A正确;
B.置换反应指一种单质和一种化合物反应生成另一种单质和另一种化合物,由题中所给反应可知该反应为置换反应,故B正确;
C.若金属R为铝,而铝的化合价为,硫酸根的化合价为,所以生成物中硫酸铝应为,而不是,故C错误;
D.M在反应前是0价,反应后是价,所以反应前后M的化合价发生了改变,故D正确。故选C。
7.【答案】C
【解析】A.将镁片放入稀盐酸中,反应生成氢气,说明镁的金属活动性比氢强;即Mg>H;
B.将铜片放入稀盐酸中,无明显现象,说明铜和稀盐酸不反应,说明铜的金属活动性比氢弱;即H>Cu;
C.将镁片放入硝酸银溶液中,镁与AgNO3溶液反应置换出银,说明了活动性Mg>Ag;
D.将铜片放入硝酸银溶液中,铜与AgNO3溶液反应置换出银,说明了活动性Cu>Ag;
根据ABD,即可得出Mg>H,H>Cu,Cu>Ag,由此可得出三种金属活动性镁>铜>银。故将镁片放入硝酸银溶液中的实验不需进行。故选C。
8.【答案】B
【解析】碳、铜和盐酸不反应,而锌、铁、镁、铝与酸反应时,金属和氢气的质量关系如下:
同质量的四种金属,生成氢气的关系:铝>镁>铁>锌。故:
A.锌和铜混合物比同质量的铁生成氢气少,选项错误;
B.锌和镁混合物可能与同质量的铁生成氢气相同,选项正确;
C.铝和镁混合物比同质量的铁生成氢气多,选项错误;
D.碳和铜混合物不与酸生成氢气,选项错误。
故选B。
9.【答案】D
【解析】A.锌、铜均能与硝酸银溶液反应,说明了活动性锌>银,铜>银,但无法确定锌和铜的活动性强弱,故该方案不合理;
B.银与ZnSO4溶液不反应,说明了活动性锌>银;铜能与硝酸银溶液反应,说明了活动性铜>银,但无法确定锌和铜的活动性强弱,故该方案不合理;
C.银、铜均不能与硫酸锌溶液反应,说明了活动性锌>银,锌>铜,但无法确定银和铜的活动性强弱,故该方案不合理;
D.锌能与硫酸铜溶液反应,说明了活动性锌>铜,铜能与硝酸银溶液反应,说明了活动性铜>银,由此可得出三种金属活动性锌>铜>银;故该方案合理。
10.【答案】D
【解析】A.反应后的液体中一定含有硫酸锌,可能含有硫酸、硫酸铜,选项错误;
B.实验所得滤液不是纯水,可能含有硫酸、硫酸铜,直接排放,会导致水体或土壤被污染,选项错误;
C.滤渣中一定有铜,可能含有锌,只有锌过量时,滤渣才含铜和锌,选项错误;
D.锌和硫酸生成硫酸锌和氢气,锌和硫酸铜反应生成铜和硫酸锌,都属于一种单质和一种化合物生成另一种单质和另一种化合物,发生的反应都是置换反应,选项正确。
故选D。
二、综合题
11.【答案】(1);;
(2) ;2AgNO3+Cu=Cu(NO3)2+2Ag ;置换反应
【解析】(1)①镁与氧气在点燃条件下反应生成氧化镁,化学方程式为:;
②锌与盐酸反应生成氯化锌和氢气,化学方程式为:;
③铁与硫酸铜溶液反应生成硫酸亚铁和铜,化学方程式为:。
(2)①金属氧化物加热分解。加热氧化银可得到银和氧气,该反应的化学方程式;;
② 2AgNO3+Cu=Cu(NO3)2+2Ag ,基本反应类型为置换反应
12.【解析】农业生产中用硫酸铜和氢氧化钙配制波尔多液,硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为CuSO4+Fe=Cu+FeSO4, 所以波尔多液不能使用铁制容器配制、贮存、运输,故填:CuSO4+Fe=Cu+FeSO4。
13.【答案】; Ag、Cu、Fe;
【解析】由于金属的活动性顺序是:锌>铁>铜>银,一定质量的铁粉和铜粉加入到
Zn(NO3)2和AgNO3的混合溶液中,铁、铜不能置换溶液中的锌,铁先置换出溶液中的银,生成了硝酸亚铁,当铁反应完后,若有剩余的硝酸银,铜再与硝酸银反应生成银和硝酸铜,所以一定会发生的反应是:。充分反应后过滤,向滤渣中滴加稀盐酸,有无色气体产生,说明滤渣中一定有铁,则反应情况是硝酸银量不足,只能反应部分的铁,生成银和硝酸亚铁,铁有剩余,铜还没有反应,所以滤渣中含有:铁、铜、银,滤液中的溶质一定含有。
14.【答案】 (1)四氧化三铁;(2)FeSO4;(3)导线(合理即可);强;(4)置换反应
【解析】
A是目前世界年产量最高的金属,故A为铁;铁在氧气中燃烧生成黑色的四氧化三铁,故B为四氧化三铁;铁与稀硫酸反应生成浅绿色的硫酸亚铁溶液和氢气,故C中的溶质是硫酸亚铁;铁与硫酸铜反应生成硫酸亚铁和铜,故D为铜;红棕色的氧化铁与一氧化碳在高温条件下反应生成铁和二氧化碳,故E为氧化铁。代入框图,推理成立。
(1)由分析可知,B的名称是四氧化三铁;
(2)溶液C中溶质是硫酸亚铁,其化学式为FeSO4;
(3)D为铜,具有导电性,可用于制导线,③可证明铁的金属活动性比铜强;
(4)反应②是一种单质与一种化合物反应生成一种单质与一种化合物的反应,基本反应类型是置换反应。
1
一、选择题
1. 【2021湖南长沙】金属活动性顺序在工农业生产和科学研究中有重要作用。下列金属中活动性最强的是( )
A.镁(Mg) B.铝(Al) C.铁(Fe) D.铜(Cu)
2.铝抗腐蚀能力强的原因是( )
A.硬度、密度都较小 B.化学性质不活泼
C.常温下不与氧气反应 D.表面易形成致密的氧化膜
3.已知A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应;相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.D>C>A>B B.A>B>C>D C.B>A>C>D D.D>C>B>A
4.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
5.一定质量M、N两种金属,分别与相同且等量的稀硫酸反应,生成氢气的质量与反应时间的关系如图所示。分析图象得到的以下结论中,不正确的是( )
A.两种金属的活动性:M>N
B.两种金属生成氢气的质量:M=N
C.两种金属消耗稀硫酸的质量:M=N
D.充分反应后,得到溶液的质量:M=N
6.已知金属M与硫酸铜溶液反应的化学反应方程式:则下列说法错误的是( )
A.M的金属活动性比Cu强 B.该反应属于置换反应
C.金属M可能是铝 D.该反应前后M的化合价发生了改变
7.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是( )
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
8.向5.6 g含两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含杂质可能是( )
A.锌和铜 B.锌和镁 C.铝和镁 D.碳和铜
9.【2021年浙江省衢州市】小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )
A.
C.
D.
10.某工厂排放只含有少量硫酸和硫酸铜的废液。同学取适量废液放入盛有一定量锌粉的烧杯中,搅拌,待充分反应后过滤,得少量滤渣和滤液。关于该实验,下列说法正确的是( )
A.反应后液体只含有硫酸锌
B.实验所得滤液是纯水,可直接排放
C.滤渣中一定含铜和锌
D.发生的反应都是置换反应
二、综合题
11.对金属材料的研究,在人类发展的历史长河中起着非常重要的作用。
(1)金属的化学性质。完成下列反应的化学方程式:
①镁与氧气反应 。
②锌与盐酸反应 。
③铁与硫酸铜溶液反应 。
(2)①金属氧化物加热分解。加热氧化银得到银和氧气,写出该反应的化学方程式 。
②将铜丝团浸入硝酸银溶液中一段时间,可以观察到的现象有:铜丝团表面有白色固体生成,反应的化学方程式为____________, 该反应的基本反应类型是 。
12.农业生产中,波尔多液广泛用于消毒杀菌。配制、贮存、运输波尔多液不能使用铁制容器,用化学方程式解释其原因为_________。
13.将一定质量的铁粉和铜粉加入到Zn(NO3)2和AgNO3的混合溶液中,一定会发生的化学反应方程式为 。充分反应后过滤,向滤渣中滴加稀盐酸,有无色气体产生,则滤渣中一定含有____(填化学式),滤液中的溶质一定含有____(填化学式)。
14. A是目前世界年产量最高的金属,根据下图回答下列问题:
(1)B的名称是 。
(2)溶液C中溶质的化学式为______。
(3)D可用于制_______,③可证明铁的金属活动性比铜____(填“强”或“弱”)。
(4)②的基本反应类型是 。
参考答案与解析
一、选择题
1.【答案】A
【解答】常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au;在金属活动性顺序中,金属的位置越靠前,金属的活动性就越强,选项提供的四种金属中镁的位置最靠前,故四种金属中金属活动性最强的是镁。
2.【答案】D
3.【答案】A
【解析】A能置换出B,说明A比B活泼,C、D能与稀盐酸反应产生H2且D比C反应剧烈,而A不能,说明D比C活泼,C比 A活泼,故活动顺序为D>C>A>B,故选A。
4.【答案】B
【解析】A.金属与酸反应,反应越剧烈,金属活动性越强,对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱,A正确;
B.②稀盐酸和铁反应,生成氯化亚铁和氢气,说明金属活动性铁在氢前,④铜和硝酸银反应,生成硝酸铜和银,说明金属活动性铜大于银,不能判断出铁、铜的金属活动性强弱,B错,符合题意;
C.活动性强的金属,能和活动性弱的金属盐溶液反应,分析实验④的现象,能判断出铜和银的金属活动性强弱,C正确;
D.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱,镁>铁>氢,实验③铜和稀盐酸不反应,说明活动性氢>铜,活动性强的金属能和活动性弱的金属盐溶液反应,分析实验④的现象,活动性铜>银,故金属活动性,镁>铁>铜>银,D正确。
故选B。
5.【答案】D
【解答】A.由图像可知,在反应相同的时间内,M生成的氢气比N多,则两种金属的活动性:M>N,故A正确;
B.由图象可知,最终金属A和金属B生成的氢气质量相等,故B正确;
C.由图象可知,生成的氢气的质量相同,则参加反应的稀硫酸的质量也是相等的,故C正确;
D.由于两种金属的相对原子质量大小不能确定,充分反应后,得到溶液的质量也无法比较,故D错误。
故选D。
6.【答案】C
【解析】A.在金属活动性顺序中排在前面的金属能把排在后面的金属从它的化合物溶液中置换出来,因为金属M能把铜置换出来,所以M比铜活泼,故A正确;
B.置换反应指一种单质和一种化合物反应生成另一种单质和另一种化合物,由题中所给反应可知该反应为置换反应,故B正确;
C.若金属R为铝,而铝的化合价为,硫酸根的化合价为,所以生成物中硫酸铝应为,而不是,故C错误;
D.M在反应前是0价,反应后是价,所以反应前后M的化合价发生了改变,故D正确。故选C。
7.【答案】C
【解析】A.将镁片放入稀盐酸中,反应生成氢气,说明镁的金属活动性比氢强;即Mg>H;
B.将铜片放入稀盐酸中,无明显现象,说明铜和稀盐酸不反应,说明铜的金属活动性比氢弱;即H>Cu;
C.将镁片放入硝酸银溶液中,镁与AgNO3溶液反应置换出银,说明了活动性Mg>Ag;
D.将铜片放入硝酸银溶液中,铜与AgNO3溶液反应置换出银,说明了活动性Cu>Ag;
根据ABD,即可得出Mg>H,H>Cu,Cu>Ag,由此可得出三种金属活动性镁>铜>银。故将镁片放入硝酸银溶液中的实验不需进行。故选C。
8.【答案】B
【解析】碳、铜和盐酸不反应,而锌、铁、镁、铝与酸反应时,金属和氢气的质量关系如下:
同质量的四种金属,生成氢气的关系:铝>镁>铁>锌。故:
A.锌和铜混合物比同质量的铁生成氢气少,选项错误;
B.锌和镁混合物可能与同质量的铁生成氢气相同,选项正确;
C.铝和镁混合物比同质量的铁生成氢气多,选项错误;
D.碳和铜混合物不与酸生成氢气,选项错误。
故选B。
9.【答案】D
【解析】A.锌、铜均能与硝酸银溶液反应,说明了活动性锌>银,铜>银,但无法确定锌和铜的活动性强弱,故该方案不合理;
B.银与ZnSO4溶液不反应,说明了活动性锌>银;铜能与硝酸银溶液反应,说明了活动性铜>银,但无法确定锌和铜的活动性强弱,故该方案不合理;
C.银、铜均不能与硫酸锌溶液反应,说明了活动性锌>银,锌>铜,但无法确定银和铜的活动性强弱,故该方案不合理;
D.锌能与硫酸铜溶液反应,说明了活动性锌>铜,铜能与硝酸银溶液反应,说明了活动性铜>银,由此可得出三种金属活动性锌>铜>银;故该方案合理。
10.【答案】D
【解析】A.反应后的液体中一定含有硫酸锌,可能含有硫酸、硫酸铜,选项错误;
B.实验所得滤液不是纯水,可能含有硫酸、硫酸铜,直接排放,会导致水体或土壤被污染,选项错误;
C.滤渣中一定有铜,可能含有锌,只有锌过量时,滤渣才含铜和锌,选项错误;
D.锌和硫酸生成硫酸锌和氢气,锌和硫酸铜反应生成铜和硫酸锌,都属于一种单质和一种化合物生成另一种单质和另一种化合物,发生的反应都是置换反应,选项正确。
故选D。
二、综合题
11.【答案】(1);;
(2) ;2AgNO3+Cu=Cu(NO3)2+2Ag ;置换反应
【解析】(1)①镁与氧气在点燃条件下反应生成氧化镁,化学方程式为:;
②锌与盐酸反应生成氯化锌和氢气,化学方程式为:;
③铁与硫酸铜溶液反应生成硫酸亚铁和铜,化学方程式为:。
(2)①金属氧化物加热分解。加热氧化银可得到银和氧气,该反应的化学方程式;;
② 2AgNO3+Cu=Cu(NO3)2+2Ag ,基本反应类型为置换反应
12.【解析】农业生产中用硫酸铜和氢氧化钙配制波尔多液,硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为CuSO4+Fe=Cu+FeSO4, 所以波尔多液不能使用铁制容器配制、贮存、运输,故填:CuSO4+Fe=Cu+FeSO4。
13.【答案】; Ag、Cu、Fe;
【解析】由于金属的活动性顺序是:锌>铁>铜>银,一定质量的铁粉和铜粉加入到
Zn(NO3)2和AgNO3的混合溶液中,铁、铜不能置换溶液中的锌,铁先置换出溶液中的银,生成了硝酸亚铁,当铁反应完后,若有剩余的硝酸银,铜再与硝酸银反应生成银和硝酸铜,所以一定会发生的反应是:。充分反应后过滤,向滤渣中滴加稀盐酸,有无色气体产生,说明滤渣中一定有铁,则反应情况是硝酸银量不足,只能反应部分的铁,生成银和硝酸亚铁,铁有剩余,铜还没有反应,所以滤渣中含有:铁、铜、银,滤液中的溶质一定含有。
14.【答案】 (1)四氧化三铁;(2)FeSO4;(3)导线(合理即可);强;(4)置换反应
【解析】
A是目前世界年产量最高的金属,故A为铁;铁在氧气中燃烧生成黑色的四氧化三铁,故B为四氧化三铁;铁与稀硫酸反应生成浅绿色的硫酸亚铁溶液和氢气,故C中的溶质是硫酸亚铁;铁与硫酸铜反应生成硫酸亚铁和铜,故D为铜;红棕色的氧化铁与一氧化碳在高温条件下反应生成铁和二氧化碳,故E为氧化铁。代入框图,推理成立。
(1)由分析可知,B的名称是四氧化三铁;
(2)溶液C中溶质是硫酸亚铁,其化学式为FeSO4;
(3)D为铜,具有导电性,可用于制导线,③可证明铁的金属活动性比铜强;
(4)反应②是一种单质与一种化合物反应生成一种单质与一种化合物的反应,基本反应类型是置换反应。
1
同课章节目录
