人教版九下8.3 金属资源的利用和保护(第1课时) 作业(含解析)
文档属性
| 名称 | 人教版九下8.3 金属资源的利用和保护(第1课时) 作业(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 129.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-03 22:57:52 | ||
图片预览

文档简介
8.3 金属资源的利用和保护(第1课时)
一、选择题
1.下列矿石的主要成分不属于氧化物的是( )
A.铝土矿(主要成分Al2O3) B.菱铁矿(主要成分FeCO3)
C.赤铁矿(主要成分Fe2O3) D.磁铁矿(主要成分Fe3O4)
2.把铁矿石、焦炭和石灰石一起加入到高炉中进行冶炼,得到的产物是( )
A.钢 B.生铁 C.纯铁 D.锰钢
3.工业炼铁的主要原料中,正确的一组是( )
①铁矿石;②焦炭;③一氧化碳;④石灰石;⑤空气
A.①②⑤ B.①②④⑤ C.①③④⑤ D.②③④
4.用“W”形玻璃管进行微型实验,如下图所示。下列说法不正确的是( )
A.a处红棕色粉末变为黑色 B.a处的反应为CO+Fe2O3===2Fe+CO2
C.b处澄清石灰水变浑浊证明有CO2生成 D.可利用点燃的方法进行尾气处理
5.用下列矿石冶炼金属时,排放的废气容易引起酸雨的是( )
A.辉铜矿(主要成分Cu2S) B.赤铁矿(主要成分Fe2O3)
C.磁铁矿(主要成分Fe3O4) D.铝土矿(主要成分Al2O3)
6.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20 gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2 g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2 g
C.反应生成CO2的质量为16.5 g
D.参加反应的Fe2O3占原总质量的80%
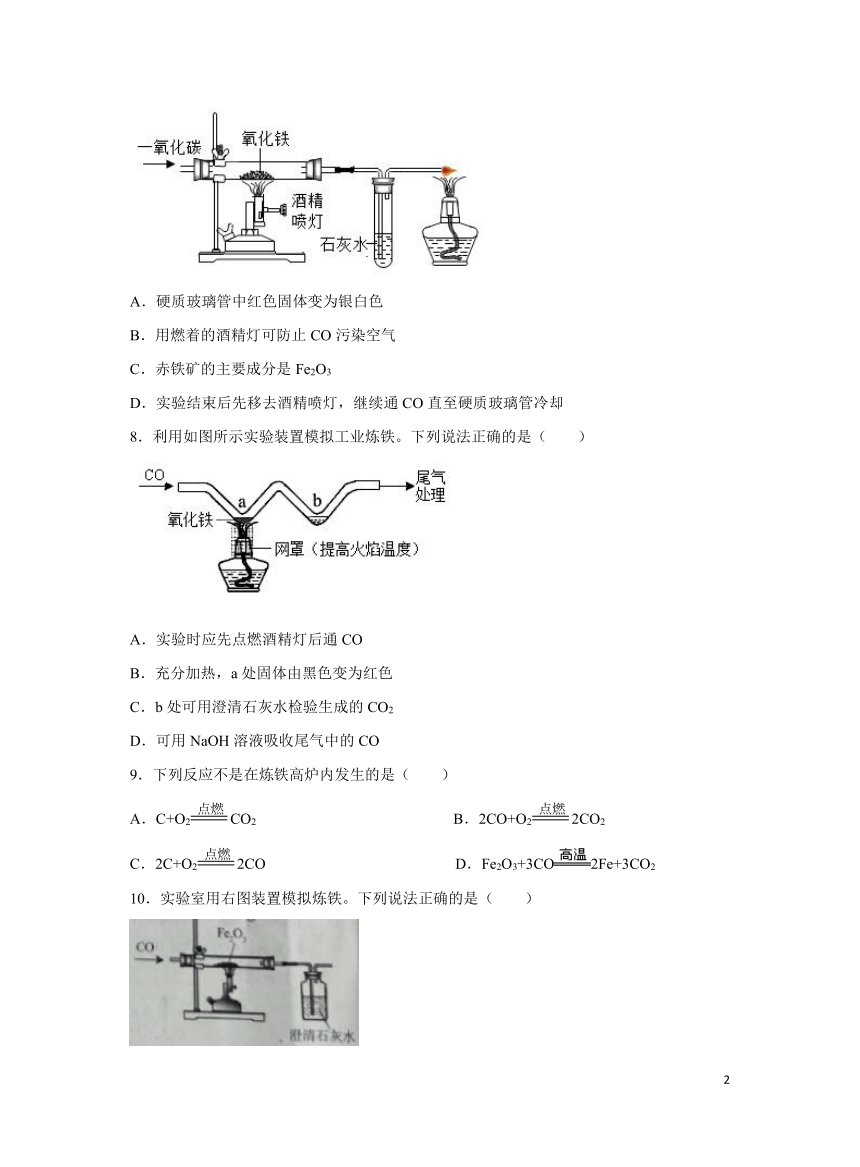
7.下列有关模拟工业炼铁的叙述不正确的是( )
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
8.利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
9.下列反应不是在炼铁高炉内发生的是( )
A.C+O2CO2 B.2CO+O22CO2
C.2C+O22CO D.Fe2O3+3CO2Fe+3CO2
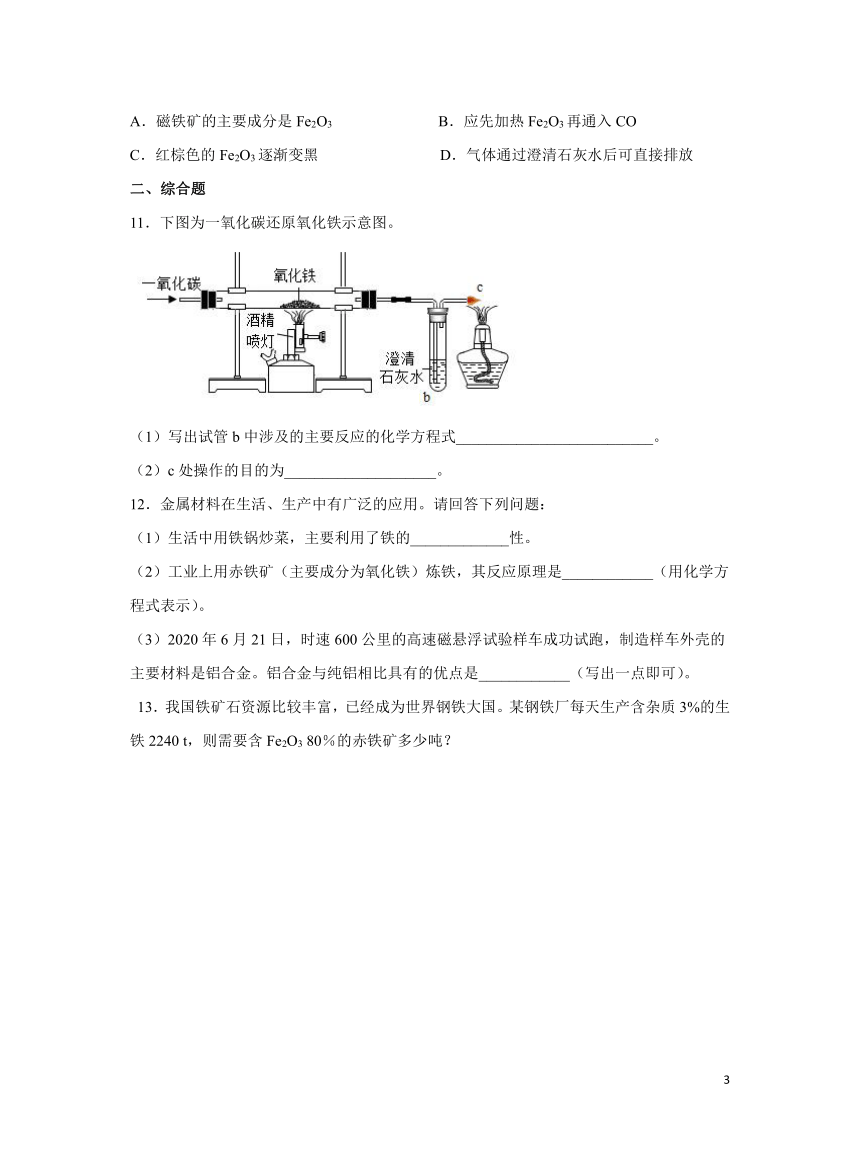
10.实验室用右图装置模拟炼铁。下列说法正确的是( )
A.磁铁矿的主要成分是Fe2O3 B.应先加热Fe2O3再通入CO
C.红棕色的Fe2O3逐渐变黑 D.气体通过澄清石灰水后可直接排放
二、综合题
11.下图为一氧化碳还原氧化铁示意图。
(1)写出试管b中涉及的主要反应的化学方程式__________________________。
(2)c处操作的目的为____________________。
12.金属材料在生活、生产中有广泛的应用。请回答下列问题:
(1)生活中用铁锅炒菜,主要利用了铁的_____________性。
(2)工业上用赤铁矿(主要成分为氧化铁)炼铁,其反应原理是____________(用化学方程式表示)。
(3)2020年6月21日,时速600公里的高速磁悬浮试验样车成功试跑,制造样车外壳的主要材料是铝合金。铝合金与纯铝相比具有的优点是____________(写出一点即可)。
13.我国铁矿石资源比较丰富,已经成为世界钢铁大国。某钢铁厂每天生产含杂质3%的生铁2240 t,则需要含Fe2O3 80%的赤铁矿多少吨?
参考答案与解析
一、选择题
1.【答案】B
【解析】氧化物是由2种元素组成的化合物,B是三种元素组成的。
2.【答案】B
【解析】铁矿石、焦炭在高炉中会反应,得到主要成分是铁,同时含有一定量的碳和其它杂质的生铁。
3.【答案】B
【解析】工业炼铁原料主要是铁矿石、 焦炭、石灰石和空气。
4.【答案】B
【解析】CO还原Fe2O3实验,B项中化学方程式缺少反应条件“高温”,故B项错误
5.【答案】A
【解析】辉铜矿中有S,会生成二氧化硫。
6.【答案】D
【解析】A.由化学方程式可知,反应中一氧化碳得到氧,属于还原剂,选项错误;
B.由化学方程式可知,氧化铁失去的氧元素的质量与生成的铁的质量比=48:112,反应中氧化铁失去的氧元素的质量=20 g 15.2 g=4.8 g,则反应后生成的铁的质量为11.2 g,选项错误;
C.由化学方程式可知,氧化铁失去的氧元素的质量与生成的二氧化碳的质量比=48:132,反应中氧化铁失去的氧元素的质量=20 g 15.2 g=4.8 g,则反应后生成的CO2的质量为13.2 g,选项错误;
D.由题意可知,参加反应的氧化铁失去的氧元素的质量=20 g 15.2 g=4.8 g,参加反应的氧化铁的质量=4.8 g÷×100%=16 g,参加反应的Fe2O3占原总质量的质量分数=×100%=80%,选项正确,故选D。
7.【答案】A
【解析】A.一氧化碳还原氧化铁,红色的氧化铁被还原成黑色铁粉而不是银白色。故A符合题意;
B.没有参加反应的一氧化碳直接通入空气中会造成空气污染,所以可以用一只燃着的酒精灯将一氧化碳燃烧掉。故B不符合题意;
C.赤铁矿颜色是红色的,因为其主要成分氧化铁为红色固体。故C不符合题意;
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却,目的是让还原出来的铁粉在一氧化碳气流中冷却。如果先停止通一氧化碳,后移去酒精喷灯,还原的铁粉又会与空气中的氧气反应。故D不符合题意。故选A。
8.【答案】C
【解析】A.由于CO是可燃性气体,实验时要先通CO排出管内空气,再点燃酒精灯,故错误;
B.a处氧化铁和一氧化碳在加热条件下生成铁和二氧化碳,可观察到固体有红色变为黑色,故错误;
C.二氧化碳能使澄清石灰水变浑浊,检验二氧化碳可以用澄清石灰水,故正确;
D.一氧化碳不与氢氧化钠溶液反应,不能用氢氧化钠溶液吸收CO,故错误。
9.【答案】 C
10.【答案】C
【解析】赤铁矿的主要成分是Fe2O3,磁铁矿的主要成分是Fe3O4;炼铁过程中,由于一氧化碳易爆炸,加热前先CO把装置内空气赶走,防止加热时产生爆炸,再加热Fe2O3;反应过程中出现红棕色的Fe2O3逐渐变黑;反应后尾气含有一氧化碳气体有毒,需要处理,不能直接排放,否则会污染空气。故选C。
二、综合题
11.【答案】(1); (2)尾气处理,防止未反应的CO进入空气中
【解析】(1)一氧化碳与氧化铁在高温条件下反应后生成铁和二氧化碳,而二氧化碳通入澄清石灰水中,与氢氧化钙反应生成碳酸钙沉淀和水,书写化学方程式注意配平及沉淀符号,所以该反应化学方程式为;
故答案为:。
(2)由于一氧化碳具有毒性,不能直接排放,防止造成污染,其具有可燃性,因此可以点燃进行处理;
故答案为:尾气处理,防止未反应的CO进入空气中。
12.【答案】导热 硬度大等合理答案
【解析】(1)生活中用铁锅炒菜,主要利用了铁的导热性;(2)工业上用赤铁矿炼铁,其反应原理是氧化铁和一氧化碳在高温的条件下反应生成铁和二氧化碳,用化学方程式表示为;(3)合金的优点硬度比组成的金属大、抗腐蚀性比组成的金属更强和熔点比组成的金属更低等;所以铝合金与纯铝相比具有的优点是硬度大等(合理答案)。
13.解:设需要含Fe2O3 80%赤铁矿的质量为x。
Fe2O3+3CO2Fe+3CO2
160 112
x×80% 2240 t×(1-3%)
x==3880 t
答:需要含Fe2O3 80%的赤铁矿3880 t。
1
一、选择题
1.下列矿石的主要成分不属于氧化物的是( )
A.铝土矿(主要成分Al2O3) B.菱铁矿(主要成分FeCO3)
C.赤铁矿(主要成分Fe2O3) D.磁铁矿(主要成分Fe3O4)
2.把铁矿石、焦炭和石灰石一起加入到高炉中进行冶炼,得到的产物是( )
A.钢 B.生铁 C.纯铁 D.锰钢
3.工业炼铁的主要原料中,正确的一组是( )
①铁矿石;②焦炭;③一氧化碳;④石灰石;⑤空气
A.①②⑤ B.①②④⑤ C.①③④⑤ D.②③④
4.用“W”形玻璃管进行微型实验,如下图所示。下列说法不正确的是( )
A.a处红棕色粉末变为黑色 B.a处的反应为CO+Fe2O3===2Fe+CO2
C.b处澄清石灰水变浑浊证明有CO2生成 D.可利用点燃的方法进行尾气处理
5.用下列矿石冶炼金属时,排放的废气容易引起酸雨的是( )
A.辉铜矿(主要成分Cu2S) B.赤铁矿(主要成分Fe2O3)
C.磁铁矿(主要成分Fe3O4) D.铝土矿(主要成分Al2O3)
6.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20 gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2 g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2 g
C.反应生成CO2的质量为16.5 g
D.参加反应的Fe2O3占原总质量的80%
7.下列有关模拟工业炼铁的叙述不正确的是( )
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
8.利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A.实验时应先点燃酒精灯后通CO
B.充分加热,a处固体由黑色变为红色
C.b处可用澄清石灰水检验生成的CO2
D.可用NaOH溶液吸收尾气中的CO
9.下列反应不是在炼铁高炉内发生的是( )
A.C+O2CO2 B.2CO+O22CO2
C.2C+O22CO D.Fe2O3+3CO2Fe+3CO2
10.实验室用右图装置模拟炼铁。下列说法正确的是( )
A.磁铁矿的主要成分是Fe2O3 B.应先加热Fe2O3再通入CO
C.红棕色的Fe2O3逐渐变黑 D.气体通过澄清石灰水后可直接排放
二、综合题
11.下图为一氧化碳还原氧化铁示意图。
(1)写出试管b中涉及的主要反应的化学方程式__________________________。
(2)c处操作的目的为____________________。
12.金属材料在生活、生产中有广泛的应用。请回答下列问题:
(1)生活中用铁锅炒菜,主要利用了铁的_____________性。
(2)工业上用赤铁矿(主要成分为氧化铁)炼铁,其反应原理是____________(用化学方程式表示)。
(3)2020年6月21日,时速600公里的高速磁悬浮试验样车成功试跑,制造样车外壳的主要材料是铝合金。铝合金与纯铝相比具有的优点是____________(写出一点即可)。
13.我国铁矿石资源比较丰富,已经成为世界钢铁大国。某钢铁厂每天生产含杂质3%的生铁2240 t,则需要含Fe2O3 80%的赤铁矿多少吨?
参考答案与解析
一、选择题
1.【答案】B
【解析】氧化物是由2种元素组成的化合物,B是三种元素组成的。
2.【答案】B
【解析】铁矿石、焦炭在高炉中会反应,得到主要成分是铁,同时含有一定量的碳和其它杂质的生铁。
3.【答案】B
【解析】工业炼铁原料主要是铁矿石、 焦炭、石灰石和空气。
4.【答案】B
【解析】CO还原Fe2O3实验,B项中化学方程式缺少反应条件“高温”,故B项错误
5.【答案】A
【解析】辉铜矿中有S,会生成二氧化硫。
6.【答案】D
【解析】A.由化学方程式可知,反应中一氧化碳得到氧,属于还原剂,选项错误;
B.由化学方程式可知,氧化铁失去的氧元素的质量与生成的铁的质量比=48:112,反应中氧化铁失去的氧元素的质量=20 g 15.2 g=4.8 g,则反应后生成的铁的质量为11.2 g,选项错误;
C.由化学方程式可知,氧化铁失去的氧元素的质量与生成的二氧化碳的质量比=48:132,反应中氧化铁失去的氧元素的质量=20 g 15.2 g=4.8 g,则反应后生成的CO2的质量为13.2 g,选项错误;
D.由题意可知,参加反应的氧化铁失去的氧元素的质量=20 g 15.2 g=4.8 g,参加反应的氧化铁的质量=4.8 g÷×100%=16 g,参加反应的Fe2O3占原总质量的质量分数=×100%=80%,选项正确,故选D。
7.【答案】A
【解析】A.一氧化碳还原氧化铁,红色的氧化铁被还原成黑色铁粉而不是银白色。故A符合题意;
B.没有参加反应的一氧化碳直接通入空气中会造成空气污染,所以可以用一只燃着的酒精灯将一氧化碳燃烧掉。故B不符合题意;
C.赤铁矿颜色是红色的,因为其主要成分氧化铁为红色固体。故C不符合题意;
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却,目的是让还原出来的铁粉在一氧化碳气流中冷却。如果先停止通一氧化碳,后移去酒精喷灯,还原的铁粉又会与空气中的氧气反应。故D不符合题意。故选A。
8.【答案】C
【解析】A.由于CO是可燃性气体,实验时要先通CO排出管内空气,再点燃酒精灯,故错误;
B.a处氧化铁和一氧化碳在加热条件下生成铁和二氧化碳,可观察到固体有红色变为黑色,故错误;
C.二氧化碳能使澄清石灰水变浑浊,检验二氧化碳可以用澄清石灰水,故正确;
D.一氧化碳不与氢氧化钠溶液反应,不能用氢氧化钠溶液吸收CO,故错误。
9.【答案】 C
10.【答案】C
【解析】赤铁矿的主要成分是Fe2O3,磁铁矿的主要成分是Fe3O4;炼铁过程中,由于一氧化碳易爆炸,加热前先CO把装置内空气赶走,防止加热时产生爆炸,再加热Fe2O3;反应过程中出现红棕色的Fe2O3逐渐变黑;反应后尾气含有一氧化碳气体有毒,需要处理,不能直接排放,否则会污染空气。故选C。
二、综合题
11.【答案】(1); (2)尾气处理,防止未反应的CO进入空气中
【解析】(1)一氧化碳与氧化铁在高温条件下反应后生成铁和二氧化碳,而二氧化碳通入澄清石灰水中,与氢氧化钙反应生成碳酸钙沉淀和水,书写化学方程式注意配平及沉淀符号,所以该反应化学方程式为;
故答案为:。
(2)由于一氧化碳具有毒性,不能直接排放,防止造成污染,其具有可燃性,因此可以点燃进行处理;
故答案为:尾气处理,防止未反应的CO进入空气中。
12.【答案】导热 硬度大等合理答案
【解析】(1)生活中用铁锅炒菜,主要利用了铁的导热性;(2)工业上用赤铁矿炼铁,其反应原理是氧化铁和一氧化碳在高温的条件下反应生成铁和二氧化碳,用化学方程式表示为;(3)合金的优点硬度比组成的金属大、抗腐蚀性比组成的金属更强和熔点比组成的金属更低等;所以铝合金与纯铝相比具有的优点是硬度大等(合理答案)。
13.解:设需要含Fe2O3 80%赤铁矿的质量为x。
Fe2O3+3CO2Fe+3CO2
160 112
x×80% 2240 t×(1-3%)
x==3880 t
答:需要含Fe2O3 80%的赤铁矿3880 t。
1
同课章节目录
