5.1.3 不同价态含硫物质的转化课件(19张ppt)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.3 不同价态含硫物质的转化课件(19张ppt)2022-2023学年下学期高一化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 31.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-04 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
课时3 不同价态含硫物质的转化
学习目标
1. 了解不同价态含硫物质之间的转化;
3. 能说出含硫物质进入大气的主要途径,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识。
2. 能利用氧化还原反应原理设计不同价态物质之间的相互转化;
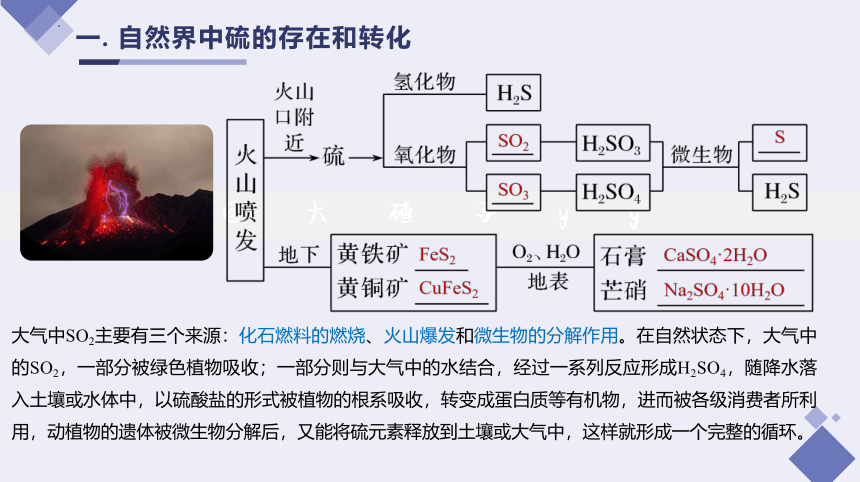
一. 自然界中硫的存在和转化
大气中SO2主要有三个来源:化石燃料的燃烧、火山爆发和微生物的分解作用。在自然状态下,大气中的SO2,一部分被绿色植物吸收;一部分则与大气中的水结合,经过一系列反应形成H2SO4,随降水落入土壤或水体中,以硫酸盐的形式被植物的根系吸收,转变成蛋白质等有机物,进而被各级消费者所利用,动植物的遗体被微生物分解后,又能将硫元素释放到土壤或大气中,这样就形成一个完整的循环。
物质:
价态:
性质:
H2S、Na2S
S
SO2、H2SO3、Na2SO3
H2SO4
S
-2
只有还原性
既有氧化性,又有还原性
只有氧化性
S
0
S
+4
S
+6
被氧化
被氧化
被氧化
被还原
被还原
被还原
二. 硫的化合价与性质的关系
通过 反应实现不同价态含硫物质的相互转化。
氧化还原
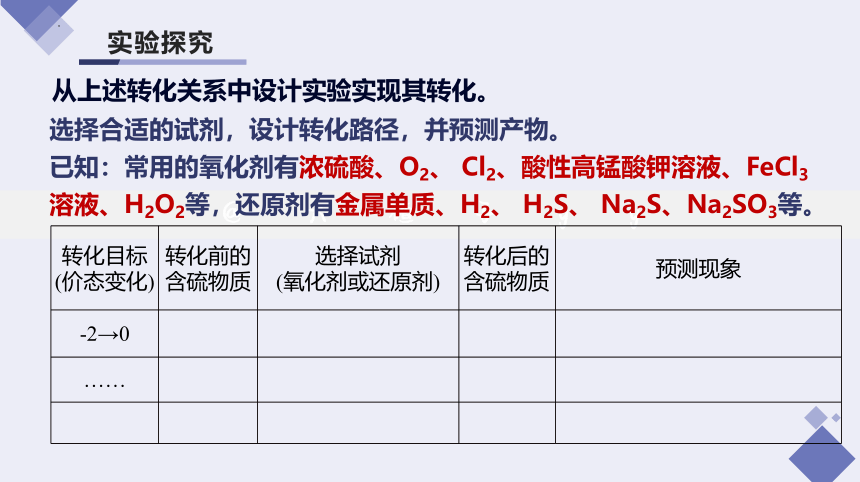
实验探究
选择合适的试剂,设计转化路径,并预测产物。
已知:常用的氧化剂有浓硫酸、O2、 Cl2、酸性高锰酸钾溶液、FeCl3溶液、H2O2等,还原剂有金属单质、H2、 H2S、 Na2S、Na2SO3等。
转化目标 (价态变化) 转化前的含硫物质 选择试剂 (氧化剂或还原剂) 转化后的含硫物质 预测现象
-2→0
……
从上述转化关系中设计实验实现其转化。
常见含硫物质的转化实验
实验探究
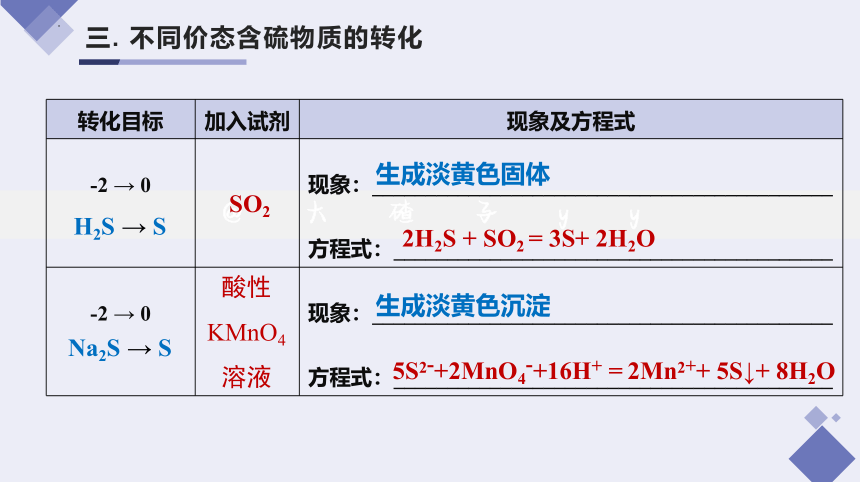
三. 不同价态含硫物质的转化
转化目标 加入试剂 现象及方程式
-2 → 0 现象:___________________________________________
方程式:_________________________________________
-2 → 0 现象:___________________________________________
方程式:_________________________________________
SO2
酸性KMnO4
溶液
生成淡黄色沉淀
5S2-+2MnO4-+16H+ = 2Mn2++ 5S↓+ 8H2O
生成淡黄色固体
2H2S + SO2 = 3S+ 2H2O
H2S → S
Na2S → S
转化目标 加入试剂 现象及方程式
0 → -2 现象:___________________________________________
方程式:_________________________________________
0 → -2 现象:___________________________________________
方程式:_________________________________________
H2
硫在H2中燃烧,产生有臭鸡蛋气味的气体
Fe
有黑色块状固体生成
S + Fe = FeS
三. 不同价态含硫物质的转化
S → H2S
S → FeS
S + H2 = H2S
转化目标 加入试剂 现象及方程式
0 → +4 现象:_______________________________________________
方程式:_________________________________________
+4 → 0 现象:_______________________________________________
方程式:_________________________________________
O2
燃烧,发出明亮的蓝紫色火焰,产生刺激性气味气体
S + O2 = SO2
点燃
氢硫酸
生成淡黄色沉淀
2H2S + SO2 = 3S↓+ 2H2O
三. 不同价态含硫物质的转化
S → SO2
SO2 → S
转化目标 加入试剂 现象及方程式
+4 → +6 现象:___________________________________________
方程式:_________________________________________
+6 → +4 现象:___________________________________________
方程式:_________________________________________
溴水
溶液橙黄色褪去
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
Cu
有气体生成,品红溶液褪色
Cu + 2H2SO4(浓) = CuSO4+ SO2↑+2H2O
三. 不同价态含硫物质的转化
SO2 → H2SO4
H2SO4 → SO2
Na2S溶液中滴入Na2SO3 溶液,再滴加稀H2SO4
转化目标 转化前的含硫物质 选择试剂 预测转化后的含硫物质 实验操作和现象
S
S
0
+4
S
+
-2
S
S粉中加入NaOH溶液,加热。
NaOH
溶液
Na2SO3
和Na2S
S
S
0
+4
S
+
-2
SO2和H2S
S
H2SO4、
水
Na2SO3和
Na2S
S
S
+4
+6
S
+
0
S和
浓H2SO4
硫粉溶解;同时有刺激性气体产生。
生成淡黄色固体
S
SO2
三. 不同价态含硫物质的转化
硫粉逐渐消失。
溶液出现浑浊。
S粉中滴入浓H2SO4 并加热。
四. 同种元素氧化还原规律
(1)邻位价态原则
(2)同种元素相邻价态的粒子不发生氧化还原反应
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应,即使两者氧化性、还原性区分明显。
(3)归中律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态产物,如:2H2S+SO2 = 3S+2H2O
四. 同种元素氧化还原规律
(4)歧化律
单质S和强碱溶液共热,S单质既作氧化剂又作还原剂。
3S+6NaOH = 2Na2S + Na2SO3 + 3H2O
(5)含硫物质的连续氧化过程
H2S
足量O2
SO2
S
O2
O2
△ ,催化剂
SO3
H2O
H2SO4
2H2S + 3O2(足) = 2SO2 + 2H2O
点燃
S + O2 = SO2
点燃
2SO2 +O2 2SO3
△
催化剂
SO3 +H2O = H2SO4
四. 同种元素氧化还原规律
牛刀小试
【例1】写出图中序号所示反应的化学方程式。
① ;
② ;
③ 。
Na2SO3+H2SO4 = Na2SO4+SO2↑+H2O
SO2+2NaOH = Na2SO3+H2O
【例2】写出②、③、④反应的化学方程式:②___________________________;③________________________________;④__________________________。
H2SO3+2NaOH=Na2SO3+2H2O
Na2SO3+H2SO4 =Na2SO4 +SO2↑+H2O
Na2SO3+SO2+H2O =2NaHSO3
牛刀小试
写出③④⑤的化学方程式:③____________________;
④_______________;⑤_______________________。
写出②⑤的化学方程式:②_________________________________; ⑤_______________________。
SO2+2H2S=3S↓+2H2O
2Na2SO3+O2= 2Na2SO4
【例3】
牛刀小试
【例4】A、B、C、D、E五种物质中含有同一种元素,A是淡黄色固体,其相互转化关系如图所示,回答下列问题:
(1)写出B、E的化学式:B____、E_______。
H2S
H2SO4
(2)写出C→D的化学方程式:___________________。
(3)将足量的物质C通入BaCl2溶液中,下列说法正确的是 ____。
①溶液没有明显变化 ②溶液中出现白色沉淀
③若继续通入Cl2,则溶液中出现白色沉淀
①③
化学与职业
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
H2S
S
SO2
硫及其化合物的相互转化
CaSO4
SO3
SO2
H2 , △
O2 , 燃烧
H2 S
O2 , 催化剂
Ca(OH)2
H2SO3
H2 O
FeS
HCl
Fe , △
NaSO3
H2SO4
NaOH
NaOH
H2SO4
O2 , 燃烧
BaSO4
O2
Ba(OH )2
H2 O
Cl2
a. 浓酸 , Cu , △
b. 浓酸 , C , △
BaCl2
CaSO3
O2
CaO
与品红化合(检验)
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
课时3 不同价态含硫物质的转化
学习目标
1. 了解不同价态含硫物质之间的转化;
3. 能说出含硫物质进入大气的主要途径,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识。
2. 能利用氧化还原反应原理设计不同价态物质之间的相互转化;
一. 自然界中硫的存在和转化
大气中SO2主要有三个来源:化石燃料的燃烧、火山爆发和微生物的分解作用。在自然状态下,大气中的SO2,一部分被绿色植物吸收;一部分则与大气中的水结合,经过一系列反应形成H2SO4,随降水落入土壤或水体中,以硫酸盐的形式被植物的根系吸收,转变成蛋白质等有机物,进而被各级消费者所利用,动植物的遗体被微生物分解后,又能将硫元素释放到土壤或大气中,这样就形成一个完整的循环。
物质:
价态:
性质:
H2S、Na2S
S
SO2、H2SO3、Na2SO3
H2SO4
S
-2
只有还原性
既有氧化性,又有还原性
只有氧化性
S
0
S
+4
S
+6
被氧化
被氧化
被氧化
被还原
被还原
被还原
二. 硫的化合价与性质的关系
通过 反应实现不同价态含硫物质的相互转化。
氧化还原
实验探究
选择合适的试剂,设计转化路径,并预测产物。
已知:常用的氧化剂有浓硫酸、O2、 Cl2、酸性高锰酸钾溶液、FeCl3溶液、H2O2等,还原剂有金属单质、H2、 H2S、 Na2S、Na2SO3等。
转化目标 (价态变化) 转化前的含硫物质 选择试剂 (氧化剂或还原剂) 转化后的含硫物质 预测现象
-2→0
……
从上述转化关系中设计实验实现其转化。
常见含硫物质的转化实验
实验探究
三. 不同价态含硫物质的转化
转化目标 加入试剂 现象及方程式
-2 → 0 现象:___________________________________________
方程式:_________________________________________
-2 → 0 现象:___________________________________________
方程式:_________________________________________
SO2
酸性KMnO4
溶液
生成淡黄色沉淀
5S2-+2MnO4-+16H+ = 2Mn2++ 5S↓+ 8H2O
生成淡黄色固体
2H2S + SO2 = 3S+ 2H2O
H2S → S
Na2S → S
转化目标 加入试剂 现象及方程式
0 → -2 现象:___________________________________________
方程式:_________________________________________
0 → -2 现象:___________________________________________
方程式:_________________________________________
H2
硫在H2中燃烧,产生有臭鸡蛋气味的气体
Fe
有黑色块状固体生成
S + Fe = FeS
三. 不同价态含硫物质的转化
S → H2S
S → FeS
S + H2 = H2S
转化目标 加入试剂 现象及方程式
0 → +4 现象:_______________________________________________
方程式:_________________________________________
+4 → 0 现象:_______________________________________________
方程式:_________________________________________
O2
燃烧,发出明亮的蓝紫色火焰,产生刺激性气味气体
S + O2 = SO2
点燃
氢硫酸
生成淡黄色沉淀
2H2S + SO2 = 3S↓+ 2H2O
三. 不同价态含硫物质的转化
S → SO2
SO2 → S
转化目标 加入试剂 现象及方程式
+4 → +6 现象:___________________________________________
方程式:_________________________________________
+6 → +4 现象:___________________________________________
方程式:_________________________________________
溴水
溶液橙黄色褪去
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
Cu
有气体生成,品红溶液褪色
Cu + 2H2SO4(浓) = CuSO4+ SO2↑+2H2O
三. 不同价态含硫物质的转化
SO2 → H2SO4
H2SO4 → SO2
Na2S溶液中滴入Na2SO3 溶液,再滴加稀H2SO4
转化目标 转化前的含硫物质 选择试剂 预测转化后的含硫物质 实验操作和现象
S
S
0
+4
S
+
-2
S
S粉中加入NaOH溶液,加热。
NaOH
溶液
Na2SO3
和Na2S
S
S
0
+4
S
+
-2
SO2和H2S
S
H2SO4、
水
Na2SO3和
Na2S
S
S
+4
+6
S
+
0
S和
浓H2SO4
硫粉溶解;同时有刺激性气体产生。
生成淡黄色固体
S
SO2
三. 不同价态含硫物质的转化
硫粉逐渐消失。
溶液出现浑浊。
S粉中滴入浓H2SO4 并加热。
四. 同种元素氧化还原规律
(1)邻位价态原则
(2)同种元素相邻价态的粒子不发生氧化还原反应
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降。
如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应,即使两者氧化性、还原性区分明显。
(3)归中律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态产物,如:2H2S+SO2 = 3S+2H2O
四. 同种元素氧化还原规律
(4)歧化律
单质S和强碱溶液共热,S单质既作氧化剂又作还原剂。
3S+6NaOH = 2Na2S + Na2SO3 + 3H2O
(5)含硫物质的连续氧化过程
H2S
足量O2
SO2
S
O2
O2
△ ,催化剂
SO3
H2O
H2SO4
2H2S + 3O2(足) = 2SO2 + 2H2O
点燃
S + O2 = SO2
点燃
2SO2 +O2 2SO3
△
催化剂
SO3 +H2O = H2SO4
四. 同种元素氧化还原规律
牛刀小试
【例1】写出图中序号所示反应的化学方程式。
① ;
② ;
③ 。
Na2SO3+H2SO4 = Na2SO4+SO2↑+H2O
SO2+2NaOH = Na2SO3+H2O
【例2】写出②、③、④反应的化学方程式:②___________________________;③________________________________;④__________________________。
H2SO3+2NaOH=Na2SO3+2H2O
Na2SO3+H2SO4 =Na2SO4 +SO2↑+H2O
Na2SO3+SO2+H2O =2NaHSO3
牛刀小试
写出③④⑤的化学方程式:③____________________;
④_______________;⑤_______________________。
写出②⑤的化学方程式:②_________________________________; ⑤_______________________。
SO2+2H2S=3S↓+2H2O
2Na2SO3+O2= 2Na2SO4
【例3】
牛刀小试
【例4】A、B、C、D、E五种物质中含有同一种元素,A是淡黄色固体,其相互转化关系如图所示,回答下列问题:
(1)写出B、E的化学式:B____、E_______。
H2S
H2SO4
(2)写出C→D的化学方程式:___________________。
(3)将足量的物质C通入BaCl2溶液中,下列说法正确的是 ____。
①溶液没有明显变化 ②溶液中出现白色沉淀
③若继续通入Cl2,则溶液中出现白色沉淀
①③
化学与职业
化工工程师
化工工程师是解决人类在生产、生活等领域面临的化工相关问题的专业技术人才,工作在石油炼制、化肥生产、医药开发和环境治理等领域。主要工作是依据科学原理,统筹各方面的资源,设计化工生产的工艺流程,并监控生产过程,及时解决生产中遇到的技术问题。
化工工程师需要具有高度的社会责任感、团队精神、全局观念、风险管控意识和创新能力,并具备化学、化工、安全、经济、环境等方面的专业知识。
H2S
S
SO2
硫及其化合物的相互转化
CaSO4
SO3
SO2
H2 , △
O2 , 燃烧
H2 S
O2 , 催化剂
Ca(OH)2
H2SO3
H2 O
FeS
HCl
Fe , △
NaSO3
H2SO4
NaOH
NaOH
H2SO4
O2 , 燃烧
BaSO4
O2
Ba(OH )2
H2 O
Cl2
a. 浓酸 , Cu , △
b. 浓酸 , C , △
BaCl2
CaSO3
O2
CaO
与品红化合(检验)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
