5.1.2硫及其化合物 课件 (22张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.2硫及其化合物 课件 (22张ppt) 2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-04 09:43:46 | ||
图片预览






文档简介
(共22张PPT)
第五章 化工生产中的重要非金属材料
第一节 硫及其化合物
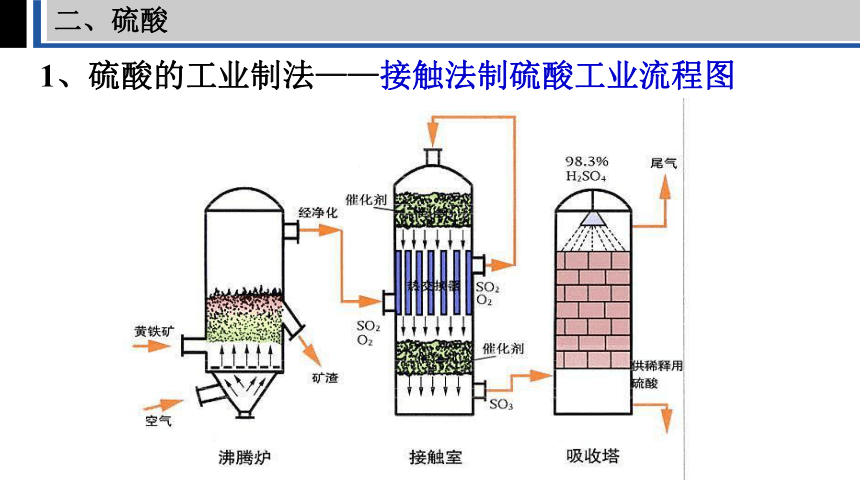
1、硫酸的工业制法——接触法制硫酸工业流程图
二、硫酸
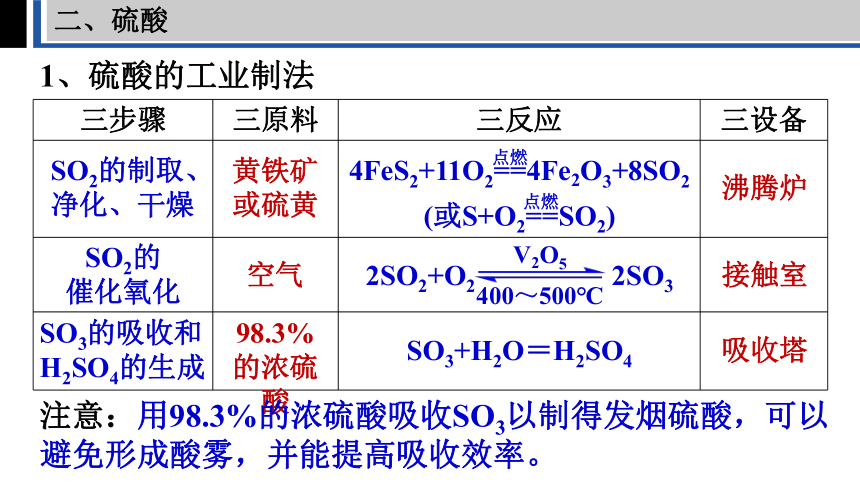
1、硫酸的工业制法
三步骤 三原料 三反应 三设备
SO2的制取、净化、干燥
SO2的
催化氧化
SO3的吸收和
H2SO4的生成
黄铁矿
或硫黄
空气
98.3%的浓硫酸
SO3+H2O=H2SO4
2SO2+O2 2SO3
V2O5
400~500℃
4FeS2+11O2==4Fe2O3+8SO2
(或S+O2==SO2)
点燃
点燃
沸腾炉
接触室
吸收塔
注意:用98.3%的浓硫酸吸收SO3以制得发烟硫酸,可以避免形成酸雾,并能提高吸收效率。
二、硫酸
2、硫酸的物理性质:
纯硫酸是无色、黏稠的油状液体, 沸点高、难挥发。常用的浓硫酸中H2SO4的质量分数为98.3%,密度为1.84g·cm 3。
3、硫酸的化学性质:
硫酸是二元强酸,稀硫酸具有酸的通性,能与酸碱指示剂、活泼金属、碱、碱性氧化物及某些盐反应。
4、浓硫酸的特性:
吸水性、脱水性和强氧化性
二、硫酸
(1)浓硫酸的吸水性:
浓硫酸可以将气体、液体或固体中的游离态水或结合态H2O“夺走”的性质。
4、浓硫酸的特性
实验1:在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:蓝色胆矾(CuSO4·5H2O)晶体转化为白色的无水硫酸铜(CuSO4)粉末。
结论:浓硫酸可以夺走结晶水合物中的结合态H2O
应用:用于干燥酸性或中性的非还原性气体
CuSO4·5H2O===CuSO4+5H2O
浓硫酸
二、硫酸
浓硫酸 浓H3PO4 P2O5 无水CaCl2 碱石灰
状态
特性
不能干 燥的 气体
可干燥 的气体
液态
液态
固态
固态
固态
(洗气瓶)
(洗气瓶)
(干燥管)
(干燥管)
(干燥管)
酸性 强氧化性
酸性
中性
碱性
碱性气体NH3还原性气体H2S、HI
碱性气体
(NH3)
NH3
酸性气体CO2、SO2
HCl
中性、酸性、非还原性气体
中性、酸性气体
多数气体
中性、
碱性气体
特例:SO2
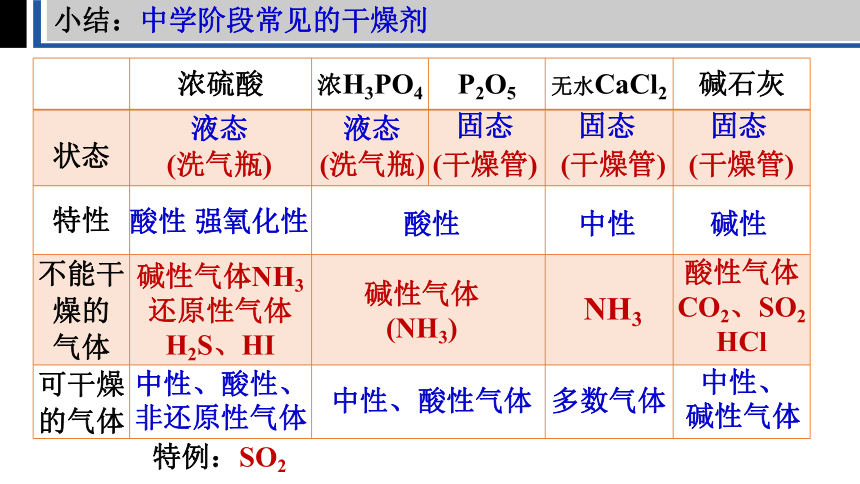
小结:中学阶段常见的干燥剂
(2)浓硫酸的脱水性:
4、浓硫酸的特性
将有机物中的氢元素和氧元素按水的组成比脱去。
实验2:向盛有干燥的蔗糖固体的烧杯中浓硫酸,边加边搅拌。
二、硫酸
现象: 烧杯外壁发烫,白色的蔗糖固体变成黑色粘稠物,后逐渐膨胀形成海绵状黑色固体,能闻到刺激性的气味
C12H22O11 12C+11H2O
浓硫酸
C+H2SO4(浓)==CO2↑+2SO2↑+2H2O
二、硫酸
(3)浓硫酸的强氧化性
4、浓硫酸的特性
酸的氧化性:
氧化性酸:
由酸分子中的正价中心原子体现出来,如浓硫酸,与金属单质或非金属单质反应时,+6价的S被还原为SO2。
是酸的通性,由H+的体现出来,表现为与金属反应时H+被还原为H2。
常见的强氧化性酸:(无H2)
浓硝酸→NO2;稀硝酸→NO;次氯酸→Cl
二、硫酸
(3)浓硫酸的强氧化性
①与金属单质的反应
Ⅰ )常温下与铁、铝接触,金属表面会生成一层致密的氧化膜而钝化;但加热时,铁、铝仍可以与浓硫酸反应。
2Fe+6H2SO4(浓)==2Fe2(SO4)3+3SO2↑+6H2O
Ⅱ )加热条件下大多数金属(除Au、Pt外)可被浓硫酸氧化
二、硫酸
实验5 3:浓硫酸与铜的反应
Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
对此反应的几点说明:
1、对于该反应不加热,反应不能进行;
2、随着反应的进行,浓硫酸会因生成的H2O而被稀释,当稀释到一定程度时反应则停止;
3、浓硫酸在反应中体现了氧化性和酸性。
二、硫酸
(3)浓硫酸的强氧化性
②与非金属单质的反应:
C+H2SO4(浓)==CO2↑+2SO2↑+2H2O
S+2H2SO4(浓)==3SO2↑+2H2O
(浓硫酸在反应中仅体现氧化性)
思考:如何检验碳与浓硫酸反应的产物?
思路:先检验H2O,后检验SO2、最后检验CO2
③与还原性物质的反应:
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
二、硫酸
注意:酸性KMnO4溶液可兼起除SO2、并检验SO2是否除尽的作用,理论上只要酸性KMnO4溶液的紫红色不完全褪去,则可证明SO2被除尽。图中虚线框中的溶液可省略。
二、硫酸
1、硫酸根离子的检验方法
(1)原理:
Ba2++SO42 =BaSO4↓(白色)
(2)试剂:
沉淀剂:BaCl2溶液
抗干扰剂:稀盐酸(排除CO32 、SO32 、Ag+干扰)
(3)操作方法:
待测液
加足量稀盐酸酸化
无明显现象
滴加BaCl2
溶液
有白色沉淀(有SO42 )
无白色沉淀(无SO42 )
三、硫酸根离子的检验
粗盐水
要保留的离子
杂质离子
Na+、Cl
Mg2+
SO42
Ca2+
选择能使杂质转化为气体或沉淀的物质作为除杂试剂(不影响要保留的离子,且应适当过量)
①NaOH
②BaCl2
③Na2CO3
除杂质Ca2+,并除去引入的Ba2+
除去因除杂试剂过量而引入的新杂质离子
除去引入的CO32 、OH
④稀盐酸
综合考虑,确定试剂添加顺序和实验操作步骤
先加BaCl2,再加Na2CO3;
先过滤,再加稀盐酸。
除去粗盐中的杂质:可溶性硫酸盐、MgCl2、CaCl2
练、海盐经溶解、过滤后仍含有Ca2+、Mg2+、SO42 等可溶性杂质,为得到纯净的NaCl,可向漏液中依次加入过量的下列溶液,其中不合理的是( )
A. BaCl2→NaOH→Na2CO3→过滤→稀盐酸→蒸发结晶
B. Ba(OH)2→Na2CO3→过滤→稀盐酸→蒸发结晶
C. Na2CO3 →NaOH→BaCl2→过滤→稀盐酸→蒸发结晶
D. BaCl2→Na2CO3 →NaOH→过滤→稀盐酸→蒸发结晶
C
三、硫酸根离子的检验
1、自然界中硫的存在与转化
(1)硫的存在:
自然界中硫的分布很广,既能以游离态形式存在,又能以化合态形式存在。
①游离态:
火山口附近或地壳岩层里
②化合态:
主要以硫化物和硫酸盐的形式存在
黄铁矿 黄铜矿
硫
化
物
FeS2
CuFeS2
芒硝 石膏矿 重晶石
硫
酸
盐
Na2SO4·10H2O
CaSO4·2H2O
BaSO4
四、不同价态含硫物质的转化
(1)硫的存在:自然界中硫的分布很广,既能以游离态形式存在,又能以化合态形式存在。
(1)游离态:火山口附近或地壳岩层里
②化合态:主要以硫化物和硫酸盐的形式存在
③其他:蛋白质、化石燃料(煤、石油、天然气)
1、自然界中硫的存在与转化
四、不同价态含硫物质的转化
(2)硫的转化:硫及其化合物的“价—类”二维图
硫元素
化合价
+6
+4
0
2
氢化物 单质 氧化物 酸 盐 物质类别
H2S
S
SO2
SO3
H2SO4
H2SO3
Na2S
Na2SO3
Na2SO4
只有还原性
只有氧化性
两性
四、不同价态含硫物质的转化
2、实验室中研究不同价态含硫物质的转化
(1)转化原理:
S S S S
2 0 +4 +6
[O] [O] [O]
[H] [H] [H]
(2)实验设计:原则是科学性、可行性、安全性和绿色化
转化目标
(价态变化)
转化前的含硫物质
选择试剂
转化后的含硫物质
预期现象
2→0
Na2S
Cl2
S
将少量Cl2通入Na2S溶液中,出现黄色沉淀
0→+2
S
H2
H2S
加热之后产生有臭鸡蛋气味的气体
四、不同价态含硫物质的转化
(2)实验设计:原则是科学性、可行性、安全性和绿色化
转化目标
(价态变化)
转化前的含硫物质
选择试剂
转化后的含硫物质
预期现象
0→+4
S
O2
SO2
发出明亮的蓝紫色火焰,产生刺激性气味的气体
+4→0
SO2
H2S
S
两者混合后,生成黄色沉淀
+4→+6
SO2
新制氯水
BaCl2溶液
H2SO4
SO2通入氯水中,氯水褪色;加BaCl2产生白色沉淀
+6→+4
H2SO4
铜片、
品红溶液
SO2
铜片与浓硫酸混合加热,将产生的气体通入品红溶液中,溶液褪色
四、不同价态含硫物质的转化
硫元素
H2S
SO2
SO3
H2SO4
S
SO2
SO3
H2SO4
O2
O2
H2O
O2
O2
H2O
拓展:含硫物质的连续氧化规律
第五章 化工生产中的重要非金属材料
第一节 硫及其化合物
1、硫酸的工业制法——接触法制硫酸工业流程图
二、硫酸
1、硫酸的工业制法
三步骤 三原料 三反应 三设备
SO2的制取、净化、干燥
SO2的
催化氧化
SO3的吸收和
H2SO4的生成
黄铁矿
或硫黄
空气
98.3%的浓硫酸
SO3+H2O=H2SO4
2SO2+O2 2SO3
V2O5
400~500℃
4FeS2+11O2==4Fe2O3+8SO2
(或S+O2==SO2)
点燃
点燃
沸腾炉
接触室
吸收塔
注意:用98.3%的浓硫酸吸收SO3以制得发烟硫酸,可以避免形成酸雾,并能提高吸收效率。
二、硫酸
2、硫酸的物理性质:
纯硫酸是无色、黏稠的油状液体, 沸点高、难挥发。常用的浓硫酸中H2SO4的质量分数为98.3%,密度为1.84g·cm 3。
3、硫酸的化学性质:
硫酸是二元强酸,稀硫酸具有酸的通性,能与酸碱指示剂、活泼金属、碱、碱性氧化物及某些盐反应。
4、浓硫酸的特性:
吸水性、脱水性和强氧化性
二、硫酸
(1)浓硫酸的吸水性:
浓硫酸可以将气体、液体或固体中的游离态水或结合态H2O“夺走”的性质。
4、浓硫酸的特性
实验1:在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:蓝色胆矾(CuSO4·5H2O)晶体转化为白色的无水硫酸铜(CuSO4)粉末。
结论:浓硫酸可以夺走结晶水合物中的结合态H2O
应用:用于干燥酸性或中性的非还原性气体
CuSO4·5H2O===CuSO4+5H2O
浓硫酸
二、硫酸
浓硫酸 浓H3PO4 P2O5 无水CaCl2 碱石灰
状态
特性
不能干 燥的 气体
可干燥 的气体
液态
液态
固态
固态
固态
(洗气瓶)
(洗气瓶)
(干燥管)
(干燥管)
(干燥管)
酸性 强氧化性
酸性
中性
碱性
碱性气体NH3还原性气体H2S、HI
碱性气体
(NH3)
NH3
酸性气体CO2、SO2
HCl
中性、酸性、非还原性气体
中性、酸性气体
多数气体
中性、
碱性气体
特例:SO2
小结:中学阶段常见的干燥剂
(2)浓硫酸的脱水性:
4、浓硫酸的特性
将有机物中的氢元素和氧元素按水的组成比脱去。
实验2:向盛有干燥的蔗糖固体的烧杯中浓硫酸,边加边搅拌。
二、硫酸
现象: 烧杯外壁发烫,白色的蔗糖固体变成黑色粘稠物,后逐渐膨胀形成海绵状黑色固体,能闻到刺激性的气味
C12H22O11 12C+11H2O
浓硫酸
C+H2SO4(浓)==CO2↑+2SO2↑+2H2O
二、硫酸
(3)浓硫酸的强氧化性
4、浓硫酸的特性
酸的氧化性:
氧化性酸:
由酸分子中的正价中心原子体现出来,如浓硫酸,与金属单质或非金属单质反应时,+6价的S被还原为SO2。
是酸的通性,由H+的体现出来,表现为与金属反应时H+被还原为H2。
常见的强氧化性酸:(无H2)
浓硝酸→NO2;稀硝酸→NO;次氯酸→Cl
二、硫酸
(3)浓硫酸的强氧化性
①与金属单质的反应
Ⅰ )常温下与铁、铝接触,金属表面会生成一层致密的氧化膜而钝化;但加热时,铁、铝仍可以与浓硫酸反应。
2Fe+6H2SO4(浓)==2Fe2(SO4)3+3SO2↑+6H2O
Ⅱ )加热条件下大多数金属(除Au、Pt外)可被浓硫酸氧化
二、硫酸
实验5 3:浓硫酸与铜的反应
Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O
对此反应的几点说明:
1、对于该反应不加热,反应不能进行;
2、随着反应的进行,浓硫酸会因生成的H2O而被稀释,当稀释到一定程度时反应则停止;
3、浓硫酸在反应中体现了氧化性和酸性。
二、硫酸
(3)浓硫酸的强氧化性
②与非金属单质的反应:
C+H2SO4(浓)==CO2↑+2SO2↑+2H2O
S+2H2SO4(浓)==3SO2↑+2H2O
(浓硫酸在反应中仅体现氧化性)
思考:如何检验碳与浓硫酸反应的产物?
思路:先检验H2O,后检验SO2、最后检验CO2
③与还原性物质的反应:
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
二、硫酸
注意:酸性KMnO4溶液可兼起除SO2、并检验SO2是否除尽的作用,理论上只要酸性KMnO4溶液的紫红色不完全褪去,则可证明SO2被除尽。图中虚线框中的溶液可省略。
二、硫酸
1、硫酸根离子的检验方法
(1)原理:
Ba2++SO42 =BaSO4↓(白色)
(2)试剂:
沉淀剂:BaCl2溶液
抗干扰剂:稀盐酸(排除CO32 、SO32 、Ag+干扰)
(3)操作方法:
待测液
加足量稀盐酸酸化
无明显现象
滴加BaCl2
溶液
有白色沉淀(有SO42 )
无白色沉淀(无SO42 )
三、硫酸根离子的检验
粗盐水
要保留的离子
杂质离子
Na+、Cl
Mg2+
SO42
Ca2+
选择能使杂质转化为气体或沉淀的物质作为除杂试剂(不影响要保留的离子,且应适当过量)
①NaOH
②BaCl2
③Na2CO3
除杂质Ca2+,并除去引入的Ba2+
除去因除杂试剂过量而引入的新杂质离子
除去引入的CO32 、OH
④稀盐酸
综合考虑,确定试剂添加顺序和实验操作步骤
先加BaCl2,再加Na2CO3;
先过滤,再加稀盐酸。
除去粗盐中的杂质:可溶性硫酸盐、MgCl2、CaCl2
练、海盐经溶解、过滤后仍含有Ca2+、Mg2+、SO42 等可溶性杂质,为得到纯净的NaCl,可向漏液中依次加入过量的下列溶液,其中不合理的是( )
A. BaCl2→NaOH→Na2CO3→过滤→稀盐酸→蒸发结晶
B. Ba(OH)2→Na2CO3→过滤→稀盐酸→蒸发结晶
C. Na2CO3 →NaOH→BaCl2→过滤→稀盐酸→蒸发结晶
D. BaCl2→Na2CO3 →NaOH→过滤→稀盐酸→蒸发结晶
C
三、硫酸根离子的检验
1、自然界中硫的存在与转化
(1)硫的存在:
自然界中硫的分布很广,既能以游离态形式存在,又能以化合态形式存在。
①游离态:
火山口附近或地壳岩层里
②化合态:
主要以硫化物和硫酸盐的形式存在
黄铁矿 黄铜矿
硫
化
物
FeS2
CuFeS2
芒硝 石膏矿 重晶石
硫
酸
盐
Na2SO4·10H2O
CaSO4·2H2O
BaSO4
四、不同价态含硫物质的转化
(1)硫的存在:自然界中硫的分布很广,既能以游离态形式存在,又能以化合态形式存在。
(1)游离态:火山口附近或地壳岩层里
②化合态:主要以硫化物和硫酸盐的形式存在
③其他:蛋白质、化石燃料(煤、石油、天然气)
1、自然界中硫的存在与转化
四、不同价态含硫物质的转化
(2)硫的转化:硫及其化合物的“价—类”二维图
硫元素
化合价
+6
+4
0
2
氢化物 单质 氧化物 酸 盐 物质类别
H2S
S
SO2
SO3
H2SO4
H2SO3
Na2S
Na2SO3
Na2SO4
只有还原性
只有氧化性
两性
四、不同价态含硫物质的转化
2、实验室中研究不同价态含硫物质的转化
(1)转化原理:
S S S S
2 0 +4 +6
[O] [O] [O]
[H] [H] [H]
(2)实验设计:原则是科学性、可行性、安全性和绿色化
转化目标
(价态变化)
转化前的含硫物质
选择试剂
转化后的含硫物质
预期现象
2→0
Na2S
Cl2
S
将少量Cl2通入Na2S溶液中,出现黄色沉淀
0→+2
S
H2
H2S
加热之后产生有臭鸡蛋气味的气体
四、不同价态含硫物质的转化
(2)实验设计:原则是科学性、可行性、安全性和绿色化
转化目标
(价态变化)
转化前的含硫物质
选择试剂
转化后的含硫物质
预期现象
0→+4
S
O2
SO2
发出明亮的蓝紫色火焰,产生刺激性气味的气体
+4→0
SO2
H2S
S
两者混合后,生成黄色沉淀
+4→+6
SO2
新制氯水
BaCl2溶液
H2SO4
SO2通入氯水中,氯水褪色;加BaCl2产生白色沉淀
+6→+4
H2SO4
铜片、
品红溶液
SO2
铜片与浓硫酸混合加热,将产生的气体通入品红溶液中,溶液褪色
四、不同价态含硫物质的转化
硫元素
H2S
SO2
SO3
H2SO4
S
SO2
SO3
H2SO4
O2
O2
H2O
O2
O2
H2O
拓展:含硫物质的连续氧化规律
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
