化学人教版(2019)必修第一册1.1物质的分类及转化 课件(2课时,共37张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1物质的分类及转化 课件(2课时,共37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-04 09:49:40 | ||
图片预览









文档简介
(共37张PPT)
第1课时 物质的分类
第一章 物质及其变化
第一节 物质的分类及转化
根据物质的组成和性质可以对物质进行分类。
感受分类方法对化学研究和学习化学的重要作用,体会日常生产、生活中分类法的应用。
03
知道胶体是一种常见的分散系和胶体的丁达尔效应。
学习目标
01
02
新课导入
超市商品按一定类别进行陈列
新课导入
餐牌里的分类
物质的分类
一、同素异形体
1. 定义:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
2. 实例:金刚石、石墨和C60;O2和O3;红磷和白磷。
3. 产生原因:
(1)组成分子的原子数目和成键方式不同,如:氧气(O2)和臭氧(O3)。
(2)原子的排列方式不同,如:金刚石和石墨。
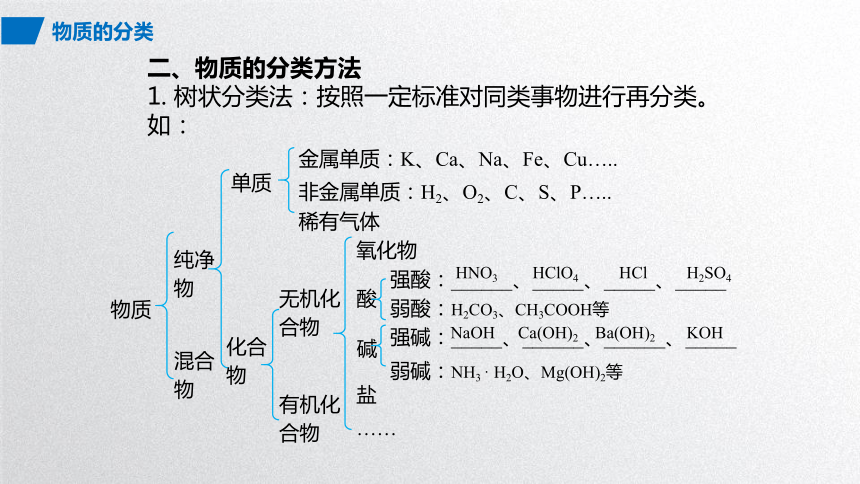
二、物质的分类方法
1. 树状分类法:按照一定标准对同类事物进行再分类。
如:
物质
纯净物
单质
金属单质:K、Ca、Na、Fe、Cu…..
非金属单质:H2、O2、C、S、P…..
化合物
有机化合物
混合物
无机化合物
氧化物
酸
碱
盐
……
强酸:______、_____、_____、_____
弱酸:H2CO3、CH3COOH等
强碱:_____、______、______、_____
弱碱:NH3 · H2O、Mg(OH)2等
H2SO4
HCl
HNO3
HClO4
KOH
NaOH
Ca(OH)2
Ba(OH)2
稀有气体
物质的分类
物质的分类
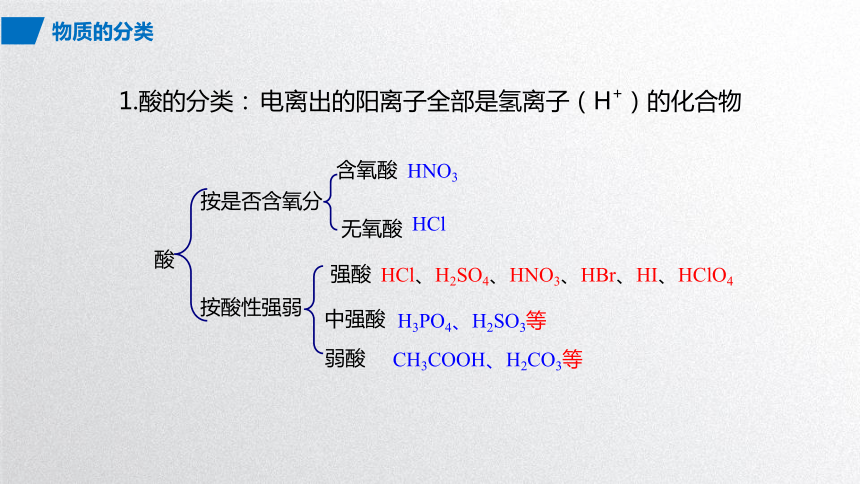
1.酸的分类:
按是否含氧分
酸
含氧酸
无氧酸
HNO3
HCl
电离出的阳离子全部是氢离子(H+)的化合物
按酸性强弱
强酸
CH3COOH、H2CO3等
中强酸
H3PO4、H2SO3等
弱酸
HCl、H2SO4、HNO3、HBr、HI、HClO4
物质的分类
2.碱的分类:
电离出的阴离子全部是氢氧离子(OH-)的化合物
按是否可溶
碱
可溶性碱
不溶性碱
按碱性强弱
强碱
弱碱
Mg(OH)2、Cu(OH)2、 Fe(OH)3
KOH
Ca(OH)2
Fe(OH)3
NH3·H2O
按提供的OH-个数
一元碱:
二元碱:
多元碱:
…………
NaOH、KOH、Ba(OH)2
NaOH、KOH
物质的分类
3.盐的分类:
由金属阳离子(或)和酸根离子构成的化合物
盐
按溶解性
可溶盐
难溶盐
NaCl、AgNO3、CuSO4、NH4Cl
CaCO3、 BaCO3 、BaSO4
按组成和性质分
正盐
酸式盐
碱式盐
复盐
Na2CO3
K2SO4
NaHCO3
KHSO4
Cu2(OH)2CO3
KAl(SO4)2、(NH4)2Fe(SO4)2
…………
物质的分类
指能与酸反应,只生成相应价态的盐和水的氧化物
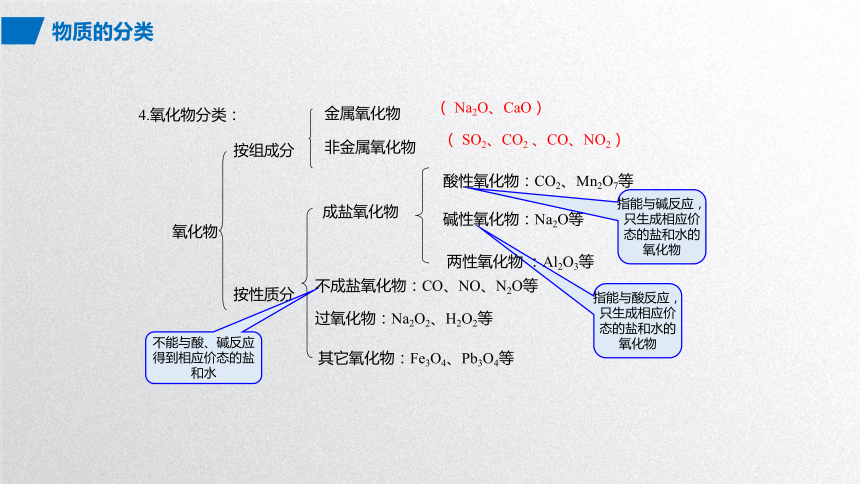
4.氧化物分类:
氧化物
按组成分
按性质分
金属氧化物
非金属氧化物
( SO2、CO2 、CO、NO2)
( Na2O、CaO)
不能与酸、碱反应
得到相应价态的盐和水
成盐氧化物
不成盐氧化物:CO、NO、N2O等
过氧化物:Na2O2、H2O2等
其它氧化物:Fe3O4、Pb3O4等
酸性氧化物:CO2、Mn2O7等
碱性氧化物:Na2O等
两性氧化物 :Al2O3等
指能与碱反应,只生成相应价态的盐和水的氧化物
物质的分类
氧化物的分类
(1)酸性氧化物:与水反应只生成相应价态的酸,或与碱反应只生成一种盐和水的氧化物。
如:SO2 + H2O === H2SO3; SO2 + 2NaOH === Na2SO3 + H2O
(2)碱性氧化物:与水反应只生成相应价态的碱,或与酸反应只生成一种盐和水的氧化物。
如:Na2O + H2O === 2NaOH;Na2O + 2HCl === 2NaCl + H2O
物质的分类
易错提醒:
(1)碱性氧化物一定是金属氧化物。
(2)金属氧化物不一定是碱性氧化物,如Mn2O7。
(3)酸性氧化物不一定是非金属氧化物,如Mn2O7。
(4)非金属氧化物不一定是酸性氧化物,如CO。
物质的分类
2. 交叉分类法:同一事物按不同标准进行分类的方法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠 盐
钾 盐
硫 酸 盐
碳 酸 盐
分散系及其分类
一、分散系及其分类
1.分散系的概念:分散系是将一种(或多种)物质分散到另一种(或多种)物质得到的体系。
2. 分散系的组成
(1)分散质:被分散的物质
(2)分散剂:容纳分散质的物质
分散系及其分类
3.分散系的分类:
(1)按照分散剂的不同,可分为气溶胶、液溶胶、固溶胶。
(2)按照分散质粒子直径的大小分类(本质区别):
外观特点
举例
均一、稳定、透明
NaCl溶液、碘酒
均一、介稳
不均一、不透明、不稳定
稀豆浆、鸡蛋清、淀粉溶液
油水混合物、泥浆水
1
100
溶液
胶体
浊液
____nm
____nm
分散质粒子直径
分散系及其分类
4. 常见的胶体:(1)气溶胶:______________________________。
(2)液溶胶:____________________________________________。
(3)固溶胶:__________________________________________。
烟、云、雾
蛋白质溶液(鸡蛋清、牛奶、豆浆、血液)、淀粉溶液
有色玻璃、土壤胶体
分散质
分散剂
气
液
固
气
液
固
分散系及其分类
5.分散系的分离
(1)用_______的方法,分离胶体与浊液。
(2)用_______的方法,分离胶体与溶液。
过滤
渗析
分散系及其分类
二、Fe(OH)3胶体的制备
1.原理:_________________________________________________________;
2.步骤:往______中加入5~6滴______________溶液,继续加热直到溶液呈现________,停止加热。
沸水
饱和FeCl3
红褐色
FeCl3 + 3H2O Fe(OH)3(胶体)+ 3HCl
===
分散系及其分类
二、Fe(OH)3胶体的制备
3.注意事项:
(1)不能用自来水代替蒸馏水,因为自来水中含有________(如Cl-),会使胶体发生聚沉;
(2)不能搅拌或长时间持续________,因为会使胶粒运动加快,从而克服胶粒间的排斥力发生聚沉;
(3)为了制得浓度较大的Fe(OH)3胶体,使现象更明显,需要用FeCl3的饱和溶液。
离子
加热
分散系及其分类
胶体的性质
(1)电泳:胶体分散质微粒细小,具有巨大的比表面积(单位质量具有的表面积),能较强地吸附电性相同的离子,从而形成带电微粒(胶粒)。这些微粒在外电场的作用下会发生定向移动,如氢氧化铁胶体微粒带正电荷,在通电的情况下胶体微粒向与直流电源负极相连的一极移动,这种现象称为电泳。
(2)聚沉:胶体粒子聚集成为较大的颗粒而形成沉淀,从分散剂里析出的过程叫聚沉。可使胶体聚沉的方法有
①加酸、碱、盐的溶液;
②加带相反电荷胶粒的胶体;
③加热或搅拌。
分散系及其分类
三、丁达尔效应
CuSO4溶液 Fe(OH)3胶体
(1)概念:当光束通过胶体时,可以看到______________。
(2)应用:区别溶液与胶体。
一条光亮的“通路”
第2课时 物质的转化
第一章 物质及其变化
第一节 物质的分类及转化
总结酸、碱、盐的主要化学性质和反应类型。
掌握物质间转化的规律和方法。
学习目标
01
02
新课导入
大自然的创造——世界上最奇妙的转化
空气中的氮气(N2)
氮氧化物、氮肥
发生化学反应
思考与讨论
酸性氧化物除了能与碱反应生成盐和水,还能发生什么反应?请以CO2为例试着分析一下。
CO2+2NaOH == Na2CO3 +H2O
CO2+H2O == H2CO3
CO2+CaO == CaCO3
部分与水反应生成对应酸
与碱反应生成对应盐和水
与碱性氧化物反应生成对应盐和水
能溶于水的含氧酸,对应的酸性氧化物一般能与水反应生成对应酸。
思考与讨论
碱性氧化物除了能与碱反应生成盐和水,还能发生什么反应?请以CaO为例试着分析一下。
CaO+H2O == Ca(OH)2
CaO+H2SO4 == CaSO4+H2O
CaO+CO2 == CaCO3
与酸反应生成对应盐和水
部分与水反应生成对应碱
能溶于水的碱,对应的酸性氧化物一般能与水反应生成对应酸。
与碱性氧化物反应生成对应盐和水
氧化物的主要性质
化学性质 发生反应
酸性 氧化物 部分与水反应
与碱反应
与碱性氧化物
碱性 氧化物 部分与水反应
与酸反应
与酸性氧化物
CO2+2NaOH == Na2CO3 +H2O
CO2+H2O == H2CO3
CO2+CaO == CaCO3
CaO+H2O == Ca(OH)2
CaO+H2SO4 == CaSO4+H2O
CaO+CO2 == CaCO3
思考与讨论
写出稀盐酸与NaOH Fe Fe2O3 Na2CO3反应的化学方程式。
Fe+2HCl == FeCl2+H2↑
Fe2O3+6HCl == 2FeCl3+3H2O
NaOH+HCl == NaCl+H2O
Na2CO3+2HCl == 2NaCl+H2O+CO2 ↑
碱 金属单质 碱性氧化物 盐
复分解反应
置换反应
复分解反应
复分解反应
酸的通性
酸的通性 反应条件 反应类型
指示剂 使紫色石蕊试液变红色,无色酚酞试液不变色
活泼金属 置换反应
碱性氧化物 复分解反应
碱 复分解反应
某些盐 复分解反应
酸+活泼金属 →盐+氢气
酸+金属氧化物→盐+水
酸+碱→盐+水
酸和碱是一组相对应的概念,你能依据酸的通性推测碱的通性吗?
生成沉淀/气体/水
碱的通性
碱的通性 反应特征 反应类型
指示剂 使紫色石蕊试液变蓝色,无色酚酞试液变红色
酸
酸性氧化物
某些盐
酸+碱→盐+水
碱+酸性氧化物→盐+水
复分解反应
复分解反应
复分解反应
生成沉淀/气体/水
思考与讨论
为什么酸和碱具有“通性”呢?
因为凡是酸溶液中都含有H+,所以酸具有相似的化学性质。
碱都具有OH-,所以碱都具有相似的性质。
盐类也具有类似的“通性”吗?
思考与讨论
判断下列物质混合后能否发生反应,如果能请写出化学方程式。
Fe +CuSO4
CaCO3+2HCl
NaOH+CuSO4
NaCl+AgNO3
Fe +CuSO4 == Cu+FeSO4
CaCO3+2HCl == CaCl2+H2O+CO2↑
2NaOH+CuSO4 == Cu(OH)2↓+Na2SO4
NaCl+AgNO3 == AgCl↓+NaNO3
盐的主要性质
物质类别 反应特征 反应类型
活泼金属
某些酸
某些碱
某些盐
复分解反应
活泼金属+不活泼金属盐→不活泼金属+活泼金属盐
置换反应
复分解反应
复分解反应
Fe +CuSO4 == Cu+FeSO4
CaCO3+2HCl == CaCl2+H2O+CO2↑
2NaOH+CuSO4 == Cu(OH)2↓+Na2SO4
NaCl+AgNO3 == AgCl↓+NaNO3
生成沉淀/气体/水
生成沉淀/气体/水
生成沉淀/ 体/水
思考与讨论
现有一单质钙,你能利用本节课所学知识,将其转化为硫酸钙吗?
Ca →CaO→Ca(OH)2 →CaSO4
2Ca+O2 == 2CaO
CaO+H2O == Ca(OH)2
Ca(OH)2+H2SO4 == CaSO4+ 2H2O
思考与讨论
现有一单质碳,你能利用本节课所学知识,将其转化为碳酸钙吗?
C→CO2→H2CO3 →CaCO3
CO2+ H2O == H2CO3
C + O2 == CO2
H2CO3+ Ca(OH)2 == CaCO3↓+ 2H2O
物质间的转化
观察下列转化关系,从物质分类的角度,你发现了什么规律?
C→CO2→H2CO3 →CaCO3
Ca →CaO→Ca(OH)2 →CaCO3
金属
碱性氧化物
碱
盐
非金属
酸性氧化物
酸
盐
注意:物质转化的几个不一定
1.不是所有的酸和金属都能反应,且反应也不一定生成H2。如铜不与稀硫酸、稀盐酸反应;铜与浓硝酸反应不生成H2。
2.非金属氧化物不一定与水反应生成酸。如CO、NO等不能与水反应。
3.金属氧化物不一定与水反应生成碱。如CuO、Fe2O3等不能与水反应。
物质间的转化
第1课时 物质的分类
第一章 物质及其变化
第一节 物质的分类及转化
根据物质的组成和性质可以对物质进行分类。
感受分类方法对化学研究和学习化学的重要作用,体会日常生产、生活中分类法的应用。
03
知道胶体是一种常见的分散系和胶体的丁达尔效应。
学习目标
01
02
新课导入
超市商品按一定类别进行陈列
新课导入
餐牌里的分类
物质的分类
一、同素异形体
1. 定义:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
2. 实例:金刚石、石墨和C60;O2和O3;红磷和白磷。
3. 产生原因:
(1)组成分子的原子数目和成键方式不同,如:氧气(O2)和臭氧(O3)。
(2)原子的排列方式不同,如:金刚石和石墨。
二、物质的分类方法
1. 树状分类法:按照一定标准对同类事物进行再分类。
如:
物质
纯净物
单质
金属单质:K、Ca、Na、Fe、Cu…..
非金属单质:H2、O2、C、S、P…..
化合物
有机化合物
混合物
无机化合物
氧化物
酸
碱
盐
……
强酸:______、_____、_____、_____
弱酸:H2CO3、CH3COOH等
强碱:_____、______、______、_____
弱碱:NH3 · H2O、Mg(OH)2等
H2SO4
HCl
HNO3
HClO4
KOH
NaOH
Ca(OH)2
Ba(OH)2
稀有气体
物质的分类
物质的分类
1.酸的分类:
按是否含氧分
酸
含氧酸
无氧酸
HNO3
HCl
电离出的阳离子全部是氢离子(H+)的化合物
按酸性强弱
强酸
CH3COOH、H2CO3等
中强酸
H3PO4、H2SO3等
弱酸
HCl、H2SO4、HNO3、HBr、HI、HClO4
物质的分类
2.碱的分类:
电离出的阴离子全部是氢氧离子(OH-)的化合物
按是否可溶
碱
可溶性碱
不溶性碱
按碱性强弱
强碱
弱碱
Mg(OH)2、Cu(OH)2、 Fe(OH)3
KOH
Ca(OH)2
Fe(OH)3
NH3·H2O
按提供的OH-个数
一元碱:
二元碱:
多元碱:
…………
NaOH、KOH、Ba(OH)2
NaOH、KOH
物质的分类
3.盐的分类:
由金属阳离子(或)和酸根离子构成的化合物
盐
按溶解性
可溶盐
难溶盐
NaCl、AgNO3、CuSO4、NH4Cl
CaCO3、 BaCO3 、BaSO4
按组成和性质分
正盐
酸式盐
碱式盐
复盐
Na2CO3
K2SO4
NaHCO3
KHSO4
Cu2(OH)2CO3
KAl(SO4)2、(NH4)2Fe(SO4)2
…………
物质的分类
指能与酸反应,只生成相应价态的盐和水的氧化物
4.氧化物分类:
氧化物
按组成分
按性质分
金属氧化物
非金属氧化物
( SO2、CO2 、CO、NO2)
( Na2O、CaO)
不能与酸、碱反应
得到相应价态的盐和水
成盐氧化物
不成盐氧化物:CO、NO、N2O等
过氧化物:Na2O2、H2O2等
其它氧化物:Fe3O4、Pb3O4等
酸性氧化物:CO2、Mn2O7等
碱性氧化物:Na2O等
两性氧化物 :Al2O3等
指能与碱反应,只生成相应价态的盐和水的氧化物
物质的分类
氧化物的分类
(1)酸性氧化物:与水反应只生成相应价态的酸,或与碱反应只生成一种盐和水的氧化物。
如:SO2 + H2O === H2SO3; SO2 + 2NaOH === Na2SO3 + H2O
(2)碱性氧化物:与水反应只生成相应价态的碱,或与酸反应只生成一种盐和水的氧化物。
如:Na2O + H2O === 2NaOH;Na2O + 2HCl === 2NaCl + H2O
物质的分类
易错提醒:
(1)碱性氧化物一定是金属氧化物。
(2)金属氧化物不一定是碱性氧化物,如Mn2O7。
(3)酸性氧化物不一定是非金属氧化物,如Mn2O7。
(4)非金属氧化物不一定是酸性氧化物,如CO。
物质的分类
2. 交叉分类法:同一事物按不同标准进行分类的方法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠 盐
钾 盐
硫 酸 盐
碳 酸 盐
分散系及其分类
一、分散系及其分类
1.分散系的概念:分散系是将一种(或多种)物质分散到另一种(或多种)物质得到的体系。
2. 分散系的组成
(1)分散质:被分散的物质
(2)分散剂:容纳分散质的物质
分散系及其分类
3.分散系的分类:
(1)按照分散剂的不同,可分为气溶胶、液溶胶、固溶胶。
(2)按照分散质粒子直径的大小分类(本质区别):
外观特点
举例
均一、稳定、透明
NaCl溶液、碘酒
均一、介稳
不均一、不透明、不稳定
稀豆浆、鸡蛋清、淀粉溶液
油水混合物、泥浆水
1
100
溶液
胶体
浊液
____nm
____nm
分散质粒子直径
分散系及其分类
4. 常见的胶体:(1)气溶胶:______________________________。
(2)液溶胶:____________________________________________。
(3)固溶胶:__________________________________________。
烟、云、雾
蛋白质溶液(鸡蛋清、牛奶、豆浆、血液)、淀粉溶液
有色玻璃、土壤胶体
分散质
分散剂
气
液
固
气
液
固
分散系及其分类
5.分散系的分离
(1)用_______的方法,分离胶体与浊液。
(2)用_______的方法,分离胶体与溶液。
过滤
渗析
分散系及其分类
二、Fe(OH)3胶体的制备
1.原理:_________________________________________________________;
2.步骤:往______中加入5~6滴______________溶液,继续加热直到溶液呈现________,停止加热。
沸水
饱和FeCl3
红褐色
FeCl3 + 3H2O Fe(OH)3(胶体)+ 3HCl
===
分散系及其分类
二、Fe(OH)3胶体的制备
3.注意事项:
(1)不能用自来水代替蒸馏水,因为自来水中含有________(如Cl-),会使胶体发生聚沉;
(2)不能搅拌或长时间持续________,因为会使胶粒运动加快,从而克服胶粒间的排斥力发生聚沉;
(3)为了制得浓度较大的Fe(OH)3胶体,使现象更明显,需要用FeCl3的饱和溶液。
离子
加热
分散系及其分类
胶体的性质
(1)电泳:胶体分散质微粒细小,具有巨大的比表面积(单位质量具有的表面积),能较强地吸附电性相同的离子,从而形成带电微粒(胶粒)。这些微粒在外电场的作用下会发生定向移动,如氢氧化铁胶体微粒带正电荷,在通电的情况下胶体微粒向与直流电源负极相连的一极移动,这种现象称为电泳。
(2)聚沉:胶体粒子聚集成为较大的颗粒而形成沉淀,从分散剂里析出的过程叫聚沉。可使胶体聚沉的方法有
①加酸、碱、盐的溶液;
②加带相反电荷胶粒的胶体;
③加热或搅拌。
分散系及其分类
三、丁达尔效应
CuSO4溶液 Fe(OH)3胶体
(1)概念:当光束通过胶体时,可以看到______________。
(2)应用:区别溶液与胶体。
一条光亮的“通路”
第2课时 物质的转化
第一章 物质及其变化
第一节 物质的分类及转化
总结酸、碱、盐的主要化学性质和反应类型。
掌握物质间转化的规律和方法。
学习目标
01
02
新课导入
大自然的创造——世界上最奇妙的转化
空气中的氮气(N2)
氮氧化物、氮肥
发生化学反应
思考与讨论
酸性氧化物除了能与碱反应生成盐和水,还能发生什么反应?请以CO2为例试着分析一下。
CO2+2NaOH == Na2CO3 +H2O
CO2+H2O == H2CO3
CO2+CaO == CaCO3
部分与水反应生成对应酸
与碱反应生成对应盐和水
与碱性氧化物反应生成对应盐和水
能溶于水的含氧酸,对应的酸性氧化物一般能与水反应生成对应酸。
思考与讨论
碱性氧化物除了能与碱反应生成盐和水,还能发生什么反应?请以CaO为例试着分析一下。
CaO+H2O == Ca(OH)2
CaO+H2SO4 == CaSO4+H2O
CaO+CO2 == CaCO3
与酸反应生成对应盐和水
部分与水反应生成对应碱
能溶于水的碱,对应的酸性氧化物一般能与水反应生成对应酸。
与碱性氧化物反应生成对应盐和水
氧化物的主要性质
化学性质 发生反应
酸性 氧化物 部分与水反应
与碱反应
与碱性氧化物
碱性 氧化物 部分与水反应
与酸反应
与酸性氧化物
CO2+2NaOH == Na2CO3 +H2O
CO2+H2O == H2CO3
CO2+CaO == CaCO3
CaO+H2O == Ca(OH)2
CaO+H2SO4 == CaSO4+H2O
CaO+CO2 == CaCO3
思考与讨论
写出稀盐酸与NaOH Fe Fe2O3 Na2CO3反应的化学方程式。
Fe+2HCl == FeCl2+H2↑
Fe2O3+6HCl == 2FeCl3+3H2O
NaOH+HCl == NaCl+H2O
Na2CO3+2HCl == 2NaCl+H2O+CO2 ↑
碱 金属单质 碱性氧化物 盐
复分解反应
置换反应
复分解反应
复分解反应
酸的通性
酸的通性 反应条件 反应类型
指示剂 使紫色石蕊试液变红色,无色酚酞试液不变色
活泼金属 置换反应
碱性氧化物 复分解反应
碱 复分解反应
某些盐 复分解反应
酸+活泼金属 →盐+氢气
酸+金属氧化物→盐+水
酸+碱→盐+水
酸和碱是一组相对应的概念,你能依据酸的通性推测碱的通性吗?
生成沉淀/气体/水
碱的通性
碱的通性 反应特征 反应类型
指示剂 使紫色石蕊试液变蓝色,无色酚酞试液变红色
酸
酸性氧化物
某些盐
酸+碱→盐+水
碱+酸性氧化物→盐+水
复分解反应
复分解反应
复分解反应
生成沉淀/气体/水
思考与讨论
为什么酸和碱具有“通性”呢?
因为凡是酸溶液中都含有H+,所以酸具有相似的化学性质。
碱都具有OH-,所以碱都具有相似的性质。
盐类也具有类似的“通性”吗?
思考与讨论
判断下列物质混合后能否发生反应,如果能请写出化学方程式。
Fe +CuSO4
CaCO3+2HCl
NaOH+CuSO4
NaCl+AgNO3
Fe +CuSO4 == Cu+FeSO4
CaCO3+2HCl == CaCl2+H2O+CO2↑
2NaOH+CuSO4 == Cu(OH)2↓+Na2SO4
NaCl+AgNO3 == AgCl↓+NaNO3
盐的主要性质
物质类别 反应特征 反应类型
活泼金属
某些酸
某些碱
某些盐
复分解反应
活泼金属+不活泼金属盐→不活泼金属+活泼金属盐
置换反应
复分解反应
复分解反应
Fe +CuSO4 == Cu+FeSO4
CaCO3+2HCl == CaCl2+H2O+CO2↑
2NaOH+CuSO4 == Cu(OH)2↓+Na2SO4
NaCl+AgNO3 == AgCl↓+NaNO3
生成沉淀/气体/水
生成沉淀/气体/水
生成沉淀/ 体/水
思考与讨论
现有一单质钙,你能利用本节课所学知识,将其转化为硫酸钙吗?
Ca →CaO→Ca(OH)2 →CaSO4
2Ca+O2 == 2CaO
CaO+H2O == Ca(OH)2
Ca(OH)2+H2SO4 == CaSO4+ 2H2O
思考与讨论
现有一单质碳,你能利用本节课所学知识,将其转化为碳酸钙吗?
C→CO2→H2CO3 →CaCO3
CO2+ H2O == H2CO3
C + O2 == CO2
H2CO3+ Ca(OH)2 == CaCO3↓+ 2H2O
物质间的转化
观察下列转化关系,从物质分类的角度,你发现了什么规律?
C→CO2→H2CO3 →CaCO3
Ca →CaO→Ca(OH)2 →CaCO3
金属
碱性氧化物
碱
盐
非金属
酸性氧化物
酸
盐
注意:物质转化的几个不一定
1.不是所有的酸和金属都能反应,且反应也不一定生成H2。如铜不与稀硫酸、稀盐酸反应;铜与浓硝酸反应不生成H2。
2.非金属氧化物不一定与水反应生成酸。如CO、NO等不能与水反应。
3.金属氧化物不一定与水反应生成碱。如CuO、Fe2O3等不能与水反应。
物质间的转化
