5.1.1 硫和二氧化硫 课件(共29张PPT)
文档属性
| 名称 | 5.1.1 硫和二氧化硫 课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-04 10:05:03 | ||
图片预览







文档简介
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫和二氧化硫
“人间炼狱”
印尼伊真火山
为什么火山会有这样颜色的火焰?这种颜色的火焰是有什么引起的呢?
硫磺
新课导入
一、硫原子的结构
+16
2
8
6
原子结构示意图:
问:大家还记得它有哪些化合价吗?化合价与结构是什么关系?
硫的最低负价是-2价,最高正价是+6价,其与原子的最外层电子数有关
问:我们一般说非金属具有氧化性,那么氧的得电子能力强还是硫的得电子能力强?
根据氧和硫在元素周期表中的位置,我们可知它们的氧化性氧原子强
知识梳理
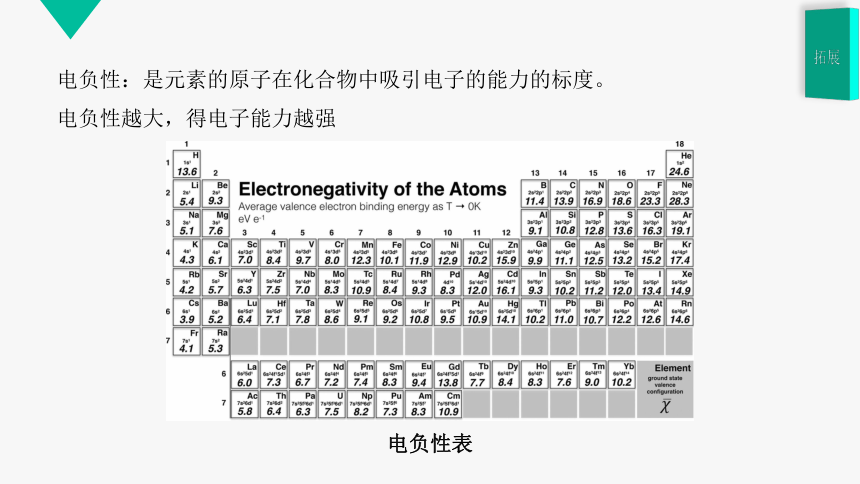
电负性:是元素的原子在化合物中吸引电子的能力的标度。
电负性越大,得电子能力越强
拓展
电负性表
结构 性质
决定
二、单质硫的性质
1.物理性质
黄色晶体,质脆,易研成粉末,不溶于水,微溶于酒精,易溶于CS2。
硫磺
(存在于火山口附近或地壳的岩层里)
硫在水中的硫结晶
可用二硫化碳作为洗涤剂清洗附着在试管壁上的硫
熔点:113℃
沸点:445℃
密度:2.06 g/cm3
-2
0
+4
+6
S
硫单质的化学性质如何体现呢?
氧化性
还原性
2.硫的化学性质
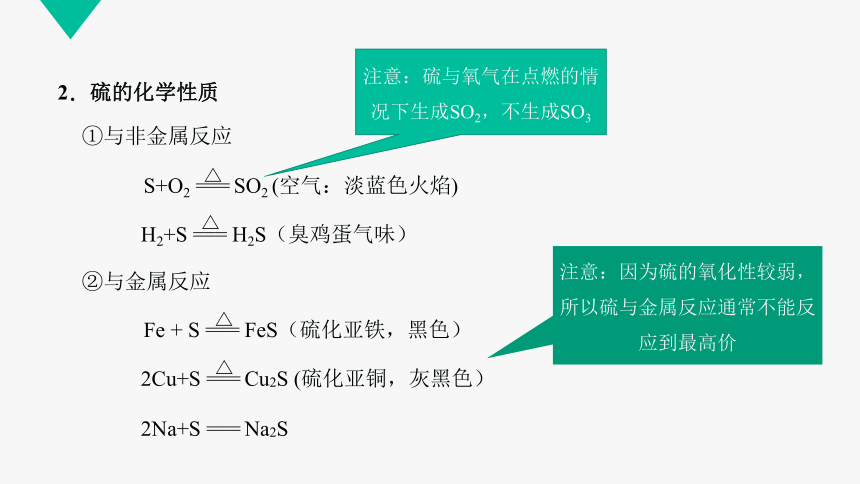
①与非金属反应
△
H2+S === H2S(臭鸡蛋气味)
△
S+O2 === SO2 (空气:淡蓝色火焰)
注意:硫与氧气在点燃的情况下生成SO2,不生成SO3
②与金属反应
2Na+S === Na2S
2Cu+S === Cu2S (硫化亚铜,灰黑色)
△
△
Fe + S === FeS(硫化亚铁,黑色)
注意:因为硫的氧化性较弱,所以硫与金属反应通常不能反应到最高价
③跟其他物质反应
S与碱反应:
3S+6KOH === 2K2S+K2SO3+3H2O
S与强氧化剂反应:
歧化反应
归中反应
S+2H2SO4(浓) === 3SO2↑+2H2O
△
二氧化硫
是常见的硫的氧化物
但是二氧化硫有毒。无论是化学实验还是工业生产都不能向空气中排放SO2
二氧化硫检测仪
三、二氧化硫的性质及用途
1.物理性质
颜色
状态
气味
毒性
密度
水溶性
____
____
_______气味
____
比空气___
易溶于水
无色
气态
刺激性
有毒
大
2.化学性质
(1)酸性氧化物的通性(硫的化合价不变,为+4价)。
Na2O+SO2 === Na2SO3
Na2CO3+SO2 === Na2SO3+CO2
SO2+2NaOH === Na2SO3+H2O
SO2+NaOH === NaHSO3
SO2+H2O H2SO3
可逆反应:
1.双向性
2.同时性
3.共存性(各反应物、生成物共存)
葡萄酒的酿造,可以看作葡萄糖被O2氧化转变为酒精和二氧化碳的过程。在葡萄酒的储存过程中,为了保证葡萄酒的甘甜,需要一些物质来防止其中的糖类被继续氧化, SO2可以起到这样的作用。
阅读材料:这里SO2体现了什么性质?
从化合价的角度分析SO2有什么性质?
既有氧化性又有还原性
(2)弱氧化性
与H2S反应生成S和H2O,其反应的化学方程式为
___________________________________。
(3)强还原性
①催化氧化的化学方程式:___________________。
②与酸性高锰酸钾溶液反应的现象:溶液_________。
③与溴水反应的现象:溴水_________;
化学方程式:________________________________________。
2H2S+SO2===3S↓+2H2O
Br2+SO2+2H2O === 2HBr+H2SO4
2SO2+O2 2SO3
催化剂
△
褪色
褪色
(4) 向一支试管中加入品红溶液,通入SO2,振荡,观察实验现象;将上述溶液加热,观察现象。
现象: 品红褪色,加热恢复红色
SO2具有漂白性
与有机色素结合成不稳定的无色物质,是化合反应。
SO2还原KMnO4等无机物不能称为漂白性。
市场黄白两种银耳对比
丑小鸭
白天鹅
不可使用于食品漂白,但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
漂白剂的种类
1.吸附性漂白:活性炭;
2.氧化性漂白:HClO、H2O2、Na2O2、O3等;
3.非氧化性漂白:SO2
特点:物理变化
特点:氧化还原反应,不可逆,漂白稳定。
特点:化合反应,可逆,漂白不稳定。
3.用途
制硫酸
制漂白剂
消毒剂
防腐剂
二氧化硫
分类观
(酸性氧化物
与CO2类似)
价态观
(还原性和
弱氧化性)
特性——漂白性:使品红溶液褪色
SO2+H2O H2SO3
SO2+NaOH === Na2SO3+H2O
SO2+Ca(OH)2 === CaSO3+H2O
2SO2+Ca(OH)2 === Ca(HSO3)2
2SO2+O2 2SO3
2H2SO3+O2 === 2H2SO4
SO2+I2+2H2O === H2SO4+2HI
H2O2+SO2 === H2SO4
2H2S+SO2 === 3S↓+2H2O
催化剂
△
知识小结
1.SO2可用作红酒的防腐剂。下列关于SO2的叙述错误的是( ??)
A.无色无味气体????????????????????????????????????????B.能与氢氧化钠溶液反应
C.能使品红溶液褪色?????????????????????????????????D.一定条件下,能与氧气反应
A
2.将 SO2 气体通入 BaCl2 溶液,无明显现象,然后再通人 X 气体或加入 X 溶液,有白色沉淀生成,X 不可能是( ? ?)
A.Cl2??????? B.CO2 C.氨水 D.H2O2??????????????????
B
当堂检测
3.如图所示的实验装置,
(1)装置⑥是实验室制二氧化硫的方法,请写出其化学方程式
。
(2)当装置⑥产生SO2后,装置①的石蕊试液 ,装置②的品红溶液 ,
装置③的H2S ,写出其化学方程式 ,装置④的现象 。
H2SO4+Na2SO3 === Na2SO4+SO2↑+H2O
变红
褪色
产生黄色沉淀
2H2S+SO2 === 3S↓+2H2O
褪色
(3)若有装置⑦装有溴水,连于装置④之后,若装置④未完全褪色,则装置⑦的现象为 ,若装置④完全褪色,则装置⑦的现象为 。
(4)当装置⑤的作用为 ,化学方程式为
。
无现象
除去尾气中的SO2
褪色
SO2+2NaOH === Na2SO3+H2O
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验
记录
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色沉淀
C
红色
红色
白色沉淀
白色溶液
D
无色
无色
白色沉淀
无色溶液
4.下列有关SO2的性质的探究实验报告记录的实验现象正确的是(?? )
D
5.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。在隔绝空气条件下,绿矾高温分解的反应为:FeSO4·7H2O →高温 Fe2O3+SO2↑+SO3↑+H2O(未配平)。回答下列问题:
(1)缺铁性贫血患者应补充Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是 ____________________________;
?
防止Fe2+被氧化
(2)将绿矾分解产生的气体,依次通过下图装置,观察到试管甲中有白色沉淀产生,该白色沉淀是________?(填化学式):试管乙中的现象是________;试管丙中溶液褪色,体现了SO2的________性;试管丁中溶液变浑浊,写出发生反应的化学方程式__________________________?。
BaSO4
还原
2H2S+SO2 === 3S↓+2H2O
褪色
本节内容结束
第一节 硫及其化合物
第1课时 硫和二氧化硫
“人间炼狱”
印尼伊真火山
为什么火山会有这样颜色的火焰?这种颜色的火焰是有什么引起的呢?
硫磺
新课导入
一、硫原子的结构
+16
2
8
6
原子结构示意图:
问:大家还记得它有哪些化合价吗?化合价与结构是什么关系?
硫的最低负价是-2价,最高正价是+6价,其与原子的最外层电子数有关
问:我们一般说非金属具有氧化性,那么氧的得电子能力强还是硫的得电子能力强?
根据氧和硫在元素周期表中的位置,我们可知它们的氧化性氧原子强
知识梳理
电负性:是元素的原子在化合物中吸引电子的能力的标度。
电负性越大,得电子能力越强
拓展
电负性表
结构 性质
决定
二、单质硫的性质
1.物理性质
黄色晶体,质脆,易研成粉末,不溶于水,微溶于酒精,易溶于CS2。
硫磺
(存在于火山口附近或地壳的岩层里)
硫在水中的硫结晶
可用二硫化碳作为洗涤剂清洗附着在试管壁上的硫
熔点:113℃
沸点:445℃
密度:2.06 g/cm3
-2
0
+4
+6
S
硫单质的化学性质如何体现呢?
氧化性
还原性
2.硫的化学性质
①与非金属反应
△
H2+S === H2S(臭鸡蛋气味)
△
S+O2 === SO2 (空气:淡蓝色火焰)
注意:硫与氧气在点燃的情况下生成SO2,不生成SO3
②与金属反应
2Na+S === Na2S
2Cu+S === Cu2S (硫化亚铜,灰黑色)
△
△
Fe + S === FeS(硫化亚铁,黑色)
注意:因为硫的氧化性较弱,所以硫与金属反应通常不能反应到最高价
③跟其他物质反应
S与碱反应:
3S+6KOH === 2K2S+K2SO3+3H2O
S与强氧化剂反应:
歧化反应
归中反应
S+2H2SO4(浓) === 3SO2↑+2H2O
△
二氧化硫
是常见的硫的氧化物
但是二氧化硫有毒。无论是化学实验还是工业生产都不能向空气中排放SO2
二氧化硫检测仪
三、二氧化硫的性质及用途
1.物理性质
颜色
状态
气味
毒性
密度
水溶性
____
____
_______气味
____
比空气___
易溶于水
无色
气态
刺激性
有毒
大
2.化学性质
(1)酸性氧化物的通性(硫的化合价不变,为+4价)。
Na2O+SO2 === Na2SO3
Na2CO3+SO2 === Na2SO3+CO2
SO2+2NaOH === Na2SO3+H2O
SO2+NaOH === NaHSO3
SO2+H2O H2SO3
可逆反应:
1.双向性
2.同时性
3.共存性(各反应物、生成物共存)
葡萄酒的酿造,可以看作葡萄糖被O2氧化转变为酒精和二氧化碳的过程。在葡萄酒的储存过程中,为了保证葡萄酒的甘甜,需要一些物质来防止其中的糖类被继续氧化, SO2可以起到这样的作用。
阅读材料:这里SO2体现了什么性质?
从化合价的角度分析SO2有什么性质?
既有氧化性又有还原性
(2)弱氧化性
与H2S反应生成S和H2O,其反应的化学方程式为
___________________________________。
(3)强还原性
①催化氧化的化学方程式:___________________。
②与酸性高锰酸钾溶液反应的现象:溶液_________。
③与溴水反应的现象:溴水_________;
化学方程式:________________________________________。
2H2S+SO2===3S↓+2H2O
Br2+SO2+2H2O === 2HBr+H2SO4
2SO2+O2 2SO3
催化剂
△
褪色
褪色
(4) 向一支试管中加入品红溶液,通入SO2,振荡,观察实验现象;将上述溶液加热,观察现象。
现象: 品红褪色,加热恢复红色
SO2具有漂白性
与有机色素结合成不稳定的无色物质,是化合反应。
SO2还原KMnO4等无机物不能称为漂白性。
市场黄白两种银耳对比
丑小鸭
白天鹅
不可使用于食品漂白,但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
漂白剂的种类
1.吸附性漂白:活性炭;
2.氧化性漂白:HClO、H2O2、Na2O2、O3等;
3.非氧化性漂白:SO2
特点:物理变化
特点:氧化还原反应,不可逆,漂白稳定。
特点:化合反应,可逆,漂白不稳定。
3.用途
制硫酸
制漂白剂
消毒剂
防腐剂
二氧化硫
分类观
(酸性氧化物
与CO2类似)
价态观
(还原性和
弱氧化性)
特性——漂白性:使品红溶液褪色
SO2+H2O H2SO3
SO2+NaOH === Na2SO3+H2O
SO2+Ca(OH)2 === CaSO3+H2O
2SO2+Ca(OH)2 === Ca(HSO3)2
2SO2+O2 2SO3
2H2SO3+O2 === 2H2SO4
SO2+I2+2H2O === H2SO4+2HI
H2O2+SO2 === H2SO4
2H2S+SO2 === 3S↓+2H2O
催化剂
△
知识小结
1.SO2可用作红酒的防腐剂。下列关于SO2的叙述错误的是( ??)
A.无色无味气体????????????????????????????????????????B.能与氢氧化钠溶液反应
C.能使品红溶液褪色?????????????????????????????????D.一定条件下,能与氧气反应
A
2.将 SO2 气体通入 BaCl2 溶液,无明显现象,然后再通人 X 气体或加入 X 溶液,有白色沉淀生成,X 不可能是( ? ?)
A.Cl2??????? B.CO2 C.氨水 D.H2O2??????????????????
B
当堂检测
3.如图所示的实验装置,
(1)装置⑥是实验室制二氧化硫的方法,请写出其化学方程式
。
(2)当装置⑥产生SO2后,装置①的石蕊试液 ,装置②的品红溶液 ,
装置③的H2S ,写出其化学方程式 ,装置④的现象 。
H2SO4+Na2SO3 === Na2SO4+SO2↑+H2O
变红
褪色
产生黄色沉淀
2H2S+SO2 === 3S↓+2H2O
褪色
(3)若有装置⑦装有溴水,连于装置④之后,若装置④未完全褪色,则装置⑦的现象为 ,若装置④完全褪色,则装置⑦的现象为 。
(4)当装置⑤的作用为 ,化学方程式为
。
无现象
除去尾气中的SO2
褪色
SO2+2NaOH === Na2SO3+H2O
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验
记录
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色沉淀
C
红色
红色
白色沉淀
白色溶液
D
无色
无色
白色沉淀
无色溶液
4.下列有关SO2的性质的探究实验报告记录的实验现象正确的是(?? )
D
5.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。在隔绝空气条件下,绿矾高温分解的反应为:FeSO4·7H2O →高温 Fe2O3+SO2↑+SO3↑+H2O(未配平)。回答下列问题:
(1)缺铁性贫血患者应补充Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是 ____________________________;
?
防止Fe2+被氧化
(2)将绿矾分解产生的气体,依次通过下图装置,观察到试管甲中有白色沉淀产生,该白色沉淀是________?(填化学式):试管乙中的现象是________;试管丙中溶液褪色,体现了SO2的________性;试管丁中溶液变浑浊,写出发生反应的化学方程式__________________________?。
BaSO4
还原
2H2S+SO2 === 3S↓+2H2O
褪色
本节内容结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
