化学人教版(2019)必修第二册5.1.2硫酸(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.2硫酸(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 73.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-04 14:42:25 | ||
图片预览





文档简介
(共23张PPT)
硫及其化合物
第五章 化工生产中的重要非金属元素
第一节
第二课时 硫酸
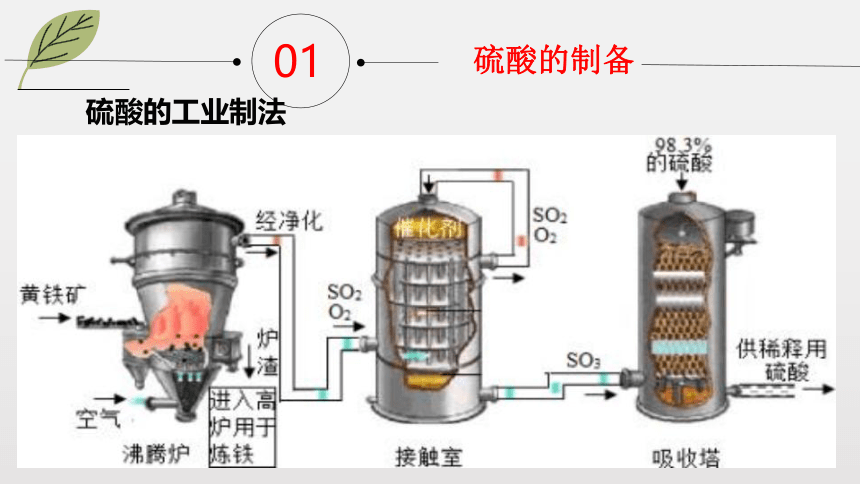
硫酸的工业制法
硫酸的制备
01
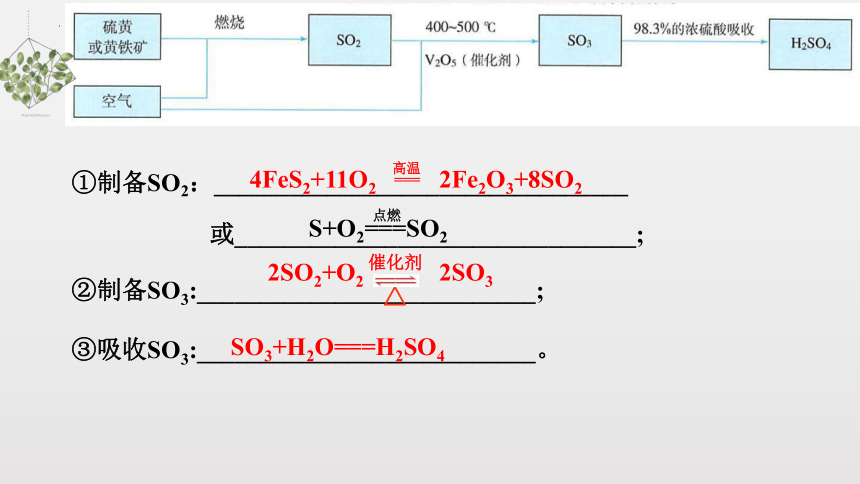
①制备SO2:_________________________________
或________________________________;
②制备SO3:___________________________;
③吸收SO3:___________________________。
SO3+H2O===H2SO4
4FeS2+11O2 2Fe2O3+8SO2
高温
===
2SO2+O2 2SO3
△
催化剂
点燃
S+O2===SO2
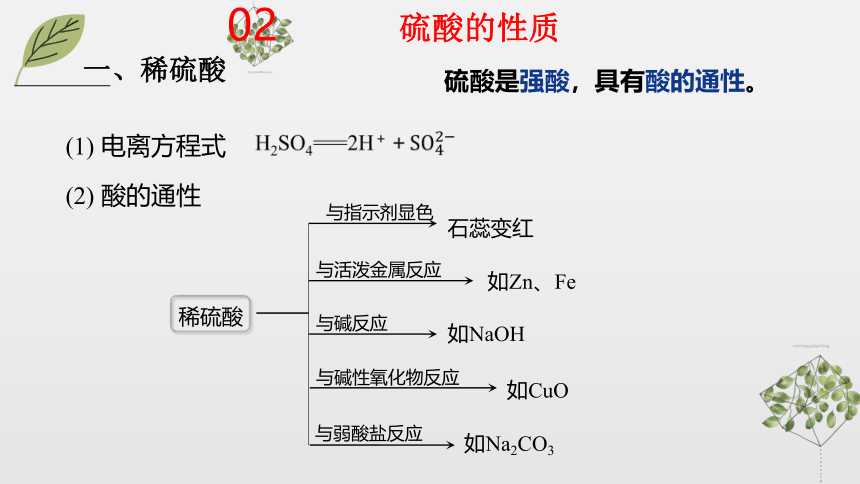
一、稀硫酸
硫酸是强酸,具有酸的通性。
(2) 酸的通性
与指示剂显色
石蕊变红
与活泼金属反应
如Zn、Fe
与碱反应
如NaOH
与碱性氧化物反应
如CuO
与弱酸盐反应
如Na2CO3
(1) 电离方程式
稀硫酸
硫酸的性质
02
1.物理性质
无色粘稠的油状液体,
高沸点(338℃),不易挥发,
98.3%的H2SO4密度1.84 g·cm-3,
与水互溶,溶于水时放出大量热。
思考:
稀释浓硫酸的操作应注意什么?
二、浓硫酸
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌。
[思考]现有失去标签的浓硫酸、浓盐酸各一瓶(瓶相同,酸体积相同),不用化学方法如何鉴别 其根据是什么
①拿起试剂瓶,掂一掂重者为浓硫酸,因为浓硫酸的密度大。
②将试剂瓶提起,摇动,呈油状、粘稠的是浓硫酸,因为浓硫酸是无色粘稠的油状液体。
③将瓶盖打开,瓶口有酸雾的是浓盐酸,因浓盐酸具有挥发性。
2.浓硫酸的化学性质
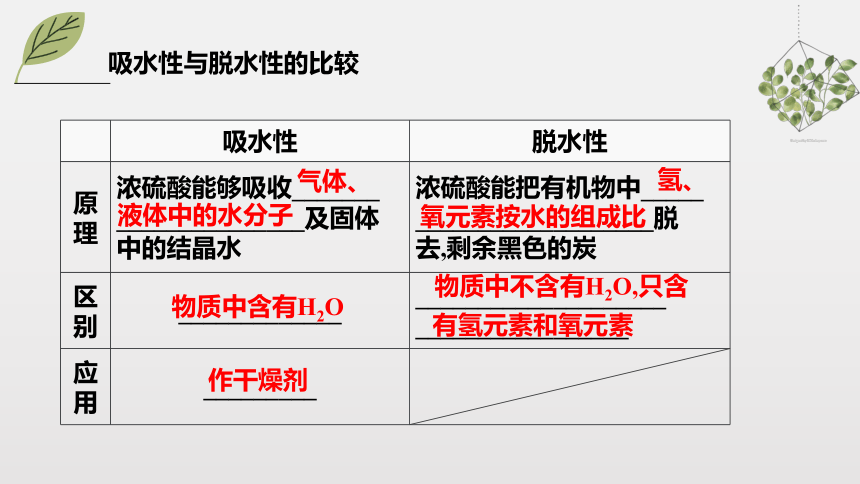
(1)吸水性:浓硫酸能吸收存在于周围环境中的水分,常用做干燥剂
可干燥: H2、O2、Cl2、CO2、SO2、N2、NO、HCl等。
不可干燥
碱性气体(NH3)、
还原性气体(H2S、HI、HBr)
(2)脱水性:浓硫酸能将有机物中的氧、氢元素按水的组成比脱去
吸水性 脱水性
原理 浓硫酸能够吸收_______ _______________及固体 中的结晶水 浓硫酸能把有机物中_____
___________________脱
去,剩余黑色的炭
区别 _____________ ____________________
_________________
应用 _________
气体、
液体中的水分子
氢、
氧元素按水的组成比
物质中含有H2O
物质中不含有H2O,只含
有氢元素和氧元素
作干燥剂
吸水性与脱水性的比较
浓硫酸与蔗糖反应
C12H22O11
浓硫酸
12C + 11H2O
(蔗糖)
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C+2H2SO4(浓) === CO2↑+2SO2↑+2H2O
a.反应需要加热
①与 非金属单质反应
b.还原产物一般是SO2
C+2H2SO4(浓) === CO2↑+2SO2↑+2H2O
(3)强氧化性
浓硫酸能氧化C、S等非金属单质,具有强氧化性
实验现象
(3)强氧化性
将a试管里的溶液慢慢倒入水中,溶液变为_____
a铜丝表面__________________________
b品红溶液逐渐变为________
c紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
②与金属的反应
2H2SO4(浓)+Cu== CuSO4+2H2O+SO2
+6
0
+2
+4
失去2e-
得到2e-
氧化剂 还原剂
表现酸性
和强氧化性
【思考与交流】
问题:(1) 该方程式中,谁是氧化剂,谁是还原剂?
(2) 浓硫酸在这个反应中体现了什么性质?
(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸让Fe、Al的钝化
设计实验方案,验证碳和浓硫酸反应的产物
检验水
无水硫酸铜
检验SO2
检验CO2
品红
澄清石灰水
C + 2H2SO4(浓) == 2SO2 ↑+ CO2↑+ 2H2O
变蓝,证明含H2O
褪色,证明含SO2
除去SO2,防止对CO2的检验产生干扰
不褪色,证明SO2已被除尽
变浑浊,证明有CO2
过量 KMnO4
石灰水
无水硫酸铜
检验水
检验
SO2
除去
SO2
检验
CO2
品红
品红
KMnO4
石灰水
无水硫酸铜
检验水
检验
SO2
除去
SO2
检验
CO2
品红
检验SO2
是否除尽
结论:检验 的正确操作方法:
被检液 取清液 有无白色沉淀产生(判断有无 )。
先加稀盐酸的目的是_______________________。
防止 、 、Ag+干扰
硫酸根离子的检验
亲爱的水:
请允许我这样叫你,每当我遇见你,我就有一种沸腾的感觉,全身会放出大量的热。当我见不到你时,我甚至会在空气中寻找你的气息,就算你让我变成稀硫酸,我对你的心也不会改变,因为我是不挥发的,这点我比硝酸强,请你不要逃避。水,没有了你,虽然我也和铁,铝接触过,但我选择了拒绝,虽然别人认为我的脾气不好,他们说我欺负金属,欺负硫化氢和硫。
小结:
浓硫酸对我的告白
天地可以证明,我只要两个电子,但这是由+6价的中心硫原子决定的,我无法改变我的脾气,我从来不欺负我的小弟二氧化硫,尽管他比我更弱,但我像对待小弟弟一样对待他,还说我欺负氢氧化钠、碳酸钠,那是因为遇到它们,可以得到你!水,请你不要再逃避,就是逃到有机物中,我也会夺取氢氧重新合成你,你逃到天涯海角,我也会找到你,水,我可以对门捷列夫发誓,我会追随你一辈子!
愿和你在一起的:98.3%浓硫酸
浓硫酸与稀硫酸的鉴别
硫酸的用途
1.高沸点——制取挥发性酸。
2.吸水性——做干燥剂。
3.脱水性——做催化剂。
4.酸性——去金属表面的氧化物、
制取硫酸盐、制造化肥。
5.强氧化性——制炸药。
下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)浓硫酸不能用来干燥硫化氢气体。
(6)碳酸钠跟稀硫酸反应生成二氧化碳气体
脱水性
吸水性
酸性
酸性和强氧化性
强氧化性
酸性
达标检测
硫及其化合物
第五章 化工生产中的重要非金属元素
第一节
第二课时 硫酸
硫酸的工业制法
硫酸的制备
01
①制备SO2:_________________________________
或________________________________;
②制备SO3:___________________________;
③吸收SO3:___________________________。
SO3+H2O===H2SO4
4FeS2+11O2 2Fe2O3+8SO2
高温
===
2SO2+O2 2SO3
△
催化剂
点燃
S+O2===SO2
一、稀硫酸
硫酸是强酸,具有酸的通性。
(2) 酸的通性
与指示剂显色
石蕊变红
与活泼金属反应
如Zn、Fe
与碱反应
如NaOH
与碱性氧化物反应
如CuO
与弱酸盐反应
如Na2CO3
(1) 电离方程式
稀硫酸
硫酸的性质
02
1.物理性质
无色粘稠的油状液体,
高沸点(338℃),不易挥发,
98.3%的H2SO4密度1.84 g·cm-3,
与水互溶,溶于水时放出大量热。
思考:
稀释浓硫酸的操作应注意什么?
二、浓硫酸
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌。
[思考]现有失去标签的浓硫酸、浓盐酸各一瓶(瓶相同,酸体积相同),不用化学方法如何鉴别 其根据是什么
①拿起试剂瓶,掂一掂重者为浓硫酸,因为浓硫酸的密度大。
②将试剂瓶提起,摇动,呈油状、粘稠的是浓硫酸,因为浓硫酸是无色粘稠的油状液体。
③将瓶盖打开,瓶口有酸雾的是浓盐酸,因浓盐酸具有挥发性。
2.浓硫酸的化学性质
(1)吸水性:浓硫酸能吸收存在于周围环境中的水分,常用做干燥剂
可干燥: H2、O2、Cl2、CO2、SO2、N2、NO、HCl等。
不可干燥
碱性气体(NH3)、
还原性气体(H2S、HI、HBr)
(2)脱水性:浓硫酸能将有机物中的氧、氢元素按水的组成比脱去
吸水性 脱水性
原理 浓硫酸能够吸收_______ _______________及固体 中的结晶水 浓硫酸能把有机物中_____
___________________脱
去,剩余黑色的炭
区别 _____________ ____________________
_________________
应用 _________
气体、
液体中的水分子
氢、
氧元素按水的组成比
物质中含有H2O
物质中不含有H2O,只含
有氢元素和氧元素
作干燥剂
吸水性与脱水性的比较
浓硫酸与蔗糖反应
C12H22O11
浓硫酸
12C + 11H2O
(蔗糖)
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C+2H2SO4(浓) === CO2↑+2SO2↑+2H2O
a.反应需要加热
①与 非金属单质反应
b.还原产物一般是SO2
C+2H2SO4(浓) === CO2↑+2SO2↑+2H2O
(3)强氧化性
浓硫酸能氧化C、S等非金属单质,具有强氧化性
实验现象
(3)强氧化性
将a试管里的溶液慢慢倒入水中,溶液变为_____
a铜丝表面__________________________
b品红溶液逐渐变为________
c紫色石蕊溶液逐渐变为________
逐渐变黑色,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
②与金属的反应
2H2SO4(浓)+Cu== CuSO4+2H2O+SO2
+6
0
+2
+4
失去2e-
得到2e-
氧化剂 还原剂
表现酸性
和强氧化性
【思考与交流】
问题:(1) 该方程式中,谁是氧化剂,谁是还原剂?
(2) 浓硫酸在这个反应中体现了什么性质?
(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
浓硫酸能和金属反应,为什么可用铝罐车和铁罐车来运输浓硫酸?
常温下,浓硫酸让Fe、Al的钝化
设计实验方案,验证碳和浓硫酸反应的产物
检验水
无水硫酸铜
检验SO2
检验CO2
品红
澄清石灰水
C + 2H2SO4(浓) == 2SO2 ↑+ CO2↑+ 2H2O
变蓝,证明含H2O
褪色,证明含SO2
除去SO2,防止对CO2的检验产生干扰
不褪色,证明SO2已被除尽
变浑浊,证明有CO2
过量 KMnO4
石灰水
无水硫酸铜
检验水
检验
SO2
除去
SO2
检验
CO2
品红
品红
KMnO4
石灰水
无水硫酸铜
检验水
检验
SO2
除去
SO2
检验
CO2
品红
检验SO2
是否除尽
结论:检验 的正确操作方法:
被检液 取清液 有无白色沉淀产生(判断有无 )。
先加稀盐酸的目的是_______________________。
防止 、 、Ag+干扰
硫酸根离子的检验
亲爱的水:
请允许我这样叫你,每当我遇见你,我就有一种沸腾的感觉,全身会放出大量的热。当我见不到你时,我甚至会在空气中寻找你的气息,就算你让我变成稀硫酸,我对你的心也不会改变,因为我是不挥发的,这点我比硝酸强,请你不要逃避。水,没有了你,虽然我也和铁,铝接触过,但我选择了拒绝,虽然别人认为我的脾气不好,他们说我欺负金属,欺负硫化氢和硫。
小结:
浓硫酸对我的告白
天地可以证明,我只要两个电子,但这是由+6价的中心硫原子决定的,我无法改变我的脾气,我从来不欺负我的小弟二氧化硫,尽管他比我更弱,但我像对待小弟弟一样对待他,还说我欺负氢氧化钠、碳酸钠,那是因为遇到它们,可以得到你!水,请你不要再逃避,就是逃到有机物中,我也会夺取氢氧重新合成你,你逃到天涯海角,我也会找到你,水,我可以对门捷列夫发誓,我会追随你一辈子!
愿和你在一起的:98.3%浓硫酸
浓硫酸与稀硫酸的鉴别
硫酸的用途
1.高沸点——制取挥发性酸。
2.吸水性——做干燥剂。
3.脱水性——做催化剂。
4.酸性——去金属表面的氧化物、
制取硫酸盐、制造化肥。
5.强氧化性——制炸药。
下列现象反映了硫酸的哪些主要性质
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)浓硫酸不能用来干燥硫化氢气体。
(6)碳酸钠跟稀硫酸反应生成二氧化碳气体
脱水性
吸水性
酸性
酸性和强氧化性
强氧化性
酸性
达标检测
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
