湖北省恩施州高中教育联盟2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 湖北省恩施州高中教育联盟2022-2023学年高二上学期期末考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 271.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-05 00:00:00 | ||
图片预览


文档简介
恩施州高中教育联盟2022-2023学年高二上学期期末考试
化学试题
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.化学与生产、生活、科技和环境等联系密切。下列有关说法正确的是
A.白鹤滩水电站首批机组投产,有利于减少CO2、SO2的排放,CO2和SO2都是大气污染物
B.利用X射线对晶体的特殊效应,可快速准确地对普通玻璃伪造的假宝石进行无损鉴定
C.“筑梦天宫”,火箭助推剂-液氧在工业上可通过分解氯酸钾制得
D.使用含磷洗涤剂不会造成水体污染
2.下列有关化学用语的描述正确的是
A.硼酸的电离方程式:H3BO3+H2O[B(OH)4]-+H+ B.四氟肼N2F4的电子式:
C.Se的基态原子简化核外电子排布式:[Ar]4s24p4
D.基态铍原子最外层的电子云轮廓图:
3.2021年9月24日,中国科学家在国际学术期刊《科学》上发表一项重大成果-首次在实验室用二氧化碳人工合成淀粉,生物酶催化剂是这项技术的关键因素。以下说法正确的是
A.合成淀粉和葡萄糖的分子式相同 B.使用生物酶大大提高了二氧化碳的平衡转化率
C.酶在任何条件下都有很高的催化效率 D.人工合成淀粉有利于推进“碳中和”目标的实现
4.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,11.2LCHCl3分子数为0.5NA B.电解精炼铜阳极质量减少6.4g时,转移电子数为0.2NA
C.23gC2H6O分子中含有碳氧健的数目一定为0.5NA D.常温常压下,17gH2O2中含有的质子数为9.NA
5.下列各组离子在给定条件下可以大量共存的是
A.1gc(H+)/c(OH-)<0的溶液中:K+、Cl-、NH4+、I-
B.0.1mol·L-1的NH4Fe(SO4)2的溶液中:Na+、NO3-、A13+、I-
C.澄清透明的溶液中:Mg2+、MnO4-、Fe3+、SO42-
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、HCO3-、Cl-、Mg2+
6.下列关于物质的结构或性质及解释均正确的是
选项 物质的结构或性质 解释
A 键角:H2O>NH3 水分子中O上孤电子对数比氨分子中N上的多
B 热稳定性:NH3>PH3 NH3分子间氢键强于PH3分子间作用力
C 熔点:晶体硅>碳化硅 Si-Si的键能大于C-Si的键能
D 电子云半径:3s>1s 3s电子能量高,在离核更远的区域出现的概率大
7.下列有关实验装置进行的实验,能达到实验目的的是
A.MnO2与浓盐酸反应制备Cl2 B.根据“侯氏制碱法”原理制备NaHCO3 C.制备Fe(OH)2白色沉淀 D.用海水制取蒸馏水
8.能正确表示下列反应的离子方程式是
A.泡沫灭火器的工作原理:2A13++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
B.草酸使酸性KMnO4溶液褪色:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
C.氢氧化铁和碘化氢溶液反应:Fe(OH)3+3H+=Fe3++3H2O
D.将少量溴水滴入过量Na2SO3溶液中:Br2+H2O+SO32-=2Br-+2H++SO42-
9.下列有关化学工业的叙述错误的是
A.工业制备硝酸的第一步反应是N2+O22NO B.氯碱工业中使用的是阳离子交换膜
C.水泥是以黏土和石灰石为主要原料,在水泥回转窑中煅烧制得的
D.合成氨反应分离氨气以后的尾气循环使用,目的是充分利用原料
10.短周期主族元素Z、W、X、Y的原子半径逐渐减小,W的最简单氢化物的水溶液呈碱性,Z的最外层电子数为内层电子总数的两倍,Y与其他元素不在
同一周期,这四种元素组成的某阴离子的结构如图所示,图中各原子最外层
均满足稳定结构。下列叙述错误的是
A.元素第一电离能和电负性均满足:X>W>Z
B.Y分别与Z、W、X都可形成18电子分子
C.Z、W的最高价含氧酸的酸性:W>Z D.最简单氢化物的沸点:X>W>Z
11.我国科学家构建的NiO/Al2O3/Pt双组分催化剂,可实现氨硼烷(H3NBH3)与H2O高效产H2的目的,发生反应的化学方程式为H3NBH3+2H2ONH4BO2+3H2↑。下列说法正确的是
A.N核外有7种不同空间运动状态的电子 B.Ni的价电子排布式为4s2
C.氨硼烷中B提供孤电子对和N提供的空轨道形成配位键
D.H3NBH3和NH4BO2中N原子均采用sp3杂化
12.甲醇与水蒸气重整制氢气的反应原理为CH3OH(g)+H2OCO2(g)+3H2(g)ΔH,科学家通过计算机模拟得出甲醇在催化剂Pd(III)表面发生解离时所经过的反应历程,如图所示,其中吸附在Pd(III)表面的物质用*标注。
已知①CO(g)+H2O(g)CO2(g)+H2(g)
ΔH1=-41.20kJ·mol-1
②CH3OH(g)CO(g)+2H2(g)ΔH2=+90.64kJ·mol-1
下列说法正确的是
A.ΔH<0 B.甲醇解离过程中仅有C-H键断裂
C.CH3OH(g)解离历程中活化能最小的反应为
CH2O*=CHO*+H*
D.适当增大压强能提高CH3OH(g)的平衡转化率
13.甲烷与硫化氢可通过重整反应制取氢气,反应为CH4+2H2SCS2+4H2.现将原料按
n(CH4))∶n(H2S)=1∶2通入反应釜中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示,下列说法正确的是
A.该反应平衡常数的表达式为K=
B.图中表示H2S、H2物质的量分数变化的曲线分别是d、a
C.M点对应温度下,CH4的转化率约为33.3%
D.由图可知该反应为吸热反应,当c(CH4)/c(H2S)不再变化时反应达平衡
14.K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。
关于该电池,下列说法正确的是
A.有机电解质1可以用KCl溶液替换
B.放电时,电子由a电极沿导线流向b电极;充电时,K+通过隔膜移向a电极
C.消耗22.4LO2时,电路中转移2mol e-
D.用此电池为铅蓄电池充电,消耗39gK时,生成1mol Pb
15.H2R是一种常见二元弱酸,用0.3mol·L-1的NaOH溶液滴定20mL同浓度的H2R溶液的滴定曲线如图。已知a点、c点依次存在:c(H2R)=c(HR-),c(HR-)=c(R2-)。下列说法错误的是
A.Ka2(H2R)=10-4.3
B.b点对应的溶液中::c(R2-)>c(H2R)
C.c点对应溶液温度为滴定过程中的最高值
D.d点对应的溶液中,满足:
c(Na+)=2c(H2R)+2c(HR-)+2c(R2-)
二、非选择题(本题包括4小题,共55分)
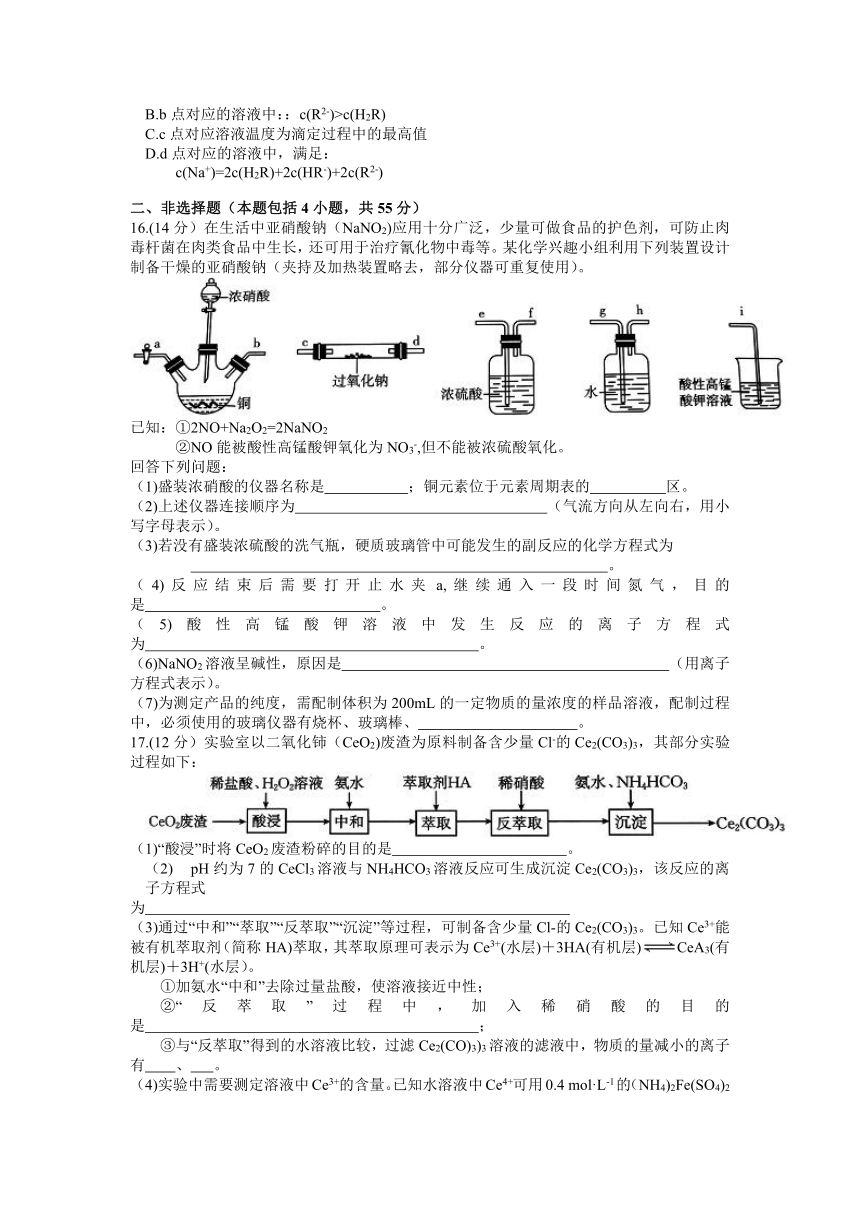
16.(14分)在生活中亚硝酸钠(NaNO2)应用十分广泛,少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组利用下列装置设计制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性高锰酸钾氧化为NO3-,但不能被浓硫酸氧化。
回答下列问题:
(1)盛装浓硝酸的仪器名称是 ;铜元素位于元素周期表的 区。
(2)上述仪器连接顺序为 (气流方向从左向右,用小写字母表示)。
(3)若没有盛装浓硫酸的洗气瓶,硬质玻璃管中可能发生的副反应的化学方程式为
。
(4)反应结束后需要打开止水夹a,继续通入一段时间氮气,目的是 。
(5)酸性高锰酸钾溶液中发生反应的离子方程式为 。
(6)NaNO2溶液呈碱性,原因是 (用离子方程式表示)。
(7)为测定产品的纯度,需配制体积为200mL的一定物质的量浓度的样品溶液,配制过程中,必须使用的玻璃仪器有烧杯、玻璃棒、 。
17.(12分)实验室以二氧化铈(CeO2)废渣为原料制备含少量Cl-的Ce2(CO3)3,其部分实验过程如下:
(1)“酸浸”时将CeO2废渣粉碎的目的是 。
pH约为7的CeCl3溶液与NH4HCO3溶液反应可生成沉淀Ce2(CO3)3,该反应的离子方程式
为
(3)通过“中和”“萃取”“反萃取”“沉淀”等过程,可制备含少量Cl-的Ce2(CO3)3。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为Ce3+(水层)+3HA(有机层)CeA3(有机层)+3H+(水层)。
①加氨水“中和”去除过量盐酸,使溶液接近中性;
②“反萃取”过程中,加入稀硝酸的目的是 ;
③与“反萃取”得到的水溶液比较,过滤Ce2(CO)3)3溶液的滤液中,物质的量减小的离子有 、 。
(4)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用0.4 mol·L-1的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色。实验步骤如下:
a.准确量取25.00mL Ce3+溶液[c(Ce3+)约为2 mol·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250mL容量瓶中后定容;
b.取出20.00mL溶液,加入指示剂,用标准溶液进行滴定,记录数据;
实验编号 滴定前标准溶液的体积读数/mL 滴定后标准溶液的体积读数/mL
1 3.20 14.12
2 3.22 14.30
3 2.56 15.00
c.重复步骤b的操作2~3次,处理数据。
①滴定过程中的离子方程式是 。
②某同学三次实验的实验数据如表所示。
根据表中数据计算c(Ce3+)= (保留三位有效数字)。
18.(14分)二氧化碳甲烷化助力我国2060年前实现“碳中和”,其中涉及的主要反应如下:
反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-164.7kJ·mol-1
反应II:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2kJ·mol-1.
CO(g)+3H2(g)CH4(g)+H2O(g)的反应热 ΔH= 。
(2)在1L恒容密闭装置中,分别充入1mol CO2和4molH2发生上述反应I,在不同温度下反应到10min时,测得H2转化率与温度关系如图1所示。已知该反应的速率方程为V正=k正c(CO2)c4(H2),
v逆=k逆c(CH4)c2(H2O),其中k正、k逆为速率常数,只受温度影响。
①关于该反应,下列叙述正确的是 。
A.恒温下缩小容器的体积,活化分子百分数不变
B.断裂4mol H—H键的同时断裂2mol H—O键,说明反应达到平衡状态
C.当反应达平衡状态时,4v正(H2)=2v逆(H2O)
D.当混合气体的平均相对分子质量不再改变时,反应达到平衡状态
②图1中,至a点的CO2平均反应速率为 mol·L-1·min-1
③图1中c点的lgk正对应的是图2中的 点。
向10L的恒压密闭装置中充入5mol CO2和20mol H2,
在不同温度下同时发生上述反应I和反应II,平衡时各含碳物质
的物质的量n(X)与温度T的关系如图所示。
①当反应I和反应II均达到化学平衡状态时,维持温度不变,压缩
装置体积,则反应II的平衡移动方向是 (填“向左”、
“向右”或“不”)移动。②曲线X表示的是 (填化学式)。
③800K时,反应II的平衡常数为 (计算结果保留三位有效数字)。
HCN H2CO3 CH3COOH
Ka=4.9×10-10 Ka1=4×10-7 Ka=1.7×10-5
Ka2=5.6×10-11
(15分)I.25℃时,下列4种溶液的浓度均为0.10mol
①NaCN溶液 ②NaOH溶液
③CH3COOH溶液 ④NaHCO3溶液
(1)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为 。
(2)测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)约为 (保留1位有效数字)。
II.海洋的水资源和其他化学资源具有十分巨大的开发潜力。
(1)氯气是实验室和工业上的常用气体,科学家基于Cl2易溶于CCl4的性质,开发了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时,电极a的反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3.
①放电时:正极反应式为 。
②充电时:每生成1mol Cl2,电极a质量理论上增加 g.
沿海电厂采用的海水为冷却水,但在排水管中生物的附着和
滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在
管道口设置一对惰性电极(如图所示),通入一定的电流。
①阴极的电极反应式为
,会使海水中的
Mg2+沉沉淀积垢,需定期清理。
②阳极区生成的Cl2在管道中可以
生成氧化灭杀附着生物的NaClO的离子方程式为 。
近年来科学家研究了一种光照充电Li-O2电池(如下图所示)。光照时,
光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li)和阳
极反应(Li2O2+2h+=2Li++O2)对电池进行充电。放电时,Li+从 电
极穿过离子交换膜向 电极迁移,总反应为 。
恩施州高中教育联盟2022-2023学年高二上学期期末考试
化学参考答案
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B A D D C D D B A A D C C B C
二、非选择题(本题包括4小题,共55分)
16.(14分,除标注外每空2分)
(1)分液漏斗(1分);;ds(1分)
(2)bghefcdefi(或bghefdcefi)
(3)2Na2O2+2H2O=4NaOH+O2↑
(4)排尽装置内部的NO,使其充分被KMnO4溶液吸收,防止其污染空气
(5)3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
(6)NO2-+H2OHNO2+OH-
(7)250mL容量瓶、胶头滴管
17.(12分,每空2分)
(1)增大反应物接触面积,加快酸浸速率,使酸浸更充分
(2)2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O
(3)②增大c(H+),上述平衡逆向移动,使Ce3+从有机层转移到水层
③Ce3+、H+(答对一个给1分,答全给2分)
(5)①Fe2++Ce4+=Ce3++Fe3+ ②2.20 mol·L-1
18.(14分,每空2分)
(1)-205.9kJ·mol-1
(2) ①AD ②0.02 ③N
(3)①向左②CH4 ③0.339
19.(15分,除标注外每空2分)
I.(1)CN-+CO2+H2O=HCN+HCO3-
(2)0.02
II.(1)①Cl2+2e-=2C1-(1分)②46
(2)①2H2O+2e-=H2↑+2OH-
②Cl2+2OH-=Cl-+ClO-+H2O
(3)金属Li/负(1分);光催化电极/正(1分);2Li+O2=Li2O2
化学试题
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.化学与生产、生活、科技和环境等联系密切。下列有关说法正确的是
A.白鹤滩水电站首批机组投产,有利于减少CO2、SO2的排放,CO2和SO2都是大气污染物
B.利用X射线对晶体的特殊效应,可快速准确地对普通玻璃伪造的假宝石进行无损鉴定
C.“筑梦天宫”,火箭助推剂-液氧在工业上可通过分解氯酸钾制得
D.使用含磷洗涤剂不会造成水体污染
2.下列有关化学用语的描述正确的是
A.硼酸的电离方程式:H3BO3+H2O[B(OH)4]-+H+ B.四氟肼N2F4的电子式:
C.Se的基态原子简化核外电子排布式:[Ar]4s24p4
D.基态铍原子最外层的电子云轮廓图:
3.2021年9月24日,中国科学家在国际学术期刊《科学》上发表一项重大成果-首次在实验室用二氧化碳人工合成淀粉,生物酶催化剂是这项技术的关键因素。以下说法正确的是
A.合成淀粉和葡萄糖的分子式相同 B.使用生物酶大大提高了二氧化碳的平衡转化率
C.酶在任何条件下都有很高的催化效率 D.人工合成淀粉有利于推进“碳中和”目标的实现
4.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,11.2LCHCl3分子数为0.5NA B.电解精炼铜阳极质量减少6.4g时,转移电子数为0.2NA
C.23gC2H6O分子中含有碳氧健的数目一定为0.5NA D.常温常压下,17gH2O2中含有的质子数为9.NA
5.下列各组离子在给定条件下可以大量共存的是
A.1gc(H+)/c(OH-)<0的溶液中:K+、Cl-、NH4+、I-
B.0.1mol·L-1的NH4Fe(SO4)2的溶液中:Na+、NO3-、A13+、I-
C.澄清透明的溶液中:Mg2+、MnO4-、Fe3+、SO42-
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、HCO3-、Cl-、Mg2+
6.下列关于物质的结构或性质及解释均正确的是
选项 物质的结构或性质 解释
A 键角:H2O>NH3 水分子中O上孤电子对数比氨分子中N上的多
B 热稳定性:NH3>PH3 NH3分子间氢键强于PH3分子间作用力
C 熔点:晶体硅>碳化硅 Si-Si的键能大于C-Si的键能
D 电子云半径:3s>1s 3s电子能量高,在离核更远的区域出现的概率大
7.下列有关实验装置进行的实验,能达到实验目的的是
A.MnO2与浓盐酸反应制备Cl2 B.根据“侯氏制碱法”原理制备NaHCO3 C.制备Fe(OH)2白色沉淀 D.用海水制取蒸馏水
8.能正确表示下列反应的离子方程式是
A.泡沫灭火器的工作原理:2A13++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
B.草酸使酸性KMnO4溶液褪色:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
C.氢氧化铁和碘化氢溶液反应:Fe(OH)3+3H+=Fe3++3H2O
D.将少量溴水滴入过量Na2SO3溶液中:Br2+H2O+SO32-=2Br-+2H++SO42-
9.下列有关化学工业的叙述错误的是
A.工业制备硝酸的第一步反应是N2+O22NO B.氯碱工业中使用的是阳离子交换膜
C.水泥是以黏土和石灰石为主要原料,在水泥回转窑中煅烧制得的
D.合成氨反应分离氨气以后的尾气循环使用,目的是充分利用原料
10.短周期主族元素Z、W、X、Y的原子半径逐渐减小,W的最简单氢化物的水溶液呈碱性,Z的最外层电子数为内层电子总数的两倍,Y与其他元素不在
同一周期,这四种元素组成的某阴离子的结构如图所示,图中各原子最外层
均满足稳定结构。下列叙述错误的是
A.元素第一电离能和电负性均满足:X>W>Z
B.Y分别与Z、W、X都可形成18电子分子
C.Z、W的最高价含氧酸的酸性:W>Z D.最简单氢化物的沸点:X>W>Z
11.我国科学家构建的NiO/Al2O3/Pt双组分催化剂,可实现氨硼烷(H3NBH3)与H2O高效产H2的目的,发生反应的化学方程式为H3NBH3+2H2ONH4BO2+3H2↑。下列说法正确的是
A.N核外有7种不同空间运动状态的电子 B.Ni的价电子排布式为4s2
C.氨硼烷中B提供孤电子对和N提供的空轨道形成配位键
D.H3NBH3和NH4BO2中N原子均采用sp3杂化
12.甲醇与水蒸气重整制氢气的反应原理为CH3OH(g)+H2OCO2(g)+3H2(g)ΔH,科学家通过计算机模拟得出甲醇在催化剂Pd(III)表面发生解离时所经过的反应历程,如图所示,其中吸附在Pd(III)表面的物质用*标注。
已知①CO(g)+H2O(g)CO2(g)+H2(g)
ΔH1=-41.20kJ·mol-1
②CH3OH(g)CO(g)+2H2(g)ΔH2=+90.64kJ·mol-1
下列说法正确的是
A.ΔH<0 B.甲醇解离过程中仅有C-H键断裂
C.CH3OH(g)解离历程中活化能最小的反应为
CH2O*=CHO*+H*
D.适当增大压强能提高CH3OH(g)的平衡转化率
13.甲烷与硫化氢可通过重整反应制取氢气,反应为CH4+2H2SCS2+4H2.现将原料按
n(CH4))∶n(H2S)=1∶2通入反应釜中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。当反应达到平衡时,体系中各组分的物质的量分数x随温度T的变化如图所示,下列说法正确的是
A.该反应平衡常数的表达式为K=
B.图中表示H2S、H2物质的量分数变化的曲线分别是d、a
C.M点对应温度下,CH4的转化率约为33.3%
D.由图可知该反应为吸热反应,当c(CH4)/c(H2S)不再变化时反应达平衡
14.K-O2电池结构如图,a和b为两个电极,其中之一为单质钾片。
关于该电池,下列说法正确的是
A.有机电解质1可以用KCl溶液替换
B.放电时,电子由a电极沿导线流向b电极;充电时,K+通过隔膜移向a电极
C.消耗22.4LO2时,电路中转移2mol e-
D.用此电池为铅蓄电池充电,消耗39gK时,生成1mol Pb
15.H2R是一种常见二元弱酸,用0.3mol·L-1的NaOH溶液滴定20mL同浓度的H2R溶液的滴定曲线如图。已知a点、c点依次存在:c(H2R)=c(HR-),c(HR-)=c(R2-)。下列说法错误的是
A.Ka2(H2R)=10-4.3
B.b点对应的溶液中::c(R2-)>c(H2R)
C.c点对应溶液温度为滴定过程中的最高值
D.d点对应的溶液中,满足:
c(Na+)=2c(H2R)+2c(HR-)+2c(R2-)
二、非选择题(本题包括4小题,共55分)
16.(14分)在生活中亚硝酸钠(NaNO2)应用十分广泛,少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组利用下列装置设计制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性高锰酸钾氧化为NO3-,但不能被浓硫酸氧化。
回答下列问题:
(1)盛装浓硝酸的仪器名称是 ;铜元素位于元素周期表的 区。
(2)上述仪器连接顺序为 (气流方向从左向右,用小写字母表示)。
(3)若没有盛装浓硫酸的洗气瓶,硬质玻璃管中可能发生的副反应的化学方程式为
。
(4)反应结束后需要打开止水夹a,继续通入一段时间氮气,目的是 。
(5)酸性高锰酸钾溶液中发生反应的离子方程式为 。
(6)NaNO2溶液呈碱性,原因是 (用离子方程式表示)。
(7)为测定产品的纯度,需配制体积为200mL的一定物质的量浓度的样品溶液,配制过程中,必须使用的玻璃仪器有烧杯、玻璃棒、 。
17.(12分)实验室以二氧化铈(CeO2)废渣为原料制备含少量Cl-的Ce2(CO3)3,其部分实验过程如下:
(1)“酸浸”时将CeO2废渣粉碎的目的是 。
pH约为7的CeCl3溶液与NH4HCO3溶液反应可生成沉淀Ce2(CO3)3,该反应的离子方程式
为
(3)通过“中和”“萃取”“反萃取”“沉淀”等过程,可制备含少量Cl-的Ce2(CO3)3。已知Ce3+能被有机萃取剂(简称HA)萃取,其萃取原理可表示为Ce3+(水层)+3HA(有机层)CeA3(有机层)+3H+(水层)。
①加氨水“中和”去除过量盐酸,使溶液接近中性;
②“反萃取”过程中,加入稀硝酸的目的是 ;
③与“反萃取”得到的水溶液比较,过滤Ce2(CO)3)3溶液的滤液中,物质的量减小的离子有 、 。
(4)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用0.4 mol·L-1的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色。实验步骤如下:
a.准确量取25.00mL Ce3+溶液[c(Ce3+)约为2 mol·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250mL容量瓶中后定容;
b.取出20.00mL溶液,加入指示剂,用标准溶液进行滴定,记录数据;
实验编号 滴定前标准溶液的体积读数/mL 滴定后标准溶液的体积读数/mL
1 3.20 14.12
2 3.22 14.30
3 2.56 15.00
c.重复步骤b的操作2~3次,处理数据。
①滴定过程中的离子方程式是 。
②某同学三次实验的实验数据如表所示。
根据表中数据计算c(Ce3+)= (保留三位有效数字)。
18.(14分)二氧化碳甲烷化助力我国2060年前实现“碳中和”,其中涉及的主要反应如下:
反应I:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-164.7kJ·mol-1
反应II:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2kJ·mol-1.
CO(g)+3H2(g)CH4(g)+H2O(g)的反应热 ΔH= 。
(2)在1L恒容密闭装置中,分别充入1mol CO2和4molH2发生上述反应I,在不同温度下反应到10min时,测得H2转化率与温度关系如图1所示。已知该反应的速率方程为V正=k正c(CO2)c4(H2),
v逆=k逆c(CH4)c2(H2O),其中k正、k逆为速率常数,只受温度影响。
①关于该反应,下列叙述正确的是 。
A.恒温下缩小容器的体积,活化分子百分数不变
B.断裂4mol H—H键的同时断裂2mol H—O键,说明反应达到平衡状态
C.当反应达平衡状态时,4v正(H2)=2v逆(H2O)
D.当混合气体的平均相对分子质量不再改变时,反应达到平衡状态
②图1中,至a点的CO2平均反应速率为 mol·L-1·min-1
③图1中c点的lgk正对应的是图2中的 点。
向10L的恒压密闭装置中充入5mol CO2和20mol H2,
在不同温度下同时发生上述反应I和反应II,平衡时各含碳物质
的物质的量n(X)与温度T的关系如图所示。
①当反应I和反应II均达到化学平衡状态时,维持温度不变,压缩
装置体积,则反应II的平衡移动方向是 (填“向左”、
“向右”或“不”)移动。②曲线X表示的是 (填化学式)。
③800K时,反应II的平衡常数为 (计算结果保留三位有效数字)。
HCN H2CO3 CH3COOH
Ka=4.9×10-10 Ka1=4×10-7 Ka=1.7×10-5
Ka2=5.6×10-11
(15分)I.25℃时,下列4种溶液的浓度均为0.10mol
①NaCN溶液 ②NaOH溶液
③CH3COOH溶液 ④NaHCO3溶液
(1)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为 。
(2)测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)约为 (保留1位有效数字)。
II.海洋的水资源和其他化学资源具有十分巨大的开发潜力。
(1)氯气是实验室和工业上的常用气体,科学家基于Cl2易溶于CCl4的性质,开发了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时,电极a的反应为NaTi2(PO4)3+2Na++2e-=Na3Ti2(PO4)3.
①放电时:正极反应式为 。
②充电时:每生成1mol Cl2,电极a质量理论上增加 g.
沿海电厂采用的海水为冷却水,但在排水管中生物的附着和
滋生会阻碍冷却水排放并降低冷却效率,为解决这一问题,通常在
管道口设置一对惰性电极(如图所示),通入一定的电流。
①阴极的电极反应式为
,会使海水中的
Mg2+沉沉淀积垢,需定期清理。
②阳极区生成的Cl2在管道中可以
生成氧化灭杀附着生物的NaClO的离子方程式为 。
近年来科学家研究了一种光照充电Li-O2电池(如下图所示)。光照时,
光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li)和阳
极反应(Li2O2+2h+=2Li++O2)对电池进行充电。放电时,Li+从 电
极穿过离子交换膜向 电极迁移,总反应为 。
恩施州高中教育联盟2022-2023学年高二上学期期末考试
化学参考答案
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B A D D C D D B A A D C C B C
二、非选择题(本题包括4小题,共55分)
16.(14分,除标注外每空2分)
(1)分液漏斗(1分);;ds(1分)
(2)bghefcdefi(或bghefdcefi)
(3)2Na2O2+2H2O=4NaOH+O2↑
(4)排尽装置内部的NO,使其充分被KMnO4溶液吸收,防止其污染空气
(5)3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
(6)NO2-+H2OHNO2+OH-
(7)250mL容量瓶、胶头滴管
17.(12分,每空2分)
(1)增大反应物接触面积,加快酸浸速率,使酸浸更充分
(2)2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O
(3)②增大c(H+),上述平衡逆向移动,使Ce3+从有机层转移到水层
③Ce3+、H+(答对一个给1分,答全给2分)
(5)①Fe2++Ce4+=Ce3++Fe3+ ②2.20 mol·L-1
18.(14分,每空2分)
(1)-205.9kJ·mol-1
(2) ①AD ②0.02 ③N
(3)①向左②CH4 ③0.339
19.(15分,除标注外每空2分)
I.(1)CN-+CO2+H2O=HCN+HCO3-
(2)0.02
II.(1)①Cl2+2e-=2C1-(1分)②46
(2)①2H2O+2e-=H2↑+2OH-
②Cl2+2OH-=Cl-+ClO-+H2O
(3)金属Li/负(1分);光催化电极/正(1分);2Li+O2=Li2O2
同课章节目录
