1103 《盐 化肥》单元复习(PPT课件19页) -2022-2023学年九年级下册化学同步精品课件讲义(人教版)
文档属性
| 名称 | 1103 《盐 化肥》单元复习(PPT课件19页) -2022-2023学年九年级下册化学同步精品课件讲义(人教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-06 11:35:58 | ||
图片预览




文档简介
(共19张PPT)
《盐 化肥》 单元复习
一、盐
1. 定义:由金属离子(或NH4+)和酸根离子构成的化合物
二、氯化钠
1. 物理性质:白色晶体,易溶于水。
2. 存在
(1)人体:人体内所含的氯化钠大部分以离子形式存在于体液中。
(2)自然界:海水、盐湖、盐井、盐矿。
二、氯化钠
3. 用途
(1)医疗上配制生理盐水;
(2)农业上用氯化钠溶液来选种;
(3)工业上可以氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等;
(4)氯化钠是重要的调味品,还可用于腌渍食品,延长保存时间;
(5)交通上用于消除公路上的积雪。
二、氯化钠
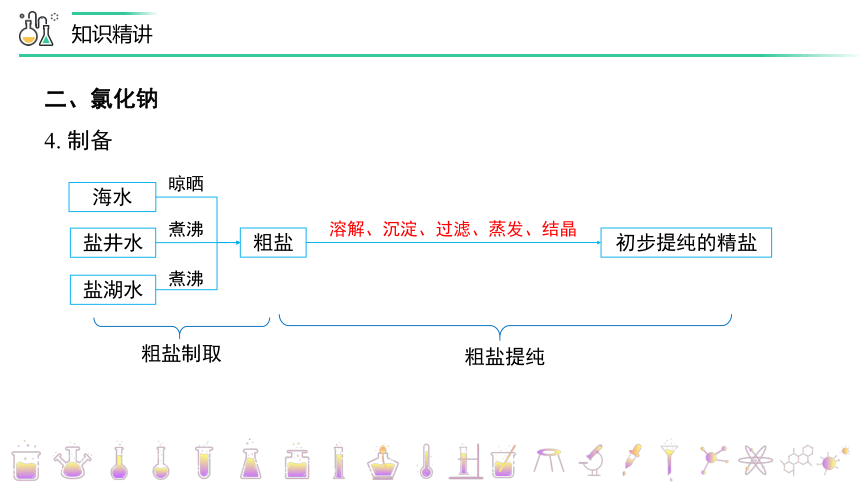
4. 制备
海水
盐井水
盐湖水
粗盐
初步提纯的精盐
晾晒
煮沸
煮沸
溶解、沉淀、过滤、蒸发、结晶
粗盐制取
粗盐提纯
二、氯化钠
5. 提纯
实验原理
注意事项
溶解性不同,过滤除去泥沙等不溶性杂质,蒸发得到较纯净的精盐
①过滤时注意“一贴二低三靠”;
②蒸发时用玻璃棒不断搅拌,防止局部温度过高导致液滴飞溅;
③蒸发皿中出现较多固体时,停止加热,用余热蒸干;
粗盐的产率= ×100%
精盐质量
溶解的粗盐质量
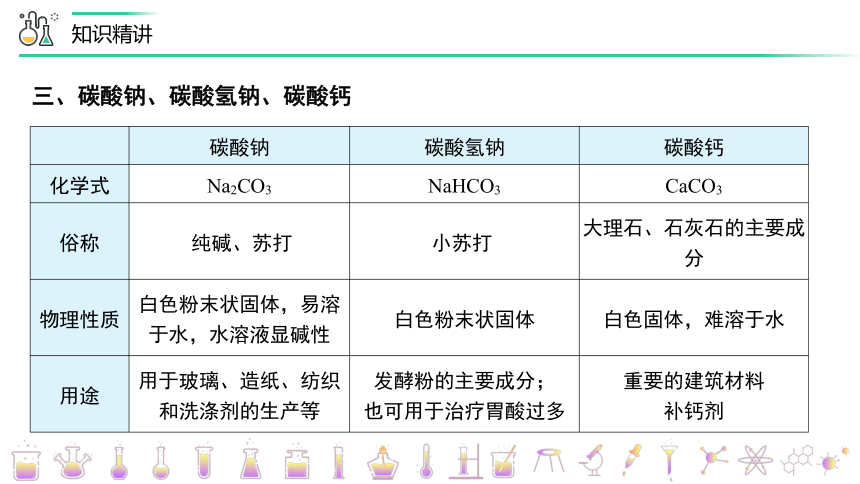
碳酸钠 碳酸氢钠 碳酸钙
化学式 Na2CO3 NaHCO3 CaCO3
俗称 纯碱、苏打 小苏打 大理石、石灰石的主要成分
物理性质 白色粉末状固体,易溶于水,水溶液显碱性 白色粉末状固体 白色固体,难溶于水
用途 用于玻璃、造纸、纺织和洗涤剂的生产等 发酵粉的主要成分; 也可用于治疗胃酸过多 重要的建筑材料
补钙剂
三、碳酸钠、碳酸氢钠、碳酸钙
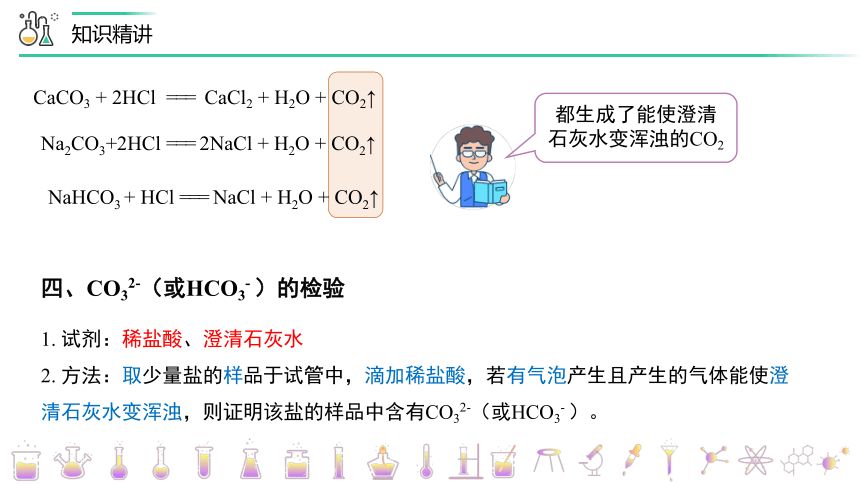
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
Na2CO3+2HCl === 2NaCl + H2O + CO2↑
NaHCO3 + HCl === NaCl + H2O + CO2↑
都生成了能使澄清
石灰水变浑浊的CO2
四、CO32-(或HCO3- )的检验
1. 试剂:稀盐酸、澄清石灰水
2. 方法:取少量盐的样品于试管中,滴加稀盐酸,若有气泡产生且产生的气体能使澄清石灰水变浑浊,则证明该盐的样品中含有CO32-(或HCO3- )。
五、复分解反应
1. 定义:在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应。
2. 字母表达式:AB + CD ==== AD + CB 。
A
B
C
D
+
==
A
B
C
D
+
六、复分解反应发生的条件
1.生成物:有气体、沉淀或水时,复分解反应才能发生。
哪些物质属于沉淀呢?
白色沉淀:AgCl、BaSO4、BaCO3、
CaCO3、Mg(OH)2、Al(OH)3
蓝色沉淀:Cu(OH)2
红褐色沉淀:Fe(OH)3
六、复分解反应发生的条件
1.生成物:有气体、沉淀或水时,复分解反应才能发生。
2.反应物
反应物类型 反应物条件
碱 + 盐 两者都可溶
盐 + 盐 盐 + 酸 酸必须可溶
七、盐的化学性质
1. 盐(溶液)+ 金属 → 新金属 + 新盐 。如:
CuSO4 + Zn = Cu + ZnSO4 Cu + 2AgNO3=2Ag+Cu(NO3)2
2. 盐 + 酸 → 新盐 + 新酸。如:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ Na2CO3+ H2SO4 = Na2SO4 + H2O + CO2↑
3. 盐 + 碱(溶液)→ 新碱 + 新盐。如:
CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
4. 盐(溶液)+ 盐(溶液)→ 两种新盐。如:
NaCl + AgNO3 = AgCl ↓+ NaNO3 Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
物 质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
八、物质的分类
肥料
农家肥
化学肥料
人畜粪便、植物体等
以化学和物理方法制成,含农作物生长所需营养元素
九、化肥
农作物所必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等
氮、磷、钾需求量较大,因此氮肥、磷肥和钾肥是最主要的化学肥料
分类 定义 示例 主要作用
氮肥 含有氮元素的肥料 尿素[CO(NH2)2] 氨水(NH3·H2O) 铵盐如NH4HCO3、NH4Cl 硝酸盐如NH4NO3、NaNO3等 植物体内蛋白质、核酸和叶绿素的组成元素。氮肥能促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量
磷肥 含有磷元素的肥料 磷酸盐如磷矿粉[Ca3(PO4)2]、 钙镁磷肥(钙和镁的磷酸盐)、 过磷酸钙[Ca(H2PO4)2(磷酸二氢钙)和CaSO4的混合物]等 植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,磷可以促进作物生长,还可增强作物的抗寒、抗旱能力
钾肥 含有钾元素的肥料 硫酸钾(K2SO4) 氯化钾(KCl)等 在植物代谢活跃的器官和组织中的分布量较高,具有保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能
氮肥、磷肥、钾肥对比
3. 化肥的利与弊
(1)利:提高农作物产量。
(2)弊:
①含有重金属元素、有毒有机物和放射性物质,施入土壤后造成潜在的土壤污染;
②引起土壤酸化,水域氮和磷含量升高、氮化物和硫化物气体排放等,造成土壤退化和水、大气环境的污染。
4. 化肥、农药的合理使用
(1)化肥:
①农家肥和化肥合理配用
②根据土壤情况和农作物种类选择化肥
(2)农药:
①根据病虫害发生、发展规律对症下药
②不同农药交替使用,提高药效,延缓或防止抗药性的发生
③提倡发展和使用生物农药
氮肥 钾肥 磷肥
观察外观 白色晶体 灰白色粉末
加水 全部溶于水 大多数不溶于水
加熟石灰研磨 铵态氮肥能放出 有刺激性气味的氨气 无气体
十、化肥的鉴别
十、化肥的鉴别
氮肥
尿素
硫酸铵
氯化铵
硝酸铵
加碱
无氨味
有氨味
加硝酸
钡溶液
无沉淀
有白色
沉淀
加硝酸
银溶液
有白色
沉淀
无沉淀
硫酸铵
氯化铵
硝酸铵
氯化铵
硝酸铵
(NH4)2SO4 + Ba(NO3)2 === BaSO4↓ + 2NH4NO3
NH4Cl+AgNO3 === AgCl↓+NH4NO3
《盐 化肥》 单元复习
一、盐
1. 定义:由金属离子(或NH4+)和酸根离子构成的化合物
二、氯化钠
1. 物理性质:白色晶体,易溶于水。
2. 存在
(1)人体:人体内所含的氯化钠大部分以离子形式存在于体液中。
(2)自然界:海水、盐湖、盐井、盐矿。
二、氯化钠
3. 用途
(1)医疗上配制生理盐水;
(2)农业上用氯化钠溶液来选种;
(3)工业上可以氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等;
(4)氯化钠是重要的调味品,还可用于腌渍食品,延长保存时间;
(5)交通上用于消除公路上的积雪。
二、氯化钠
4. 制备
海水
盐井水
盐湖水
粗盐
初步提纯的精盐
晾晒
煮沸
煮沸
溶解、沉淀、过滤、蒸发、结晶
粗盐制取
粗盐提纯
二、氯化钠
5. 提纯
实验原理
注意事项
溶解性不同,过滤除去泥沙等不溶性杂质,蒸发得到较纯净的精盐
①过滤时注意“一贴二低三靠”;
②蒸发时用玻璃棒不断搅拌,防止局部温度过高导致液滴飞溅;
③蒸发皿中出现较多固体时,停止加热,用余热蒸干;
粗盐的产率= ×100%
精盐质量
溶解的粗盐质量
碳酸钠 碳酸氢钠 碳酸钙
化学式 Na2CO3 NaHCO3 CaCO3
俗称 纯碱、苏打 小苏打 大理石、石灰石的主要成分
物理性质 白色粉末状固体,易溶于水,水溶液显碱性 白色粉末状固体 白色固体,难溶于水
用途 用于玻璃、造纸、纺织和洗涤剂的生产等 发酵粉的主要成分; 也可用于治疗胃酸过多 重要的建筑材料
补钙剂
三、碳酸钠、碳酸氢钠、碳酸钙
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
Na2CO3+2HCl === 2NaCl + H2O + CO2↑
NaHCO3 + HCl === NaCl + H2O + CO2↑
都生成了能使澄清
石灰水变浑浊的CO2
四、CO32-(或HCO3- )的检验
1. 试剂:稀盐酸、澄清石灰水
2. 方法:取少量盐的样品于试管中,滴加稀盐酸,若有气泡产生且产生的气体能使澄清石灰水变浑浊,则证明该盐的样品中含有CO32-(或HCO3- )。
五、复分解反应
1. 定义:在溶液中,两种化合物互相交换成分,生成另外两种化合物的反应。
2. 字母表达式:AB + CD ==== AD + CB 。
A
B
C
D
+
==
A
B
C
D
+
六、复分解反应发生的条件
1.生成物:有气体、沉淀或水时,复分解反应才能发生。
哪些物质属于沉淀呢?
白色沉淀:AgCl、BaSO4、BaCO3、
CaCO3、Mg(OH)2、Al(OH)3
蓝色沉淀:Cu(OH)2
红褐色沉淀:Fe(OH)3
六、复分解反应发生的条件
1.生成物:有气体、沉淀或水时,复分解反应才能发生。
2.反应物
反应物类型 反应物条件
碱 + 盐 两者都可溶
盐 + 盐 盐 + 酸 酸必须可溶
七、盐的化学性质
1. 盐(溶液)+ 金属 → 新金属 + 新盐 。如:
CuSO4 + Zn = Cu + ZnSO4 Cu + 2AgNO3=2Ag+Cu(NO3)2
2. 盐 + 酸 → 新盐 + 新酸。如:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ Na2CO3+ H2SO4 = Na2SO4 + H2O + CO2↑
3. 盐 + 碱(溶液)→ 新碱 + 新盐。如:
CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
4. 盐(溶液)+ 盐(溶液)→ 两种新盐。如:
NaCl + AgNO3 = AgCl ↓+ NaNO3 Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
物 质
纯净物
混合物
单质
化合物
金属单质
非金属单质
氧化物
酸
碱
盐
八、物质的分类
肥料
农家肥
化学肥料
人畜粪便、植物体等
以化学和物理方法制成,含农作物生长所需营养元素
九、化肥
农作物所必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等
氮、磷、钾需求量较大,因此氮肥、磷肥和钾肥是最主要的化学肥料
分类 定义 示例 主要作用
氮肥 含有氮元素的肥料 尿素[CO(NH2)2] 氨水(NH3·H2O) 铵盐如NH4HCO3、NH4Cl 硝酸盐如NH4NO3、NaNO3等 植物体内蛋白质、核酸和叶绿素的组成元素。氮肥能促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量
磷肥 含有磷元素的肥料 磷酸盐如磷矿粉[Ca3(PO4)2]、 钙镁磷肥(钙和镁的磷酸盐)、 过磷酸钙[Ca(H2PO4)2(磷酸二氢钙)和CaSO4的混合物]等 植物体内核酸、蛋白质和酶等多种重要化合物的组成元素,磷可以促进作物生长,还可增强作物的抗寒、抗旱能力
钾肥 含有钾元素的肥料 硫酸钾(K2SO4) 氯化钾(KCl)等 在植物代谢活跃的器官和组织中的分布量较高,具有保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力等功能
氮肥、磷肥、钾肥对比
3. 化肥的利与弊
(1)利:提高农作物产量。
(2)弊:
①含有重金属元素、有毒有机物和放射性物质,施入土壤后造成潜在的土壤污染;
②引起土壤酸化,水域氮和磷含量升高、氮化物和硫化物气体排放等,造成土壤退化和水、大气环境的污染。
4. 化肥、农药的合理使用
(1)化肥:
①农家肥和化肥合理配用
②根据土壤情况和农作物种类选择化肥
(2)农药:
①根据病虫害发生、发展规律对症下药
②不同农药交替使用,提高药效,延缓或防止抗药性的发生
③提倡发展和使用生物农药
氮肥 钾肥 磷肥
观察外观 白色晶体 灰白色粉末
加水 全部溶于水 大多数不溶于水
加熟石灰研磨 铵态氮肥能放出 有刺激性气味的氨气 无气体
十、化肥的鉴别
十、化肥的鉴别
氮肥
尿素
硫酸铵
氯化铵
硝酸铵
加碱
无氨味
有氨味
加硝酸
钡溶液
无沉淀
有白色
沉淀
加硝酸
银溶液
有白色
沉淀
无沉淀
硫酸铵
氯化铵
硝酸铵
氯化铵
硝酸铵
(NH4)2SO4 + Ba(NO3)2 === BaSO4↓ + 2NH4NO3
NH4Cl+AgNO3 === AgCl↓+NH4NO3
同课章节目录
