7.3.1 乙醇 课件(共37张PPT)
文档属性
| 名称 | 7.3.1 乙醇 课件(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 156.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-06 11:33:48 | ||
图片预览








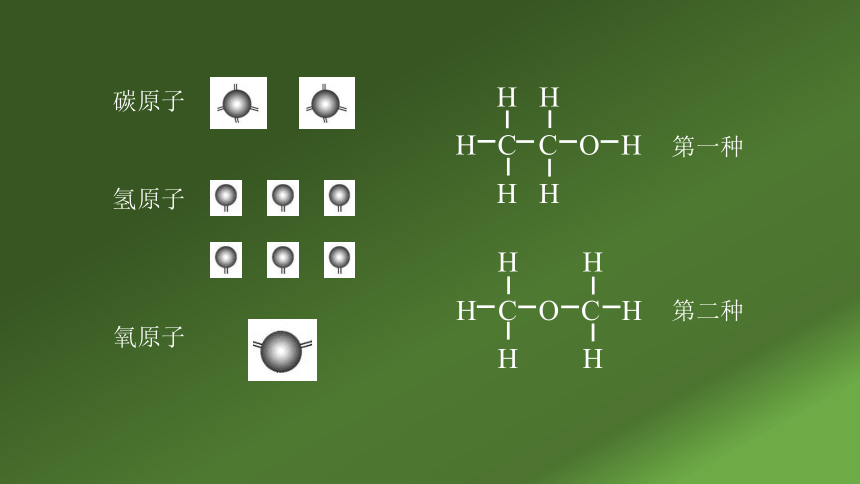

文档简介
(共37张PPT)
第七章 有机化合物
第三节 乙醇与乙酸
第1课时 乙醇
黄酒 白酒 红酒 啤酒
《本草纲目》——“烧酒非古法也,自元时始创。其法用浓酒和糟,蒸令汽上,用器承取滴露。”
一、乙醇的物理性质
乙醇
无色有特殊香味的液体
密度:0.789 g/cm3
挥发性:易挥发
熔点:-117 ℃
沸点:78.5 ℃
能与水以任意比例互溶
乙醇是一种常见的有机化合物,
可以用燃烧法确定其组成。
乙醇由C、H、O三种元素组成
二、乙醇的组成
确定有机物分子式的一般步骤:
确定元素组成→确定最简式→确定分子式
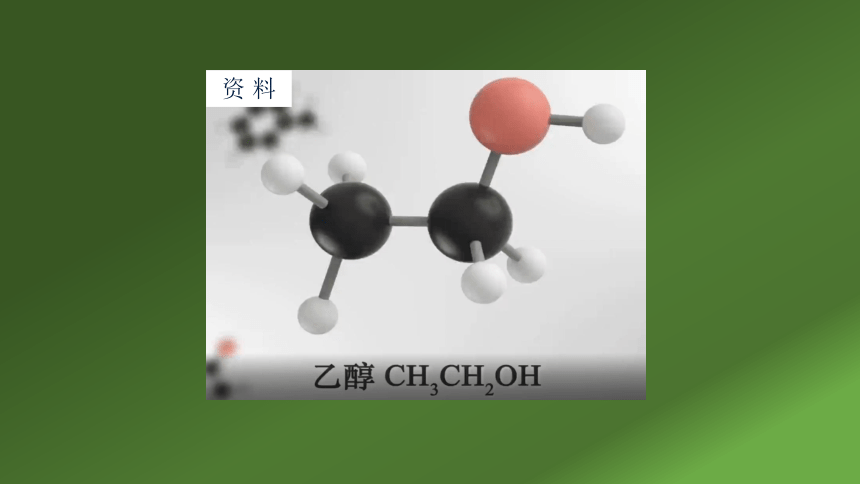
三、乙醇的结构
乙醇的分子式是C2H6O
请同学们结合有机物成键规律,
试写乙醇的结构式。
H H
H C C O H
H H
H H
H C O C H
H H
第一种
第二种
碳原子
氢原子
氧原子
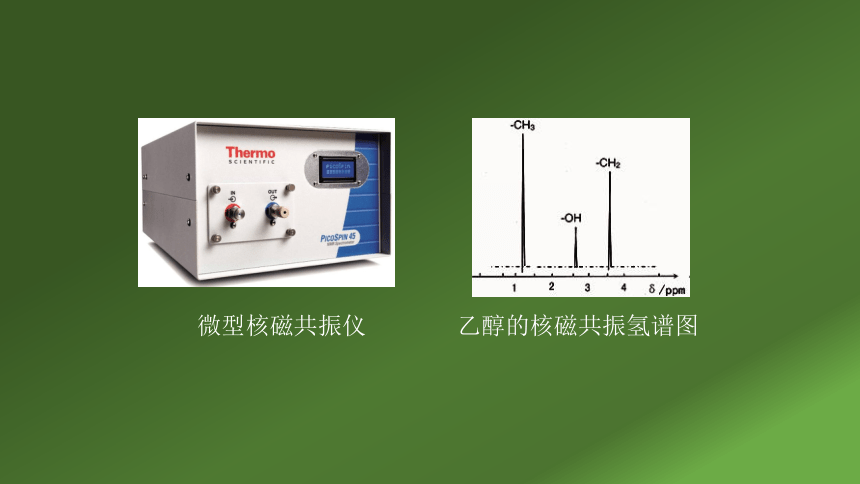
微型核磁共振仪 乙醇的核磁共振氢谱图
资 料
概念辨析
-OH OH-
电子式 O H [ O H]-
电性 电中性 负电性
存在方式 不能独立存在 能够独立存在
稳定性 不稳定 较稳定
··
· ·
·
··
··
· ·
· ·
··
物质 乙醇
有机化合物类别 醇
分子式 C2H6O
结构简式 CH3CH2OH或C2H5OH
四、乙醇的化学性质
H H
H C C O H
H H
资 料
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
乙醇钠
1.乙醇与钠反应
四、乙醇的化学性质
H H
H C C O H
H H
H O H
乙醇 水
1.乙醇与钠反应
四、乙醇的化学性质
CH3CH2OH + 3O2 2CO2 + 3H2O
点燃
2.乙醇的氧化反应
四、乙醇的化学性质
资 料
H H
H C C O H
H H
乙醇
H O
H C C H
H
乙醛
2CH3CH2OH + O2 2CH3CHO + 2H2O
催化剂
△
乙醛
2.乙醇的氧化反应
四、乙醇的化学性质
物质 乙醇 乙醛
有机化合物类别 醇 醛
分子式 C2H6O C2H4O
结构简式 CH3CH2OH CH3CHO
官能团 -OH 羟基 -CHO 醛基
资 料
H H
H C C O H
H H
小结
①
②
③
④
⑤
发生的反应 断键的位置
与Na反应 ①
催化氧化 ①③
燃烧 全部
含有酒精的消毒用品
五、乙醇的用途
使用酒精消毒的注意事项
1.75%的酒精可以直接擦拭门把手、桌面、电梯按钮等,不要大量喷洒于空气或身体上。
2.室内使用酒精时,需要保持室内通风,并远离高温物体,千万不能与明火接触。
3.家里存放酒精要远离火源和电源,且必须密封存放。
4.酒精是易燃易挥发的液体,建议购买小瓶装,以够用为宜,不要大量囤积酒精,以免留下消防安全隐患。
用酒精做燃料
五、乙醇的用途
五、乙醇的用途
五、乙醇的用途
乙醇
消毒剂
燃料
有机溶剂
工业原料
饮品
用途
性质
体现
结构
决定
小结
1.加热质量为a g的铜丝至表面变黑,立即伸入下列物质中,能使铜丝变红,而且质量仍为a g的是( )
A.稀硫酸
B.乙醇
C.稀硝酸
D.氢氧化钠溶液
巩固练习
H2SO4 + CuO === CuSO4 + H2O
2HNO3 + CuO === Cu(NO3)2 + H2O
B
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
△
2.下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇与足量的钠反应得到0.5 mol氢气
D.1 mol乙醇可以通过反应生成1 mol乙醛
巩固练习
C
组成 结构 性质 转化 应用
乙醇
课堂小结
本节内容结束
第七章 有机化合物
第三节 乙醇与乙酸
第1课时 乙醇
黄酒 白酒 红酒 啤酒
《本草纲目》——“烧酒非古法也,自元时始创。其法用浓酒和糟,蒸令汽上,用器承取滴露。”
一、乙醇的物理性质
乙醇
无色有特殊香味的液体
密度:0.789 g/cm3
挥发性:易挥发
熔点:-117 ℃
沸点:78.5 ℃
能与水以任意比例互溶
乙醇是一种常见的有机化合物,
可以用燃烧法确定其组成。
乙醇由C、H、O三种元素组成
二、乙醇的组成
确定有机物分子式的一般步骤:
确定元素组成→确定最简式→确定分子式
三、乙醇的结构
乙醇的分子式是C2H6O
请同学们结合有机物成键规律,
试写乙醇的结构式。
H H
H C C O H
H H
H H
H C O C H
H H
第一种
第二种
碳原子
氢原子
氧原子
微型核磁共振仪 乙醇的核磁共振氢谱图
资 料
概念辨析
-OH OH-
电子式 O H [ O H]-
电性 电中性 负电性
存在方式 不能独立存在 能够独立存在
稳定性 不稳定 较稳定
··
· ·
·
··
··
· ·
· ·
··
物质 乙醇
有机化合物类别 醇
分子式 C2H6O
结构简式 CH3CH2OH或C2H5OH
四、乙醇的化学性质
H H
H C C O H
H H
资 料
2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
乙醇钠
1.乙醇与钠反应
四、乙醇的化学性质
H H
H C C O H
H H
H O H
乙醇 水
1.乙醇与钠反应
四、乙醇的化学性质
CH3CH2OH + 3O2 2CO2 + 3H2O
点燃
2.乙醇的氧化反应
四、乙醇的化学性质
资 料
H H
H C C O H
H H
乙醇
H O
H C C H
H
乙醛
2CH3CH2OH + O2 2CH3CHO + 2H2O
催化剂
△
乙醛
2.乙醇的氧化反应
四、乙醇的化学性质
物质 乙醇 乙醛
有机化合物类别 醇 醛
分子式 C2H6O C2H4O
结构简式 CH3CH2OH CH3CHO
官能团 -OH 羟基 -CHO 醛基
资 料
H H
H C C O H
H H
小结
①
②
③
④
⑤
发生的反应 断键的位置
与Na反应 ①
催化氧化 ①③
燃烧 全部
含有酒精的消毒用品
五、乙醇的用途
使用酒精消毒的注意事项
1.75%的酒精可以直接擦拭门把手、桌面、电梯按钮等,不要大量喷洒于空气或身体上。
2.室内使用酒精时,需要保持室内通风,并远离高温物体,千万不能与明火接触。
3.家里存放酒精要远离火源和电源,且必须密封存放。
4.酒精是易燃易挥发的液体,建议购买小瓶装,以够用为宜,不要大量囤积酒精,以免留下消防安全隐患。
用酒精做燃料
五、乙醇的用途
五、乙醇的用途
五、乙醇的用途
乙醇
消毒剂
燃料
有机溶剂
工业原料
饮品
用途
性质
体现
结构
决定
小结
1.加热质量为a g的铜丝至表面变黑,立即伸入下列物质中,能使铜丝变红,而且质量仍为a g的是( )
A.稀硫酸
B.乙醇
C.稀硝酸
D.氢氧化钠溶液
巩固练习
H2SO4 + CuO === CuSO4 + H2O
2HNO3 + CuO === Cu(NO3)2 + H2O
B
2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
△
2.下列方法中可以证明乙醇分子中有一个氢原子与其他氢原子不同的是( )
A.1 mol乙醇完全燃烧生成3 mol水
B.乙醇可以制饮料
C.1 mol乙醇与足量的钠反应得到0.5 mol氢气
D.1 mol乙醇可以通过反应生成1 mol乙醛
巩固练习
C
组成 结构 性质 转化 应用
乙醇
课堂小结
本节内容结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
