化学人教版(2019)选择性必修1 4.2《 电解池》(共103张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2《 电解池》(共103张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 53.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-07 08:16:38 | ||
图片预览









文档简介
(共103张PPT)
第二节
电解池
新人教版选择性必修一
第四章 化学反应与电能
电解池
第1课时
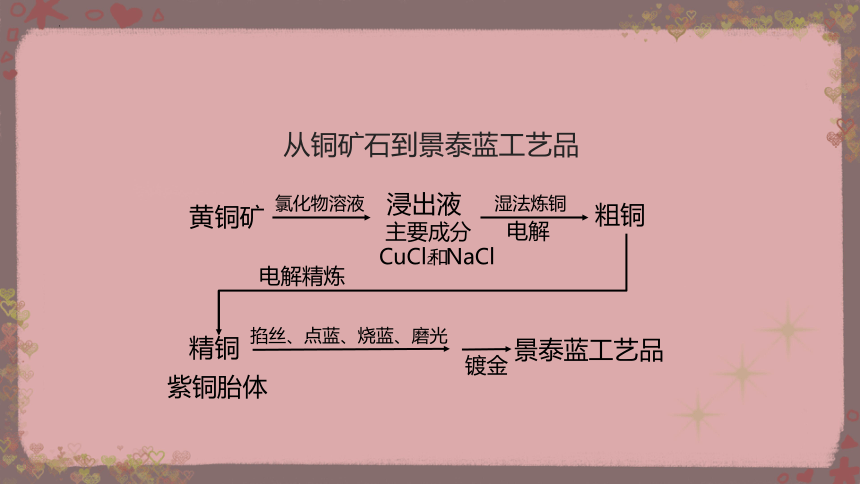
从铜矿石到景泰蓝工艺品
黄铜矿
紫铜胎体
景泰蓝工艺品
从铜矿石到景泰蓝工艺品
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2 NaCl
湿法炼铜
粗铜
精铜
紫铜胎体
电解
电解精炼
和
从铜矿石到景泰蓝工艺品
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2 NaCl
湿法炼铜
粗铜
精铜
掐丝、点蓝、烧蓝、磨光
紫铜胎体
景泰蓝工艺品
电解
电解精炼
镀金
和
任务1 实验室探究电解得粗铜的原理
浸出液
主要成分
CuCl2和NaCl
湿法炼铜
粗铜
电解
任务1 实验室探究电解得粗铜的原理
浸出液
主要成分
CuCl2和NaCl
湿法炼铜
粗铜
电解
1.1 电解CuCl2溶液
1.2 电解NaCl溶液
1.3 电解CuCl2和NaCl的混合溶液
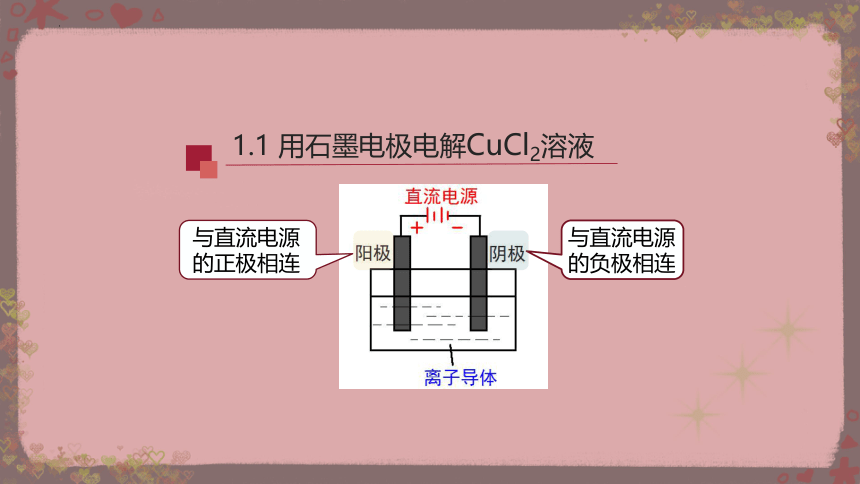
1.1 用石墨电极电解CuCl2溶液
与直流电源的负极相连
与直流电源的正极相连
1.1 用石墨电极电解CuCl2溶液
1.1 用石墨电极电解CuCl2溶液
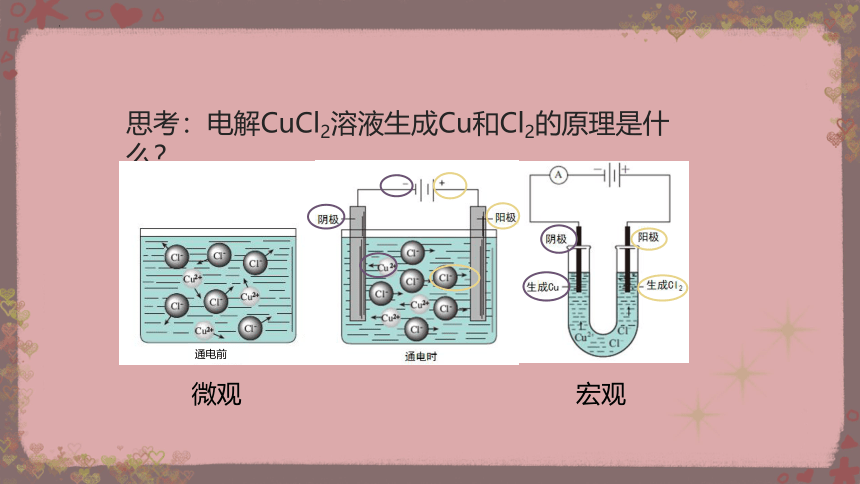
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
宏观
微观
通电前
通电前:
H2O
H+
OH-
+
CuCl2
Cu2+
+
2Cl-
1.1 用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
符号表征
通电前:
H2O
H+
OH-
+
CuCl2
Cu2+
+
2Cl-
1.1 用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
符号表征
通电时:
向阴极迁移
向阳极迁移
通电前:
H2O
H+
OH-
+
CuCl2
Cu2+
+
2Cl-
通电时:
向阴极迁移
向阳极迁移
2e-
↑
2Cl-
Cl2
-
氧化反应
放电顺序
Cl- > OH-
2e-
Cu2+
+
Cu
还原反应
Cu2+ > H+
放电顺序
通电时:
阴极
阳极
2e-
Cu2+
+
Cu
还原反应
Cu2+ > H+
放电顺序
2e-
↑
2Cl-
Cl2
-
氧化反应
放电顺序
Cl- > OH-
↑
总反应:
Cu2+ + 2Cl- Cu + Cl2
电解
电解池:把电能直接转化为化学能的装置。
电解:使电流通过电解质溶液(或熔融电解质)而
在阳极、阴极引起氧化还原反应的过程。
电解池工作原理示意图
阳离子
阴离子
e-
离子导体
e-
氧化反应
还原反应
电解池工作原理
示意图
分析电解池工作原理
的基本步骤
电源
阳极
阴极
溶液中离子
阴离子
阳离子
电极反应
放电顺序
1.2 用石墨电极电解NaCl溶液
思考:请依据电解的基本原理,预测电解
饱和食盐水的产物,并设计实验检验。
1.2 用石墨电极电解NaCl溶液
通电前:
NaCl Na+ + Cl-
H2O H+ + OH-
向阴极迁移
向阳极迁移
阴极 阳极
离子
分析 电极 反应
产物检验方法 湿润淀粉KI试纸
检验Cl2
总反应
Cl- OH-
Na+ H+
点燃法检验H2
酚酞溶液检验碱性
2e-
↑
2Cl-
Cl2
-
↑
2NaCl +
2H2O
电解
H2 + 2NaOH + Cl2
↑
H2O
H+
OH-
+
2e-
↑
2H+
H2
+
2e-
↑
2H2O
H2 +2OH-
+
思 考
能否用该电解池制备Cl2、H2 和NaOH?若不能,该怎样改进装置?
阴极区域
阳极区域
↑
2NaCl +
2H2O
电解
H2 + 2NaOH + Cl2
↑
1.Cl2 与 NaOH 反应
Cl2 + 2OH- ClO- + Cl- + H2O
一定条件
2.H2 与 Cl2 混合易爆炸
H2 + Cl2 2HCl
↑
2NaCl +
2H2O
电解
H2 + 2NaOH + Cl2
↑
Na+
精制饱和
NaCl溶液
H2O
(含少量NaOH)
隔膜
电解池工作原理示意图
阳离子
阴离子
e-
离子导体
e-
阳离子交换膜
电中性
电中性
氧化反应
还原反应
1.3 用石墨电极电解CuCl2和NaCl的混合溶液
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2
NaCl
湿法
炼铜
电
解
粗铜
电解CuCl2溶液
电解NaCl溶液
惰性电极:在实验条件下,放电顺序为:
阴极:Cu2+ > H+ > Na+
阳极:Cl- > OH-
第一课时 总结
电解:使电流通过电解质溶液(或熔融电解质)而
在阳极、阴极引起氧化还原反应的过程。
借助电解可以使非自发的氧化还原反应进行。
在生活、生产和科学研究中具有重要意义。
课后思考
1.根据已经学到的电解原理设计:怎样将粗铜电解精炼得精铜,怎样镀金,以制得景泰蓝工艺品?
2.电解池的模型还可能有什么样的变化,以指导实
际工业生产?
电解池
第2课时
从铜矿石到景泰蓝工艺品
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2 NaCl
湿法炼铜
粗铜
精铜
掐丝、点蓝、烧蓝、磨光
紫铜胎体
景泰蓝工艺品
电解
电解精炼
镀金
和
任务2 粗铜电解精炼得精铜
粗铜中含Cu约98.5%,还含有Fe、Ag、Au等杂质,怎么用电解的方法得到纯铜?请设计实验。
任务2 粗铜电解精炼得精铜
阴极
出铜
电解CuCl2溶液
还原反应
2e-
Cu2+
+
Cu
任务2 粗铜电解精炼得精铜
阴极铁钉
电解NaCl溶液
阴极:得电子,还原反应,
金属作阴极,不参与反应。
任务2 粗铜电解精炼得精铜
Cu–2e- Cu2+
氧化反应
粗铜
还原反应
2e-
Cu2+
+
Cu
纯铜
CuSO4溶液
资料
任务2 粗铜电解精炼得精铜
纯铜或钢板
CuSO4溶液
粗铜
阳极
放电顺序:
金属 > OH- > SO
2-
4
Cu–2e- Cu2+
Fe–2e- Fe2+
阳极
放电顺序:
金属 > OH- > SO
2-
4
Cu–2e- Cu2+
Fe–2e- Fe2+
阳极泥
阳极
Cu–2e- Cu2+
Fe–2e- Fe2+
阴极
CuSO4溶液
2e-
Cu2+
+
Cu
放电顺序:Cu2+ > H+ > Fe2+
放电顺序:
金属 > OH- > SO
2-
4
任务2 粗铜电解精炼得精铜
金属(除金、铂)
金属优先失电子
金属(除金、铂)
金属优先失电子
任务2 粗铜电解精炼得精铜
任务3 电镀
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。主要目的是增强金属抗腐蚀能力,增加美观或表面硬度。镀层金属通常是铬、镍、银、黄铜等。
铁合页
镀金合页
镀金
镀金
镀银
镀合金(黄铜)
镀锌铁丝
3.1 在钢管表面镀锌
粗铜
CuSO4溶液
纯铜或钢板
Zn
钢管
ZnSO4溶液
3.1 在钢管表面镀锌
Zn
Fe
ZnSO4溶液
3.1 在钢管表面镀锌
Zn
Fe
ZnSO4溶液
理论分析:
阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
向阴极迁移
Zn–2e- Zn2+
阳极:
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
向阴极迁移
Zn–2e- Zn2+
阳极:
ZnSO4溶液
3.1 在钢管表面镀锌
Zn
Fe
1
2
1
1
2
显微镜下观察
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
Zn–2e- Zn2+
阳极:
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
向阴极迁移
Zn–2e- Zn2+
阳极:
2e-
阴极:
Zn2+
+
Zn
增大阳离子浓度,可增强其氧化性,可能改变粒子放电顺序
3.2 电镀金
电镀金原理(含氰法)
[Au(CN) ]
2
-
e
-
Au
2CN
-
+
+
2H O
2
2e
-
H
2
↑
2OH
-
+
+
阴极主要电极反应
阳极
阴极
上世纪70年代,研究出亚硫酸无氰镀金法,形成一条无氰镀金流水线,填补了我国无氰镀金的空白,后荣获国家科技进步奖。
镀金工艺改进
[Au(SO ) ]
2
3
3-
e
-
+
Au
+
2SO
2-
3
孙淑兰 (1942- )
景泰蓝制作高级工程师
阴极极主要反应
思考:
请总结从铜矿石到景泰蓝工艺品的过程中用到电解时必须控制的主要生产条件,并论证这些电解过程是否可以被其他方法替代。
调控电压
调控电压
金属
(除Au、Pt)
优先失电子
导电性好的材料
离子浓度,影响放电顺序
影响电解产物
电解时必须控制的主要生产条件
直流电源电压
两电极材料
溶液中粒子浓度
离子交换膜
制备粗铜:
干法炼铜——高温时发生的氧化还原反应
湿法炼铜——常温溶液中的置换反应,或者电解
粗铜电解精炼:电解
镀金:电解
电解是最强有力的氧化还原手段,借助电解可以使非自发的氧化还原反应进行。
时间 铜胎体 镀金方法
明景泰年间 黄铜 (铜锌合金,粗铜) 鎏金(将糊状的金汞合金,均匀地涂到干净的器物表面,加热使汞挥发)
当代 紫铜 (纯铜)
电镀
景泰蓝生产工艺演变
课后思考
1.电解法在当代景泰蓝生产工艺中有着不可替代的作用。请再列举三个用电解法制备物质的工业生产实例,并解释其中的电解原理。
2.真实的景泰蓝工业生产中,黄铜矿用氯化物溶液浸出后的溶液中还含有亚铜离子,请预测亚铜离子在电解得粗铜的过程中发生了哪些变化。
电解池
第3课时
第二课时课后思考题
1.电解法在当代景泰蓝生产工艺中有着不可替代的作用。请再列举三个用电解法制备物质的工业生产实例,并解释其中的电解原理。
2.真实的景泰蓝工业生产中,黄铜矿用氯化物溶液浸出后的溶液中还含有亚铜离子,请预测亚铜离子在电解得粗铜的过程中发生了哪些变化。
对于像钠、镁、铝这样非常活泼的金属,采用一般的还原剂很难将它们从其化合物中还原出来,工业上常用电解法冶炼。
金属冶炼就是使矿石中的金属离子获得电子还原成金属单质的过程:Mn+ + n e- M
1. 电冶金
1.1 工业制金属钠
钠块放入水中
2NaCl(熔融)
电解
2Na + Cl2
1.1 工业制金属钠
2e-
↑
2Cl-
Cl2
-
阳极:
阴极:
e-
Na+
+
Na
总反应:
↑
电解熔融氯化钠装置示意图
NaCl进口
NaCl
(熔融)
Cl2出口
Na
(液态)
Na出口
阴极
阴极
阳极
1.2 工业制金属镁
阴极:
2e-
Mg2+
+
Mg
↑
2e-
2Cl-
Cl2
-
阳极:
总反应:
MgCl2(熔融)
Mg + Cl2
电解
↑
海水提镁
流程图
1.3 工业制金属铝
资料:(1)AlCl3是共价化合物;Al2O3是离子化合物。
(2)Al2O3熔点2050℃。
2Al2O3(熔融)
4Al + 3O2
电解
↑
冰晶石
戴维(英 化学家)
莫瓦桑电解制氟仪器装置图(1886年)
自从1807年戴维首次使用电解方法制得金属钾,之后的研究继续用电解法获得了钠、钙、镁、钡、锶、硼、硅、铝、氟等单质。电解为这些元素的发现立下了汗马功劳。
思考题2 真实的景泰蓝工业生产中,黄铜矿用氯化物溶液浸出后的溶液中还含有亚铜离子,请预测亚铜离子在电解得粗铜的过程中发生了哪些变化。
电解池工作原理
示意图
分析电解池工作原理
的基本步骤
电源
阳极
阴极
溶液中离子
阴离子
阳离子
电极反应
放电顺序
已知:黄铜矿经氯化物溶液浸出后的溶液中含有一定浓度Cu2+、Na+、H+ 、Cu+、Cl-、CuCl2 等。
其中存在平衡:CuCl2 Cu+ + 2Cl-
-
-
2.1 阴极
e-
Cu+
+
Cu
(1)预测
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(2)实验证据
阴极碳棒上有暗红色固体析出,阴极附近的溶液中Cu+浓度增大。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(3)再分析
阳离子
Cu2+ Na+ H+ Cu+
放电顺序:
Cu2+ > H+ > Na+
查阅资料:放电顺序:
Cu+ > Cu2+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(3)再分析
CuCl2- Cu+ + 2Cl-
放电顺序:
Cu+ > Cu2+ > H+ > Na+
阳离子
Cu2+ Na+ H+ Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(3)再分析
放电顺序:
Cu+ > Cu2+ > H+ > Na+
e-
Cu+
+
Cu
e-
Cu2+
+
Cu+
阳离子
Cu2+ Na+ H+ Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(4)小结
粒子考虑全,
放电有优先,
电压可调控,
实验证据现。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(1)预测
2e-
↑
2Cl-
Cl2
-
H2O
H+
OH-
+
通电前:
通电时:
Cl- > OH-
放电顺序:
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
CuCl2 Cu+ + 2Cl-
-
2.2 阳极
(2)实验证据
阳极没有Cl2逸出,阳极附近溶液中的Cu2+浓度增大。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(3)再分析:原因
2e-
2Cl-
Cl2↑
-
假设1:
Cl2
2Cu+
+
2Cu2+
+ 2Cl-
假设2:
e-
Cu+
-
Cu2+
Cl-未参与反应。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(4)设计实验验证
e-
Cu+
-
Cu2+
NaCl溶液
实验:相同电压下,电解相同Cl-浓度的NaCl溶液。
现象:没有检验到Cl2。
结论:假设2成立。
e-
Cu+
-
Cu2+
e-
Cu+
+
Cu
阳极主反应:
阴极主反应:
e-
Cu2+
+
Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(5)小结
有还原性的阳离子
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
e-
Cu+
-
Cu2+
e-
Cu+
+
Cu
阳极主反应:
阴极主反应:
e-
Cu2+
+
Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
电解得粗铜的过程中
Cu+在两极反应,会降低Cu的产率。
怎么改进一下电解池结构呢?
2.3 改进电解池结构
e-
Cu+
-
Cu2+
e-
Cu+
+
Cu
阳极:
阴极:
e-
Cu2+
+
Cu+
电解池 总结
任务1 电解得粗铜的原理
任务2 粗铜电解精炼得精铜
任务3 电镀——镀金
1.列举三个像景泰蓝生产工艺中用电解法制备物质的
工业生产实例。
2.真实的景泰蓝生产工艺中,电解得粗铜过程中Cu+
的变化。
实验室探究
深度思考
电解池 总结
阳极:氧化反应
阴极:还原反应
电能直接转化为化学能
是最强有力的氧化还原手段
能量
电解
方法
反应
宏观
微观
电解池 总结
电解池 总结
原电池
电解池
工作原理示意图
电解质溶液
(或熔融电解质)
电极
隔膜
电解电压
电解池 研究变量
电解时必须控制的主要生产条件
直流电源电压
两电极材料
溶液中粒子浓度
离子交换膜
电解池 影响电解产物的因素
内因
粒子的氧化性或还原性
一般情况下,放电顺序为:
阴极:Cu2+ > H+ > Na+
阳极:金属(除金、铂) > Cl- > OH-
Cu+在阴极和阳极都可以反应
外因
浓度
电压
如镀锌,粒子的氧化性或还原性随浓度增大而增强
调控不同氧化性或还原性的粒子是否发生反应
电解池 影响电解产物的因素
外因
浓度
电压
离子交换膜
……
如镀锌,粒子的氧化性或还原性随浓度增大而增强
调控不同氧化性或还原性的粒子是否发生反应
调控产物种类、产率等。
电解池 影响电解产物的因素
电解
原理
无机物的
电解制备
电有机合成
环境保护电化学
电化学腐蚀与防护
谢谢观看!
第二节
电解池
新人教版选择性必修一
第四章 化学反应与电能
电解池
第1课时
从铜矿石到景泰蓝工艺品
黄铜矿
紫铜胎体
景泰蓝工艺品
从铜矿石到景泰蓝工艺品
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2 NaCl
湿法炼铜
粗铜
精铜
紫铜胎体
电解
电解精炼
和
从铜矿石到景泰蓝工艺品
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2 NaCl
湿法炼铜
粗铜
精铜
掐丝、点蓝、烧蓝、磨光
紫铜胎体
景泰蓝工艺品
电解
电解精炼
镀金
和
任务1 实验室探究电解得粗铜的原理
浸出液
主要成分
CuCl2和NaCl
湿法炼铜
粗铜
电解
任务1 实验室探究电解得粗铜的原理
浸出液
主要成分
CuCl2和NaCl
湿法炼铜
粗铜
电解
1.1 电解CuCl2溶液
1.2 电解NaCl溶液
1.3 电解CuCl2和NaCl的混合溶液
1.1 用石墨电极电解CuCl2溶液
与直流电源的负极相连
与直流电源的正极相连
1.1 用石墨电极电解CuCl2溶液
1.1 用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
宏观
微观
通电前
通电前:
H2O
H+
OH-
+
CuCl2
Cu2+
+
2Cl-
1.1 用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
符号表征
通电前:
H2O
H+
OH-
+
CuCl2
Cu2+
+
2Cl-
1.1 用石墨电极电解CuCl2溶液
思考:电解CuCl2溶液生成Cu和Cl2的原理是什么?
符号表征
通电时:
向阴极迁移
向阳极迁移
通电前:
H2O
H+
OH-
+
CuCl2
Cu2+
+
2Cl-
通电时:
向阴极迁移
向阳极迁移
2e-
↑
2Cl-
Cl2
-
氧化反应
放电顺序
Cl- > OH-
2e-
Cu2+
+
Cu
还原反应
Cu2+ > H+
放电顺序
通电时:
阴极
阳极
2e-
Cu2+
+
Cu
还原反应
Cu2+ > H+
放电顺序
2e-
↑
2Cl-
Cl2
-
氧化反应
放电顺序
Cl- > OH-
↑
总反应:
Cu2+ + 2Cl- Cu + Cl2
电解
电解池:把电能直接转化为化学能的装置。
电解:使电流通过电解质溶液(或熔融电解质)而
在阳极、阴极引起氧化还原反应的过程。
电解池工作原理示意图
阳离子
阴离子
e-
离子导体
e-
氧化反应
还原反应
电解池工作原理
示意图
分析电解池工作原理
的基本步骤
电源
阳极
阴极
溶液中离子
阴离子
阳离子
电极反应
放电顺序
1.2 用石墨电极电解NaCl溶液
思考:请依据电解的基本原理,预测电解
饱和食盐水的产物,并设计实验检验。
1.2 用石墨电极电解NaCl溶液
通电前:
NaCl Na+ + Cl-
H2O H+ + OH-
向阴极迁移
向阳极迁移
阴极 阳极
离子
分析 电极 反应
产物检验方法 湿润淀粉KI试纸
检验Cl2
总反应
Cl- OH-
Na+ H+
点燃法检验H2
酚酞溶液检验碱性
2e-
↑
2Cl-
Cl2
-
↑
2NaCl +
2H2O
电解
H2 + 2NaOH + Cl2
↑
H2O
H+
OH-
+
2e-
↑
2H+
H2
+
2e-
↑
2H2O
H2 +2OH-
+
思 考
能否用该电解池制备Cl2、H2 和NaOH?若不能,该怎样改进装置?
阴极区域
阳极区域
↑
2NaCl +
2H2O
电解
H2 + 2NaOH + Cl2
↑
1.Cl2 与 NaOH 反应
Cl2 + 2OH- ClO- + Cl- + H2O
一定条件
2.H2 与 Cl2 混合易爆炸
H2 + Cl2 2HCl
↑
2NaCl +
2H2O
电解
H2 + 2NaOH + Cl2
↑
Na+
精制饱和
NaCl溶液
H2O
(含少量NaOH)
隔膜
电解池工作原理示意图
阳离子
阴离子
e-
离子导体
e-
阳离子交换膜
电中性
电中性
氧化反应
还原反应
1.3 用石墨电极电解CuCl2和NaCl的混合溶液
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2
NaCl
湿法
炼铜
电
解
粗铜
电解CuCl2溶液
电解NaCl溶液
惰性电极:在实验条件下,放电顺序为:
阴极:Cu2+ > H+ > Na+
阳极:Cl- > OH-
第一课时 总结
电解:使电流通过电解质溶液(或熔融电解质)而
在阳极、阴极引起氧化还原反应的过程。
借助电解可以使非自发的氧化还原反应进行。
在生活、生产和科学研究中具有重要意义。
课后思考
1.根据已经学到的电解原理设计:怎样将粗铜电解精炼得精铜,怎样镀金,以制得景泰蓝工艺品?
2.电解池的模型还可能有什么样的变化,以指导实
际工业生产?
电解池
第2课时
从铜矿石到景泰蓝工艺品
黄铜矿
氯化物溶液
浸出液
主要成分
CuCl2 NaCl
湿法炼铜
粗铜
精铜
掐丝、点蓝、烧蓝、磨光
紫铜胎体
景泰蓝工艺品
电解
电解精炼
镀金
和
任务2 粗铜电解精炼得精铜
粗铜中含Cu约98.5%,还含有Fe、Ag、Au等杂质,怎么用电解的方法得到纯铜?请设计实验。
任务2 粗铜电解精炼得精铜
阴极
出铜
电解CuCl2溶液
还原反应
2e-
Cu2+
+
Cu
任务2 粗铜电解精炼得精铜
阴极铁钉
电解NaCl溶液
阴极:得电子,还原反应,
金属作阴极,不参与反应。
任务2 粗铜电解精炼得精铜
Cu–2e- Cu2+
氧化反应
粗铜
还原反应
2e-
Cu2+
+
Cu
纯铜
CuSO4溶液
资料
任务2 粗铜电解精炼得精铜
纯铜或钢板
CuSO4溶液
粗铜
阳极
放电顺序:
金属 > OH- > SO
2-
4
Cu–2e- Cu2+
Fe–2e- Fe2+
阳极
放电顺序:
金属 > OH- > SO
2-
4
Cu–2e- Cu2+
Fe–2e- Fe2+
阳极泥
阳极
Cu–2e- Cu2+
Fe–2e- Fe2+
阴极
CuSO4溶液
2e-
Cu2+
+
Cu
放电顺序:Cu2+ > H+ > Fe2+
放电顺序:
金属 > OH- > SO
2-
4
任务2 粗铜电解精炼得精铜
金属(除金、铂)
金属优先失电子
金属(除金、铂)
金属优先失电子
任务2 粗铜电解精炼得精铜
任务3 电镀
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。主要目的是增强金属抗腐蚀能力,增加美观或表面硬度。镀层金属通常是铬、镍、银、黄铜等。
铁合页
镀金合页
镀金
镀金
镀银
镀合金(黄铜)
镀锌铁丝
3.1 在钢管表面镀锌
粗铜
CuSO4溶液
纯铜或钢板
Zn
钢管
ZnSO4溶液
3.1 在钢管表面镀锌
Zn
Fe
ZnSO4溶液
3.1 在钢管表面镀锌
Zn
Fe
ZnSO4溶液
理论分析:
阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
向阴极迁移
Zn–2e- Zn2+
阳极:
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
向阴极迁移
Zn–2e- Zn2+
阳极:
ZnSO4溶液
3.1 在钢管表面镀锌
Zn
Fe
1
2
1
1
2
显微镜下观察
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
Zn–2e- Zn2+
阳极:
3.1 在钢管表面镀锌
理论分析:阳极:Zn 阴极:Fe
通电前:
H2O
H+
OH-
+
ZnSO4
Zn2+
+
SO
2-
4
通电时:
向阴极迁移
Zn–2e- Zn2+
阳极:
2e-
阴极:
Zn2+
+
Zn
增大阳离子浓度,可增强其氧化性,可能改变粒子放电顺序
3.2 电镀金
电镀金原理(含氰法)
[Au(CN) ]
2
-
e
-
Au
2CN
-
+
+
2H O
2
2e
-
H
2
↑
2OH
-
+
+
阴极主要电极反应
阳极
阴极
上世纪70年代,研究出亚硫酸无氰镀金法,形成一条无氰镀金流水线,填补了我国无氰镀金的空白,后荣获国家科技进步奖。
镀金工艺改进
[Au(SO ) ]
2
3
3-
e
-
+
Au
+
2SO
2-
3
孙淑兰 (1942- )
景泰蓝制作高级工程师
阴极极主要反应
思考:
请总结从铜矿石到景泰蓝工艺品的过程中用到电解时必须控制的主要生产条件,并论证这些电解过程是否可以被其他方法替代。
调控电压
调控电压
金属
(除Au、Pt)
优先失电子
导电性好的材料
离子浓度,影响放电顺序
影响电解产物
电解时必须控制的主要生产条件
直流电源电压
两电极材料
溶液中粒子浓度
离子交换膜
制备粗铜:
干法炼铜——高温时发生的氧化还原反应
湿法炼铜——常温溶液中的置换反应,或者电解
粗铜电解精炼:电解
镀金:电解
电解是最强有力的氧化还原手段,借助电解可以使非自发的氧化还原反应进行。
时间 铜胎体 镀金方法
明景泰年间 黄铜 (铜锌合金,粗铜) 鎏金(将糊状的金汞合金,均匀地涂到干净的器物表面,加热使汞挥发)
当代 紫铜 (纯铜)
电镀
景泰蓝生产工艺演变
课后思考
1.电解法在当代景泰蓝生产工艺中有着不可替代的作用。请再列举三个用电解法制备物质的工业生产实例,并解释其中的电解原理。
2.真实的景泰蓝工业生产中,黄铜矿用氯化物溶液浸出后的溶液中还含有亚铜离子,请预测亚铜离子在电解得粗铜的过程中发生了哪些变化。
电解池
第3课时
第二课时课后思考题
1.电解法在当代景泰蓝生产工艺中有着不可替代的作用。请再列举三个用电解法制备物质的工业生产实例,并解释其中的电解原理。
2.真实的景泰蓝工业生产中,黄铜矿用氯化物溶液浸出后的溶液中还含有亚铜离子,请预测亚铜离子在电解得粗铜的过程中发生了哪些变化。
对于像钠、镁、铝这样非常活泼的金属,采用一般的还原剂很难将它们从其化合物中还原出来,工业上常用电解法冶炼。
金属冶炼就是使矿石中的金属离子获得电子还原成金属单质的过程:Mn+ + n e- M
1. 电冶金
1.1 工业制金属钠
钠块放入水中
2NaCl(熔融)
电解
2Na + Cl2
1.1 工业制金属钠
2e-
↑
2Cl-
Cl2
-
阳极:
阴极:
e-
Na+
+
Na
总反应:
↑
电解熔融氯化钠装置示意图
NaCl进口
NaCl
(熔融)
Cl2出口
Na
(液态)
Na出口
阴极
阴极
阳极
1.2 工业制金属镁
阴极:
2e-
Mg2+
+
Mg
↑
2e-
2Cl-
Cl2
-
阳极:
总反应:
MgCl2(熔融)
Mg + Cl2
电解
↑
海水提镁
流程图
1.3 工业制金属铝
资料:(1)AlCl3是共价化合物;Al2O3是离子化合物。
(2)Al2O3熔点2050℃。
2Al2O3(熔融)
4Al + 3O2
电解
↑
冰晶石
戴维(英 化学家)
莫瓦桑电解制氟仪器装置图(1886年)
自从1807年戴维首次使用电解方法制得金属钾,之后的研究继续用电解法获得了钠、钙、镁、钡、锶、硼、硅、铝、氟等单质。电解为这些元素的发现立下了汗马功劳。
思考题2 真实的景泰蓝工业生产中,黄铜矿用氯化物溶液浸出后的溶液中还含有亚铜离子,请预测亚铜离子在电解得粗铜的过程中发生了哪些变化。
电解池工作原理
示意图
分析电解池工作原理
的基本步骤
电源
阳极
阴极
溶液中离子
阴离子
阳离子
电极反应
放电顺序
已知:黄铜矿经氯化物溶液浸出后的溶液中含有一定浓度Cu2+、Na+、H+ 、Cu+、Cl-、CuCl2 等。
其中存在平衡:CuCl2 Cu+ + 2Cl-
-
-
2.1 阴极
e-
Cu+
+
Cu
(1)预测
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(2)实验证据
阴极碳棒上有暗红色固体析出,阴极附近的溶液中Cu+浓度增大。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(3)再分析
阳离子
Cu2+ Na+ H+ Cu+
放电顺序:
Cu2+ > H+ > Na+
查阅资料:放电顺序:
Cu+ > Cu2+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(3)再分析
CuCl2- Cu+ + 2Cl-
放电顺序:
Cu+ > Cu2+ > H+ > Na+
阳离子
Cu2+ Na+ H+ Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(3)再分析
放电顺序:
Cu+ > Cu2+ > H+ > Na+
e-
Cu+
+
Cu
e-
Cu2+
+
Cu+
阳离子
Cu2+ Na+ H+ Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.1 阴极
(4)小结
粒子考虑全,
放电有优先,
电压可调控,
实验证据现。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(1)预测
2e-
↑
2Cl-
Cl2
-
H2O
H+
OH-
+
通电前:
通电时:
Cl- > OH-
放电顺序:
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
CuCl2 Cu+ + 2Cl-
-
2.2 阳极
(2)实验证据
阳极没有Cl2逸出,阳极附近溶液中的Cu2+浓度增大。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(3)再分析:原因
2e-
2Cl-
Cl2↑
-
假设1:
Cl2
2Cu+
+
2Cu2+
+ 2Cl-
假设2:
e-
Cu+
-
Cu2+
Cl-未参与反应。
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(4)设计实验验证
e-
Cu+
-
Cu2+
NaCl溶液
实验:相同电压下,电解相同Cl-浓度的NaCl溶液。
现象:没有检验到Cl2。
结论:假设2成立。
e-
Cu+
-
Cu2+
e-
Cu+
+
Cu
阳极主反应:
阴极主反应:
e-
Cu2+
+
Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
2.2 阳极
(5)小结
有还原性的阳离子
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
e-
Cu+
-
Cu2+
e-
Cu+
+
Cu
阳极主反应:
阴极主反应:
e-
Cu2+
+
Cu+
一定浓度Cu2+、Na+、H+ 、
Cu+、Cl-、CuCl2
-
电解得粗铜的过程中
Cu+在两极反应,会降低Cu的产率。
怎么改进一下电解池结构呢?
2.3 改进电解池结构
e-
Cu+
-
Cu2+
e-
Cu+
+
Cu
阳极:
阴极:
e-
Cu2+
+
Cu+
电解池 总结
任务1 电解得粗铜的原理
任务2 粗铜电解精炼得精铜
任务3 电镀——镀金
1.列举三个像景泰蓝生产工艺中用电解法制备物质的
工业生产实例。
2.真实的景泰蓝生产工艺中,电解得粗铜过程中Cu+
的变化。
实验室探究
深度思考
电解池 总结
阳极:氧化反应
阴极:还原反应
电能直接转化为化学能
是最强有力的氧化还原手段
能量
电解
方法
反应
宏观
微观
电解池 总结
电解池 总结
原电池
电解池
工作原理示意图
电解质溶液
(或熔融电解质)
电极
隔膜
电解电压
电解池 研究变量
电解时必须控制的主要生产条件
直流电源电压
两电极材料
溶液中粒子浓度
离子交换膜
电解池 影响电解产物的因素
内因
粒子的氧化性或还原性
一般情况下,放电顺序为:
阴极:Cu2+ > H+ > Na+
阳极:金属(除金、铂) > Cl- > OH-
Cu+在阴极和阳极都可以反应
外因
浓度
电压
如镀锌,粒子的氧化性或还原性随浓度增大而增强
调控不同氧化性或还原性的粒子是否发生反应
电解池 影响电解产物的因素
外因
浓度
电压
离子交换膜
……
如镀锌,粒子的氧化性或还原性随浓度增大而增强
调控不同氧化性或还原性的粒子是否发生反应
调控产物种类、产率等。
电解池 影响电解产物的因素
电解
原理
无机物的
电解制备
电有机合成
环境保护电化学
电化学腐蚀与防护
谢谢观看!
