化学人教版(2019)选择性必修1 4.1 原电池(共123张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1 原电池(共123张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 63.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-07 00:00:00 | ||
图片预览








文档简介
(共123张PPT)
第一节
原电池
新人教版选择性必修一
第四章 化学反应与电能
原电池
第1课时
各种化学电源
写出原电池中的总反应方程式和电极反应式,并标出电子转移和离子迁移的方向。
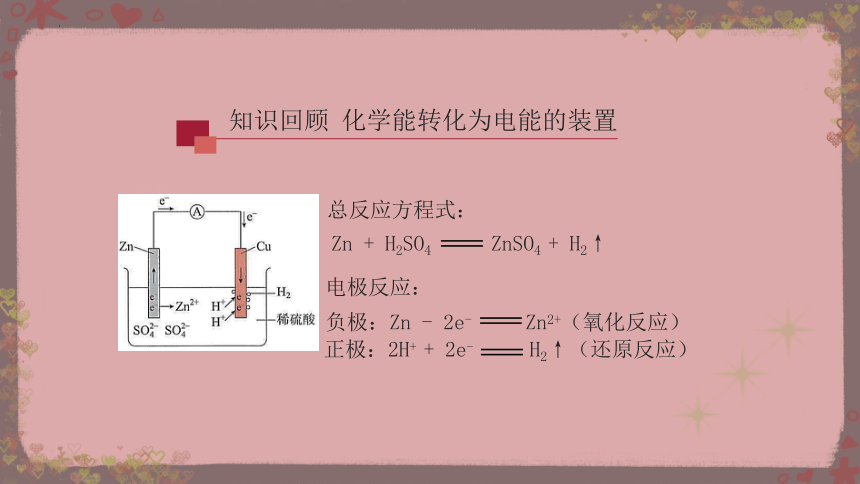
知识回顾 化学能转化为电能的装置
Zn + H2SO4 ZnSO4 + H2↑
电极反应:
负极:Zn - 2e- Zn2+(氧化反应)
正极:2H+ + 2e- H2↑(还原反应)
总反应方程式:
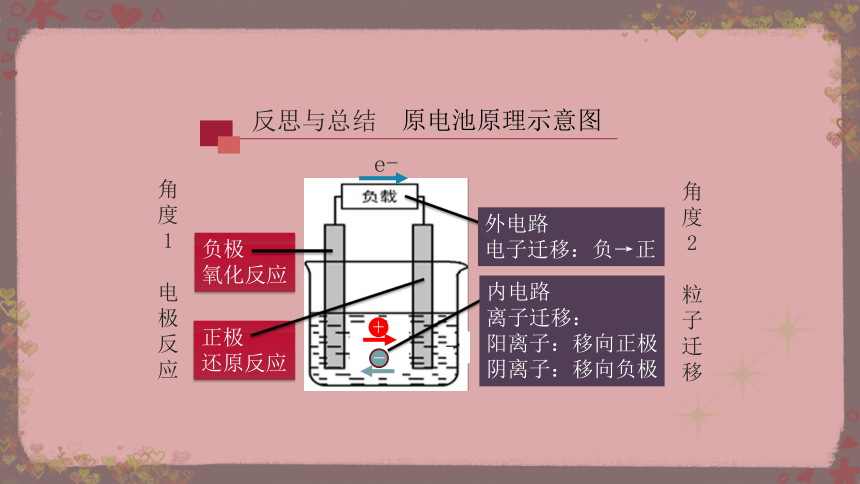
知识回顾 化学能转化为电能的装置
负极
氧化反应
正极
还原反应
+
-
e-
外电路
电子迁移:负→正
内电路
离子迁移:
阳离子:移向正极
阴离子:移向负极
角度1
电极反应
角度2
粒子迁移
原电池原理示意图
反思与总结
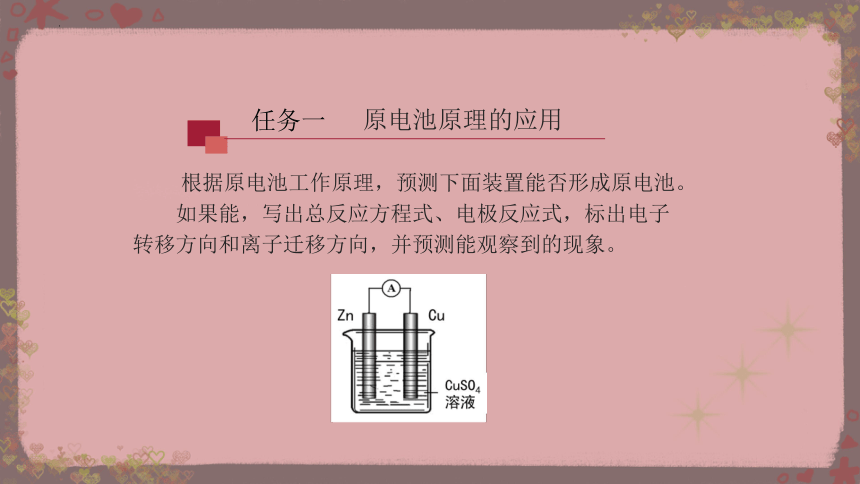
任务一
根据原电池工作原理,预测下面装置能否形成原电池。
如果能,写出总反应方程式、电极反应式,标出电子转移方向和离子迁移方向,并预测能观察到的现象。
原电池原理的应用
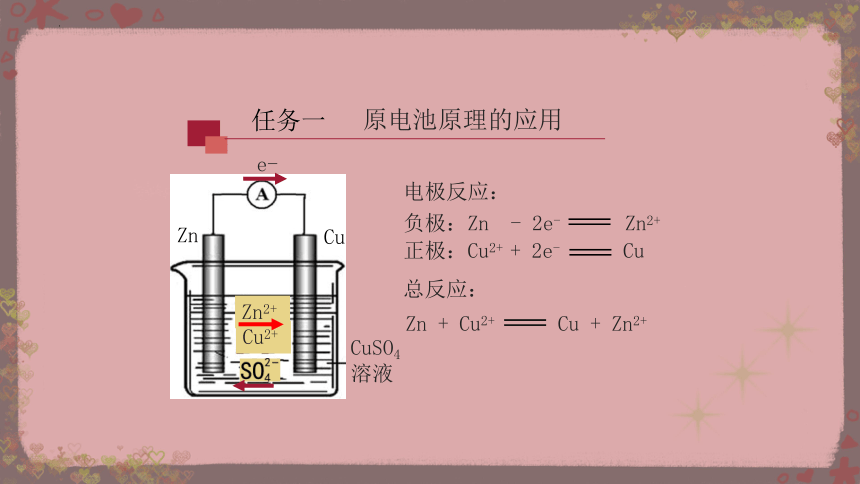
Zn + Cu2+ Cu + Zn2+
电极反应:
负极:Zn - 2e- Zn2+
正极:Cu2+ + 2e- Cu
总反应:
e-
Zn2+
Cu
Zn
CuSO4溶液
Cu2+
任务一
原电池原理的应用
观察并记录实验现象,其中哪些与预测一致,哪些与预测不同?
任务一
原电池原理的应用
实验现象:铜片、锌片表面均附着红色固体,电流表指针偏转,但电流逐渐衰减。
相同:铜片表面附着红色固体,电流表指针偏转。
不同:锌片表面附着红色固体
电流逐渐衰减
观察并记录实验现象,其中哪些与预测一致,哪些与预测不同?
任务一
原电池原理的应用
请分析“锌片表面附着红色固体,电流逐渐衰减” 的原因。
思考
Zn片
观点2
现象 原因
锌片表面附着红色固体 Zn片、附着在Zn上的Cu以及CuSO4溶液局部形成了原电池,促进了Cu在锌片表面析出。
电流逐渐 衰减 转移的电子没有经过导线,电流逐渐衰减
装置携带不方便
能量转化不充分
……
为什么没有直接利用该装置作为化学电源?
思考
理想的化学电源的特点:
便于携带
内阻小
质量小
反复使用
单位质量或单位体积输出的能量多
价格便宜
体积小
连续工作
寿命长
如何实现?
……
该装置能量转化率低的原因是什么?如何解决?
任务二
原电池装置的改造
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
方案展示
两个溶液间缺少离子导体,无法形成闭合回路。
为什么没有电流?该如何解决?
任务二
原电池装置的改造
盐桥中通常装有含KCl饱和溶液的琼胶, K+和Cl-可在其中自由移动。
盐桥
一种凝胶态的离子导体
任务二
原电池装置的改造
↑
↑
Cl-
K+
观察实验现象
双液电池的工作原理
CuSO4溶液
Zn
Cu
e-
Zn2+
Cu2+
Cl-
K+
负极:
Zn - 2e- Zn2+
正极:
Cu2+ + 2e- Cu
盐桥中的离子迁移进入两侧电解质溶液,联通了两侧电解质溶液,从而形成闭合回路。
ZnSO4溶液
e-
双液电池
单液电池
请绘制前面双液电池的工作原理示意图。要求包括以下内容:
(1)注明原电池的组成;
(2)标明氧化反应和还原反应发生的区域;
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
任务二
原电池装置的改造
+
-
方案展示
负极
氧化反应
正极
还原反应
电池工作时,装置中各物质或材料的作用是什么?能否用其他物质或材料代替?
思考
各部分的作用
Cu片 电极材料
Zn片 电极反应物 电极材料
CuSO4溶液 电极反应物 离子导体
ZnSO4溶液 离子导体
盐桥 离子导体
导线 电子导体
任务二
原电池装置的改造
原电池的构成要素
还原剂-氧化反应、氧化剂-还原反应
离子导体
电极材料
电极反应
电子导体
反思与总结
内电路,实现离子定向迁移
进行电子转移的场所
外电路,实现电子定向转移
基本要素
原电池 双液电池 单液电池
电极反应 正极:Cu2+ + 2e- Cu 负极:Zn - 2e- Zn2+ 正极:Cu2+ + 2e- Cu
负极:Zn - 2e- Zn2+
电极材料 正极:铜片; 负极:锌片 正极:铜片; 负极:锌片
离子导体 ZnSO4溶液、盐桥、CuSO4溶液 CuSO4 溶液
电子导体 导线 导线
双液原电池解决了电池自损耗的问题。
根据原电池工作原理,将下列氧化还原反应设计成原电池:
2Fe3+ + 2I- 2Fe2+ + I2
评价活动
要求:
(1)分别写出氧化反应和还原反应。
(2)根据原电池构成要素,选择合适的物质或材料,并画出原电池的工作原理示意图。
(1)氧化反应:
2I- - 2e- I2
还原反应:
2Fe3+ + 2e- 2Fe2+
(2)
(2)
(1)氧化反应:
2I- - 2e- I2
还原反应:
2Fe3+ + 2e- 2Fe2+
同学甲
同学乙
方案展示
石墨
石墨
石墨
石墨
实验
现象
KI
溶液
FeCl3
溶液
含KCl溶液
滤纸条
滴加
淀粉液
滴加铁氰
化钾溶液
(2)
同学丙
方案展示
只允许K+或Cl-通过的隔膜
(1)氧化反应:
2I- - 2e- I2
还原反应:
2Fe3+ + 2e- 2Fe2+
自发的氧化还原反应
闭合
回路
原电池
化学能
电能
离子导体
电极材料
电极反应
反思与总结 原电池工作原理
电子导体
还原反应
氧化反应
理想的化学电源的特点:
便于携带
内阻小
质量小
反复使用
单位质量或单位体积输出的能量多
价格便宜
体积小
连续工作
寿命长
如何实现?
……
原电池
第2课时
结构简单
一次电池
反复使用
二次电池
连续工作
燃料电池
新型电池
电池的研发
原电池的构成要素
自发的氧化还原反应
闭合
回路
原电池
化学能
电能
离子导体
电极材料
电极反应
电子导体
还原反应
氧化反应
知识回顾
一、一次电池
一次电池是放电后不可充电的电池。
碱性干电池
银锌电池
认识普通锌锰干电池
任务一
构造示意图
普通锌锰干电池是最早进入市场的实用干电池。因其电解质溶液用淀粉糊固定化,称为干电池。
认识普通锌锰干电池
任务一
结合资料和示意图分析:
电极反应中的还原剂和氧化剂、电极材料、离子导体。
资料
普通锌锰干电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2 Zn(NH3)2Cl2+2MnO(OH)
构造示意图
0
+4
+3
+2
电极反应活性物质 负极:Zn
正极:MnO2
电极材料 负极:Zn
正极:石墨棒
离子导体 NH4Cl和ZnCl2混合物
构造示意图
3.分析普通锌锰干电池长期占据市场和现在逐渐被替代的可能原因。
认识普通锌锰干电池
任务一
Zn
石墨棒
NH4Cl
MnO2
NH4Cl
ZnCl2
A
单液电池
优点:结构简单、价格低廉。
缺点:会发生自放电。
Zn
石墨棒
NH4Cl
MnO2
NH4Cl
ZnCl2
A
单液电池
放置不同时间后的普通锌锰干电池
碱性锌锰干电池
容量高,能大电流连续放电。还具有优良的低温性能、储存性能和防漏性能。
碱性锌锰干电池结构
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
MnO2和
KOH混合物
已知该电池总反应为:
Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2
资料
根据示意图和资料:
1.分析各部分的作用,
画出工作原理示意图;
2.写出电极反应式。
认识碱性锌锰干电池
任务二
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
0
+4
+3
+2
MnO2和
KOH混合物
观点展示
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
电极反应 还原剂:Zn粉
氧化剂 :MnO2
电极材料 负极:铜针
正极:金属外壳
离子导体 KOH、离子型导电隔膜
MnO2和
KOH混合物
+
-
正极
金属
外壳
离子型导电隔膜
Zn粉
KOH
混合物
负极
铜针
MnO2
KOH
混合物
e-
+
-
负极:Zn - 2e- + 2OH- Zn(OH)2
正极:2MnO2 + 2e- + 2H2O 2MnO(OH) + 2OH-
正极
金属
外壳
离子型导电隔膜
Zn粉
KOH
混合物
负极
铜针
MnO2
KOH
混合物
e-
+
-
总反应:Zn + 2MnO2 + 2H2O 2MnO(OH) + Zn(OH)2
0
+4
+3
+2
资料
①碱性干电池增大了正负极间的相对面积,用高导电性的氢氧化钾溶液替代了氯化铵、氯化锌溶液,锌也变成粉末状,同时采用了反应活性更高的电解二氧化锰粉;
②电流是单位时间内通过横截面的电量。
4.阅读资料,找出能使碱性锌锰干电池产生大电流和高电压的设计。
认识碱性锌锰干电池
任务二
电极活性物质
Zn粉、高活性电解MnO2
电极材料
增大相对面积
离子导体
高导电性
的KOH溶液
加快反应速率
减小电池内阻
大电流
高电压
改进方式
改进目的
改进效果
化学电源——原电池原理 + 工艺控制
碱性锌锰干电池
普通锌锰干电池
二、二次电池
二次电池又称可充电电池或蓄电池,是一类放电后可以再充电而反复使用的电池。
认识铅蓄电池
任务三
铅酸蓄电池的构造示意图
铅蓄电池优点
电压稳定
使用方便
安全可靠
价格低廉
稀硫酸
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
资料
铅蓄电池放电时的总反应为:
PbSO4难溶于水,
充电过程与上述过程相反。
1.根据铅蓄电池放电过程的总反应写出电极反应式。
认识铅蓄电池
任务三
0
+4
+2
正极:PbO2 + 4H+ + + 2e- PbSO4 + 2H2O
负极:Pb + - 2e- PbSO4
SO4
2-
SO4
2-
认识铅蓄电池
任务三
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
0
+4
+2
总反应:
2.铅蓄电池的电极反应物(Pb、PbO2)和放电后的产物(PbSO4)均以固体形式附着在电极材料表面,分析这样设计的目的。
认识铅蓄电池
任务三
目的:使电极反应物和产物富集在电极材料表面,充、放电时可以循环转化,实现电池重复使用。
Pb
PbSO4
PbO2
PbSO4
放
电
充
电
负极
正极
放
电
充
电
1.利用下面反应,设计能够连续提供电能的原电池。
2H2 + O2 2H2O
实验用品:
H2、O2、稀硫酸、石墨棒、试管、U形管、导管、导线、电流表等。
绘制实验装置图,并思考:
①电池中的电极反应是什么;
②装置是如何实现连续工作的。
设计连续工作的电池
任务四
e-
H2
O2
H2SO4溶液
石墨棒
负极:2H2 - 4e- 4H+
正极:O2 + 4H+ + 4e- 2H2O
由于燃料和氧化剂连续地由外部供给并在电极上进行反应,生成物不断地被排出,因此可以实现连续供电。
石墨棒
设计连续工作的电池
任务三
H2
O2
H2SO2
溶液
2.如何使气体反应物快速、充分的反应?
设计连续工作的电池
任务三
增大接触面积
使用
催化剂
负极:2H2 - 4e- 4H+
正极:O2 + 4H+ + 4e- 2H2O
氢氧燃料电池工作原理示意图
稀
硫
酸
资料
氢氧燃料电池汽车
能连续不断地提供电能
三、燃料电池
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电源。
能量转化率超80%
绿色发电装置
② 电池内部的电极材料和离子导体在工作过程中不发生改变,使燃料电池可以持续工作。
燃料电池的特点
① 燃料和氧化剂连续的由外部供给,生成物不断地被排出,可以连续不断地提供电能。
电池类型 原理 工艺及目的
一次电池 原电池原理 加入隔膜分隔氧化剂与还原剂,减少电池自损耗。
二次电池 原电池及 电解池原理 将相关活性物质富集在电极材料表面,实现物质循环转化。
燃料电池 原电池原理 燃料和氧化剂连续由外部提供,保持电极材料和离子导体稳定,能够实现连续工作。
重视废旧电池的回收利用,减少环境污染,节约资源。
普通干电池
二次电池
……
碱性干电池
有巨大研究潜力的电池
用废纸发电的生物电池
理论上计算
一张A4纸可产生的电力大约相当于6节5号电池的电量!
新型柔性电池:
有巨大研究潜力的电池
原电池
第3课时
盐水小汽车
资料
小汽车电源结构
盐水小汽车电池工作原理分析
1. 如何形成了原电池?请画出原电池工作示意图进行说明。
任务一
e-
+
-
负极
Zn
NaCl
溶液
观点展示
Zn片 还原剂 电极材料
石墨片 电极材料
浸NaCl溶液的滤纸片 离子导体
正极
石墨
负极:
2Zn - 4e- 2Zn2+
正极:
O2 + 4e- + 2H2O 4OH-
e-
+
-
负极
Zn
NaCl
溶液
总反应:
2Zn + O2 + 2H2O 2Zn(OH)2
观点展示
Zn片 还原剂 电极材料
石墨片 电极材料
浸NaCl溶液的滤纸片 离子导体
正极
石墨
Zn还没有完全消耗,小汽车就跑不动了。
使用前的锌片
与滤纸接触的一面
表面有Zn(OH)2覆盖
2.表面的Zn(OH)2是如何产生的?
盐水小汽车电池工作原理分析
任务一
Zn2+ + 2OH- Zn(OH)2
正极生成的OH-向负极迁移
与负极生成的Zn2+反应
Zn2+
O2
OH-
溶液
电极反应
粒子迁移
分析原电池问题的两个重要角度:
Zn2+
O2
OH-
溶液
3.请给生产商一个改造电池的建议,以能够延长
盐水小汽车行驶的时间。
盐水小汽车电池工作原理分析
任务一
方案展示
特殊性质的膜材料
限制OH-通过的
离子导电性隔膜
负极
正极
石墨
Zn
NaCl
溶液
方案展示
新能源汽车
各种新能源汽车电池
电池类型 镍镉电池 镍氢电池 锂离子电池
比能量/ (W·h·kg-1) 55 60~70 120
循环寿命/次 500以上 1000以上 1000以上
优点 比能量较高、寿命长、耐过充放性好 比能量高、寿命长 比能量高、
寿命长
缺点 镉有毒、有记忆效应、价格较高 价格高、高温充电性差 价高、存在一定安全性问题
比能量(比功率):电池单位质量或单位体积所能输出
电能的多少(或功率的大小)
2019年诺贝尔化学奖得主
吉野彰
约翰·古迪纳夫
斯坦利·惠廷厄姆
锂离子电池的发展
锂金属电池
锂离子电池
作为心脏起搏器的电池应该具备什么样的特点。
回顾锂电池的发展
任务二
1960年,瑞典医生奥克·森宁为一位病人植入了心脏起搏器,并将电池埋在皮下。当电池耗尽后需要手术更换电池。
作为心脏起搏器的电池应该具备什么样的特点。
体积小、质量小、高能量——比能量高
回顾锂电池的发展
任务二
作为心脏起搏器的电池应该具备什么样的特点。
体积小、质量小、高能量——比能量高
回顾锂电池的发展
任务二
怎样提高电池的比能量呢?
转移1mol电子时,消耗金属的质量
科学家们将目光聚焦在了Li上
结合锂的化学性质,思考用金属锂作为负极材料时需要注意的问题。
回顾锂电池的发展
任务二
Li:第二周期IA族;
还原性较强;
易与水和氧气发生反应。
电池的电解质溶液不能含水;
电池要严格密封,防止接触空气。
一次锂金属电池
资料
锂金属电池一般使用MnO2为正极反应物、金属锂或其合金为负极材料、使用非水电解质溶液做离子导体。并且用良好的密封材料进行封装。
放电反应:x Li + MnO2 LixMnO2
负极
正极
一次锂电池价格昂贵,不可充电。请思考如何解决这一问题?
回顾锂电池的发展
任务二
二次电池的特点:
电极反应物和产物在充、放电时可以循环转化,实现电池重复使用。
改进方法:
寻找可以实现物质循环转化的材料或方法。
2019诺贝尔化学奖得主
斯坦利·惠廷厄姆在1976年提出了第一个嵌入脱出型的正极材料TiS2,这几乎标志着从早期的Li—MnO2一次电池到现代二次锂电池的转变。
TiS2
Li+
资料
TiS2是一种微观上具有层状结构的固体材料。充、放电时,
Ti元素的化合价发生变化,层状结构所带电荷量发生改变,锂离子会因此从其中脱出或嵌入。
放电总反应:
x Li + TiS2 LixTiS2
结合资料、总反应与示意图,分析:
1.放电时Li+迁移方向
和电极反应;
2.简单说明其能够反复
充电的理由。
Li
固体TiS2
隔膜
含Li+的
电解质溶液
:Li+
:e-
回顾锂电池的发展
任务二
观点
展示
1.放电时Li+移向正极
正极:TiS2 + x Li+ + x e- LixTiS2
负极:x Li – x e- x Li+
x Li + TiS2 LixTiS2
放电
Li
Li+
TiS2
LixTiS2
放
电
充
电
负极
正极
放
电
充
电
2.
观点
展示
1.放电时Li+移向正极
正极:TiS2 + x Li+ + x e- LixTiS2
负极:x Li – x e- x Li+
x Li + TiS2 LixTiS2
放电
如何解决这个问题?
回顾锂电池的发展
任务二
资料
锂电池充电过程中,锂金属表面会逐渐析出尖锐的锂枝晶,有可能穿透正负极之间的隔膜,造成电池内部短路,引发电池自燃,造成爆炸。
锂枝晶
金属Li
如何解决这个问题?
回顾锂电池的发展
任务二
资料
锂电池充电过程中,锂金属表面会逐渐析出尖锐的锂枝晶,有可能穿透正负极之间的隔膜,造成电池内部短路,引发电池自燃,造成爆炸。
锂枝晶
金属Li
增加隔膜的强度
抑制或阻碍
锂枝晶的形成
约翰·古迪纳夫发现了LiCoO2等一系列正极材料,减少了枝晶短路的可能,进而大幅提升锂电池的稳定性 。
2019年诺贝尔化学奖得主
钴酸锂LiCoO2
资料
与TiS2类似, LiCoO2也是层状结构,锂离子能在放电与充电的过程中脱出或嵌入,实现物质循环转化。
负极
Li
正极 固体LiCoO2
隔膜
电解质溶液
:Li+
:e-
负极材料为金属Li,依然属于二次锂电池
放电时的总反应:
x Li + Li1-xCoO2 LiCoO2
2019诺贝尔化学奖得主
吉野彰将碳基材料用作负极,依旧用钴酸锂做正极,并采用聚乙烯或聚丙烯为隔膜,LiClO4的碳酸丙烯酯液为电解质溶液。确立了现代锂离子电池的基本框架。
放电时的总反应:
LixCy + Li1-xCoO2 LiCoO2 + Cy
负极 LixCy
LixCy
充电时,电子被石墨层结构得到, Li+仅迁移嵌入石墨层间,依然以Li+形式存在,故不存在金属Li。
锂离子电池
LixCy + Li1-xCoO2 LiCoO2 + Cy
放电
充电
充电:x Li+ + Cy + x e- LixCy
负极材料
正极材料
碳基材料作负极,
防止生成锂枝晶
钴酸锂作正极,
减少了锂枝晶
嵌入脱出型
材料TiS2
中国科学家研究成果简介
2018年10月,南开大学梁嘉杰、陈永胜教授课题组与江苏师范大学赖超课题组合作,成功制备了具有多级结构的银纳米线—石墨烯三维多孔载体,并负载金属锂作为复合负极材料,其同样可抑制锂枝晶产生,从而可实现电池超高速充电,有望大幅延长锂电池“寿命”。
已知磷酸铁锂电池放电时的总反应为:
放电时下面电极反应发生在A极还是B极?
LixCy–x e- x Li+ + Cy
LixCy + Li1-xFePO4 LiFePO4 + Cy
2.为了安全、有效的回收锂,拆解废旧电池时需要先进行放电处理,其目的是什么?
评价活动
观点一:反应生成Li+,图示显示Li+向左迁移,所以可以判断反应发生在B电极。
观点二:反应是失去电子的负极反应。图示显示阳离子Li+向左(即正极)迁移,由此判断B极为负极,所以反应发生在B电极。
LixCy–x e- x Li+ + Cy
观点展示
答案:
充分放电后,体系的化学能已充分转化为电能,避免了后续处理过程中继续释放能量,造成安全隐患。
同时放电过程中,Li+从负极B极脱出并向正极A极迁移,使Li元素在正极区富集,更利于有效的回收锂。
2.为了安全、有效的回收锂,拆解废旧电池时需要先进行放电处理,这样的目的是什么?
观点展示
谢谢观看!
第一节
原电池
新人教版选择性必修一
第四章 化学反应与电能
原电池
第1课时
各种化学电源
写出原电池中的总反应方程式和电极反应式,并标出电子转移和离子迁移的方向。
知识回顾 化学能转化为电能的装置
Zn + H2SO4 ZnSO4 + H2↑
电极反应:
负极:Zn - 2e- Zn2+(氧化反应)
正极:2H+ + 2e- H2↑(还原反应)
总反应方程式:
知识回顾 化学能转化为电能的装置
负极
氧化反应
正极
还原反应
+
-
e-
外电路
电子迁移:负→正
内电路
离子迁移:
阳离子:移向正极
阴离子:移向负极
角度1
电极反应
角度2
粒子迁移
原电池原理示意图
反思与总结
任务一
根据原电池工作原理,预测下面装置能否形成原电池。
如果能,写出总反应方程式、电极反应式,标出电子转移方向和离子迁移方向,并预测能观察到的现象。
原电池原理的应用
Zn + Cu2+ Cu + Zn2+
电极反应:
负极:Zn - 2e- Zn2+
正极:Cu2+ + 2e- Cu
总反应:
e-
Zn2+
Cu
Zn
CuSO4溶液
Cu2+
任务一
原电池原理的应用
观察并记录实验现象,其中哪些与预测一致,哪些与预测不同?
任务一
原电池原理的应用
实验现象:铜片、锌片表面均附着红色固体,电流表指针偏转,但电流逐渐衰减。
相同:铜片表面附着红色固体,电流表指针偏转。
不同:锌片表面附着红色固体
电流逐渐衰减
观察并记录实验现象,其中哪些与预测一致,哪些与预测不同?
任务一
原电池原理的应用
请分析“锌片表面附着红色固体,电流逐渐衰减” 的原因。
思考
Zn片
观点2
现象 原因
锌片表面附着红色固体 Zn片、附着在Zn上的Cu以及CuSO4溶液局部形成了原电池,促进了Cu在锌片表面析出。
电流逐渐 衰减 转移的电子没有经过导线,电流逐渐衰减
装置携带不方便
能量转化不充分
……
为什么没有直接利用该装置作为化学电源?
思考
理想的化学电源的特点:
便于携带
内阻小
质量小
反复使用
单位质量或单位体积输出的能量多
价格便宜
体积小
连续工作
寿命长
如何实现?
……
该装置能量转化率低的原因是什么?如何解决?
任务二
原电池装置的改造
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
方案展示
两个溶液间缺少离子导体,无法形成闭合回路。
为什么没有电流?该如何解决?
任务二
原电池装置的改造
盐桥中通常装有含KCl饱和溶液的琼胶, K+和Cl-可在其中自由移动。
盐桥
一种凝胶态的离子导体
任务二
原电池装置的改造
↑
↑
Cl-
K+
观察实验现象
双液电池的工作原理
CuSO4溶液
Zn
Cu
e-
Zn2+
Cu2+
Cl-
K+
负极:
Zn - 2e- Zn2+
正极:
Cu2+ + 2e- Cu
盐桥中的离子迁移进入两侧电解质溶液,联通了两侧电解质溶液,从而形成闭合回路。
ZnSO4溶液
e-
双液电池
单液电池
请绘制前面双液电池的工作原理示意图。要求包括以下内容:
(1)注明原电池的组成;
(2)标明氧化反应和还原反应发生的区域;
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
任务二
原电池装置的改造
+
-
方案展示
负极
氧化反应
正极
还原反应
电池工作时,装置中各物质或材料的作用是什么?能否用其他物质或材料代替?
思考
各部分的作用
Cu片 电极材料
Zn片 电极反应物 电极材料
CuSO4溶液 电极反应物 离子导体
ZnSO4溶液 离子导体
盐桥 离子导体
导线 电子导体
任务二
原电池装置的改造
原电池的构成要素
还原剂-氧化反应、氧化剂-还原反应
离子导体
电极材料
电极反应
电子导体
反思与总结
内电路,实现离子定向迁移
进行电子转移的场所
外电路,实现电子定向转移
基本要素
原电池 双液电池 单液电池
电极反应 正极:Cu2+ + 2e- Cu 负极:Zn - 2e- Zn2+ 正极:Cu2+ + 2e- Cu
负极:Zn - 2e- Zn2+
电极材料 正极:铜片; 负极:锌片 正极:铜片; 负极:锌片
离子导体 ZnSO4溶液、盐桥、CuSO4溶液 CuSO4 溶液
电子导体 导线 导线
双液原电池解决了电池自损耗的问题。
根据原电池工作原理,将下列氧化还原反应设计成原电池:
2Fe3+ + 2I- 2Fe2+ + I2
评价活动
要求:
(1)分别写出氧化反应和还原反应。
(2)根据原电池构成要素,选择合适的物质或材料,并画出原电池的工作原理示意图。
(1)氧化反应:
2I- - 2e- I2
还原反应:
2Fe3+ + 2e- 2Fe2+
(2)
(2)
(1)氧化反应:
2I- - 2e- I2
还原反应:
2Fe3+ + 2e- 2Fe2+
同学甲
同学乙
方案展示
石墨
石墨
石墨
石墨
实验
现象
KI
溶液
FeCl3
溶液
含KCl溶液
滤纸条
滴加
淀粉液
滴加铁氰
化钾溶液
(2)
同学丙
方案展示
只允许K+或Cl-通过的隔膜
(1)氧化反应:
2I- - 2e- I2
还原反应:
2Fe3+ + 2e- 2Fe2+
自发的氧化还原反应
闭合
回路
原电池
化学能
电能
离子导体
电极材料
电极反应
反思与总结 原电池工作原理
电子导体
还原反应
氧化反应
理想的化学电源的特点:
便于携带
内阻小
质量小
反复使用
单位质量或单位体积输出的能量多
价格便宜
体积小
连续工作
寿命长
如何实现?
……
原电池
第2课时
结构简单
一次电池
反复使用
二次电池
连续工作
燃料电池
新型电池
电池的研发
原电池的构成要素
自发的氧化还原反应
闭合
回路
原电池
化学能
电能
离子导体
电极材料
电极反应
电子导体
还原反应
氧化反应
知识回顾
一、一次电池
一次电池是放电后不可充电的电池。
碱性干电池
银锌电池
认识普通锌锰干电池
任务一
构造示意图
普通锌锰干电池是最早进入市场的实用干电池。因其电解质溶液用淀粉糊固定化,称为干电池。
认识普通锌锰干电池
任务一
结合资料和示意图分析:
电极反应中的还原剂和氧化剂、电极材料、离子导体。
资料
普通锌锰干电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2 Zn(NH3)2Cl2+2MnO(OH)
构造示意图
0
+4
+3
+2
电极反应活性物质 负极:Zn
正极:MnO2
电极材料 负极:Zn
正极:石墨棒
离子导体 NH4Cl和ZnCl2混合物
构造示意图
3.分析普通锌锰干电池长期占据市场和现在逐渐被替代的可能原因。
认识普通锌锰干电池
任务一
Zn
石墨棒
NH4Cl
MnO2
NH4Cl
ZnCl2
A
单液电池
优点:结构简单、价格低廉。
缺点:会发生自放电。
Zn
石墨棒
NH4Cl
MnO2
NH4Cl
ZnCl2
A
单液电池
放置不同时间后的普通锌锰干电池
碱性锌锰干电池
容量高,能大电流连续放电。还具有优良的低温性能、储存性能和防漏性能。
碱性锌锰干电池结构
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
MnO2和
KOH混合物
已知该电池总反应为:
Zn+2MnO2+2H2O 2MnO(OH)+Zn(OH)2
资料
根据示意图和资料:
1.分析各部分的作用,
画出工作原理示意图;
2.写出电极反应式。
认识碱性锌锰干电池
任务二
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
0
+4
+3
+2
MnO2和
KOH混合物
观点展示
金属外壳
离子型
导电隔膜
Zn粉和
KOH混合物
铜针
电极反应 还原剂:Zn粉
氧化剂 :MnO2
电极材料 负极:铜针
正极:金属外壳
离子导体 KOH、离子型导电隔膜
MnO2和
KOH混合物
+
-
正极
金属
外壳
离子型导电隔膜
Zn粉
KOH
混合物
负极
铜针
MnO2
KOH
混合物
e-
+
-
负极:Zn - 2e- + 2OH- Zn(OH)2
正极:2MnO2 + 2e- + 2H2O 2MnO(OH) + 2OH-
正极
金属
外壳
离子型导电隔膜
Zn粉
KOH
混合物
负极
铜针
MnO2
KOH
混合物
e-
+
-
总反应:Zn + 2MnO2 + 2H2O 2MnO(OH) + Zn(OH)2
0
+4
+3
+2
资料
①碱性干电池增大了正负极间的相对面积,用高导电性的氢氧化钾溶液替代了氯化铵、氯化锌溶液,锌也变成粉末状,同时采用了反应活性更高的电解二氧化锰粉;
②电流是单位时间内通过横截面的电量。
4.阅读资料,找出能使碱性锌锰干电池产生大电流和高电压的设计。
认识碱性锌锰干电池
任务二
电极活性物质
Zn粉、高活性电解MnO2
电极材料
增大相对面积
离子导体
高导电性
的KOH溶液
加快反应速率
减小电池内阻
大电流
高电压
改进方式
改进目的
改进效果
化学电源——原电池原理 + 工艺控制
碱性锌锰干电池
普通锌锰干电池
二、二次电池
二次电池又称可充电电池或蓄电池,是一类放电后可以再充电而反复使用的电池。
认识铅蓄电池
任务三
铅酸蓄电池的构造示意图
铅蓄电池优点
电压稳定
使用方便
安全可靠
价格低廉
稀硫酸
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
资料
铅蓄电池放电时的总反应为:
PbSO4难溶于水,
充电过程与上述过程相反。
1.根据铅蓄电池放电过程的总反应写出电极反应式。
认识铅蓄电池
任务三
0
+4
+2
正极:PbO2 + 4H+ + + 2e- PbSO4 + 2H2O
负极:Pb + - 2e- PbSO4
SO4
2-
SO4
2-
认识铅蓄电池
任务三
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
0
+4
+2
总反应:
2.铅蓄电池的电极反应物(Pb、PbO2)和放电后的产物(PbSO4)均以固体形式附着在电极材料表面,分析这样设计的目的。
认识铅蓄电池
任务三
目的:使电极反应物和产物富集在电极材料表面,充、放电时可以循环转化,实现电池重复使用。
Pb
PbSO4
PbO2
PbSO4
放
电
充
电
负极
正极
放
电
充
电
1.利用下面反应,设计能够连续提供电能的原电池。
2H2 + O2 2H2O
实验用品:
H2、O2、稀硫酸、石墨棒、试管、U形管、导管、导线、电流表等。
绘制实验装置图,并思考:
①电池中的电极反应是什么;
②装置是如何实现连续工作的。
设计连续工作的电池
任务四
e-
H2
O2
H2SO4溶液
石墨棒
负极:2H2 - 4e- 4H+
正极:O2 + 4H+ + 4e- 2H2O
由于燃料和氧化剂连续地由外部供给并在电极上进行反应,生成物不断地被排出,因此可以实现连续供电。
石墨棒
设计连续工作的电池
任务三
H2
O2
H2SO2
溶液
2.如何使气体反应物快速、充分的反应?
设计连续工作的电池
任务三
增大接触面积
使用
催化剂
负极:2H2 - 4e- 4H+
正极:O2 + 4H+ + 4e- 2H2O
氢氧燃料电池工作原理示意图
稀
硫
酸
资料
氢氧燃料电池汽车
能连续不断地提供电能
三、燃料电池
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电源。
能量转化率超80%
绿色发电装置
② 电池内部的电极材料和离子导体在工作过程中不发生改变,使燃料电池可以持续工作。
燃料电池的特点
① 燃料和氧化剂连续的由外部供给,生成物不断地被排出,可以连续不断地提供电能。
电池类型 原理 工艺及目的
一次电池 原电池原理 加入隔膜分隔氧化剂与还原剂,减少电池自损耗。
二次电池 原电池及 电解池原理 将相关活性物质富集在电极材料表面,实现物质循环转化。
燃料电池 原电池原理 燃料和氧化剂连续由外部提供,保持电极材料和离子导体稳定,能够实现连续工作。
重视废旧电池的回收利用,减少环境污染,节约资源。
普通干电池
二次电池
……
碱性干电池
有巨大研究潜力的电池
用废纸发电的生物电池
理论上计算
一张A4纸可产生的电力大约相当于6节5号电池的电量!
新型柔性电池:
有巨大研究潜力的电池
原电池
第3课时
盐水小汽车
资料
小汽车电源结构
盐水小汽车电池工作原理分析
1. 如何形成了原电池?请画出原电池工作示意图进行说明。
任务一
e-
+
-
负极
Zn
NaCl
溶液
观点展示
Zn片 还原剂 电极材料
石墨片 电极材料
浸NaCl溶液的滤纸片 离子导体
正极
石墨
负极:
2Zn - 4e- 2Zn2+
正极:
O2 + 4e- + 2H2O 4OH-
e-
+
-
负极
Zn
NaCl
溶液
总反应:
2Zn + O2 + 2H2O 2Zn(OH)2
观点展示
Zn片 还原剂 电极材料
石墨片 电极材料
浸NaCl溶液的滤纸片 离子导体
正极
石墨
Zn还没有完全消耗,小汽车就跑不动了。
使用前的锌片
与滤纸接触的一面
表面有Zn(OH)2覆盖
2.表面的Zn(OH)2是如何产生的?
盐水小汽车电池工作原理分析
任务一
Zn2+ + 2OH- Zn(OH)2
正极生成的OH-向负极迁移
与负极生成的Zn2+反应
Zn2+
O2
OH-
溶液
电极反应
粒子迁移
分析原电池问题的两个重要角度:
Zn2+
O2
OH-
溶液
3.请给生产商一个改造电池的建议,以能够延长
盐水小汽车行驶的时间。
盐水小汽车电池工作原理分析
任务一
方案展示
特殊性质的膜材料
限制OH-通过的
离子导电性隔膜
负极
正极
石墨
Zn
NaCl
溶液
方案展示
新能源汽车
各种新能源汽车电池
电池类型 镍镉电池 镍氢电池 锂离子电池
比能量/ (W·h·kg-1) 55 60~70 120
循环寿命/次 500以上 1000以上 1000以上
优点 比能量较高、寿命长、耐过充放性好 比能量高、寿命长 比能量高、
寿命长
缺点 镉有毒、有记忆效应、价格较高 价格高、高温充电性差 价高、存在一定安全性问题
比能量(比功率):电池单位质量或单位体积所能输出
电能的多少(或功率的大小)
2019年诺贝尔化学奖得主
吉野彰
约翰·古迪纳夫
斯坦利·惠廷厄姆
锂离子电池的发展
锂金属电池
锂离子电池
作为心脏起搏器的电池应该具备什么样的特点。
回顾锂电池的发展
任务二
1960年,瑞典医生奥克·森宁为一位病人植入了心脏起搏器,并将电池埋在皮下。当电池耗尽后需要手术更换电池。
作为心脏起搏器的电池应该具备什么样的特点。
体积小、质量小、高能量——比能量高
回顾锂电池的发展
任务二
作为心脏起搏器的电池应该具备什么样的特点。
体积小、质量小、高能量——比能量高
回顾锂电池的发展
任务二
怎样提高电池的比能量呢?
转移1mol电子时,消耗金属的质量
科学家们将目光聚焦在了Li上
结合锂的化学性质,思考用金属锂作为负极材料时需要注意的问题。
回顾锂电池的发展
任务二
Li:第二周期IA族;
还原性较强;
易与水和氧气发生反应。
电池的电解质溶液不能含水;
电池要严格密封,防止接触空气。
一次锂金属电池
资料
锂金属电池一般使用MnO2为正极反应物、金属锂或其合金为负极材料、使用非水电解质溶液做离子导体。并且用良好的密封材料进行封装。
放电反应:x Li + MnO2 LixMnO2
负极
正极
一次锂电池价格昂贵,不可充电。请思考如何解决这一问题?
回顾锂电池的发展
任务二
二次电池的特点:
电极反应物和产物在充、放电时可以循环转化,实现电池重复使用。
改进方法:
寻找可以实现物质循环转化的材料或方法。
2019诺贝尔化学奖得主
斯坦利·惠廷厄姆在1976年提出了第一个嵌入脱出型的正极材料TiS2,这几乎标志着从早期的Li—MnO2一次电池到现代二次锂电池的转变。
TiS2
Li+
资料
TiS2是一种微观上具有层状结构的固体材料。充、放电时,
Ti元素的化合价发生变化,层状结构所带电荷量发生改变,锂离子会因此从其中脱出或嵌入。
放电总反应:
x Li + TiS2 LixTiS2
结合资料、总反应与示意图,分析:
1.放电时Li+迁移方向
和电极反应;
2.简单说明其能够反复
充电的理由。
Li
固体TiS2
隔膜
含Li+的
电解质溶液
:Li+
:e-
回顾锂电池的发展
任务二
观点
展示
1.放电时Li+移向正极
正极:TiS2 + x Li+ + x e- LixTiS2
负极:x Li – x e- x Li+
x Li + TiS2 LixTiS2
放电
Li
Li+
TiS2
LixTiS2
放
电
充
电
负极
正极
放
电
充
电
2.
观点
展示
1.放电时Li+移向正极
正极:TiS2 + x Li+ + x e- LixTiS2
负极:x Li – x e- x Li+
x Li + TiS2 LixTiS2
放电
如何解决这个问题?
回顾锂电池的发展
任务二
资料
锂电池充电过程中,锂金属表面会逐渐析出尖锐的锂枝晶,有可能穿透正负极之间的隔膜,造成电池内部短路,引发电池自燃,造成爆炸。
锂枝晶
金属Li
如何解决这个问题?
回顾锂电池的发展
任务二
资料
锂电池充电过程中,锂金属表面会逐渐析出尖锐的锂枝晶,有可能穿透正负极之间的隔膜,造成电池内部短路,引发电池自燃,造成爆炸。
锂枝晶
金属Li
增加隔膜的强度
抑制或阻碍
锂枝晶的形成
约翰·古迪纳夫发现了LiCoO2等一系列正极材料,减少了枝晶短路的可能,进而大幅提升锂电池的稳定性 。
2019年诺贝尔化学奖得主
钴酸锂LiCoO2
资料
与TiS2类似, LiCoO2也是层状结构,锂离子能在放电与充电的过程中脱出或嵌入,实现物质循环转化。
负极
Li
正极 固体LiCoO2
隔膜
电解质溶液
:Li+
:e-
负极材料为金属Li,依然属于二次锂电池
放电时的总反应:
x Li + Li1-xCoO2 LiCoO2
2019诺贝尔化学奖得主
吉野彰将碳基材料用作负极,依旧用钴酸锂做正极,并采用聚乙烯或聚丙烯为隔膜,LiClO4的碳酸丙烯酯液为电解质溶液。确立了现代锂离子电池的基本框架。
放电时的总反应:
LixCy + Li1-xCoO2 LiCoO2 + Cy
负极 LixCy
LixCy
充电时,电子被石墨层结构得到, Li+仅迁移嵌入石墨层间,依然以Li+形式存在,故不存在金属Li。
锂离子电池
LixCy + Li1-xCoO2 LiCoO2 + Cy
放电
充电
充电:x Li+ + Cy + x e- LixCy
负极材料
正极材料
碳基材料作负极,
防止生成锂枝晶
钴酸锂作正极,
减少了锂枝晶
嵌入脱出型
材料TiS2
中国科学家研究成果简介
2018年10月,南开大学梁嘉杰、陈永胜教授课题组与江苏师范大学赖超课题组合作,成功制备了具有多级结构的银纳米线—石墨烯三维多孔载体,并负载金属锂作为复合负极材料,其同样可抑制锂枝晶产生,从而可实现电池超高速充电,有望大幅延长锂电池“寿命”。
已知磷酸铁锂电池放电时的总反应为:
放电时下面电极反应发生在A极还是B极?
LixCy–x e- x Li+ + Cy
LixCy + Li1-xFePO4 LiFePO4 + Cy
2.为了安全、有效的回收锂,拆解废旧电池时需要先进行放电处理,其目的是什么?
评价活动
观点一:反应生成Li+,图示显示Li+向左迁移,所以可以判断反应发生在B电极。
观点二:反应是失去电子的负极反应。图示显示阳离子Li+向左(即正极)迁移,由此判断B极为负极,所以反应发生在B电极。
LixCy–x e- x Li+ + Cy
观点展示
答案:
充分放电后,体系的化学能已充分转化为电能,避免了后续处理过程中继续释放能量,造成安全隐患。
同时放电过程中,Li+从负极B极脱出并向正极A极迁移,使Li元素在正极区富集,更利于有效的回收锂。
2.为了安全、有效的回收锂,拆解废旧电池时需要先进行放电处理,这样的目的是什么?
观点展示
谢谢观看!
