第六章 化学反应与能量 阶段重点突破练(三)(含答案)
文档属性
| 名称 | 第六章 化学反应与能量 阶段重点突破练(三)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 210.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-06 22:32:48 | ||
图片预览



文档简介
第六章 化学反应与能量 阶段重点突破练(三)
一、选择题(每小题只有一个选项符合题意)
1.下列说法错误的是( )
A.任何化学反应中都有化学键的变化
B.化学变化中的能量变化主要是由化学键的变化引起的
C.充电电池充电时电能转化为化学能
D.燃料电池是将燃料燃烧释放的热能转化为电能的装置
2.下列有关叙述正确的是( )
A.“中华有为”华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B.根据能量守恒定律,化学反应中反应物的总能量等于生成物的总能量
C.等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫蒸气放出的热量多
D.原电池中的电极一定要由两种不同的金属组成
3.关于化学反应和能量变化,下列判断不正确的是( )
A.Ba(OH)2·8H2O晶体与NH4Cl固体的反应属于吸热反应
B.当盐酸和氢氧化钠反应时,会放出热量
C.化学反应过程实际上就是原子或原子团的重新组合的过程
D.Po→He +Pb,该过程属于化学变化
4.下列图示变化为吸热反应的是( )
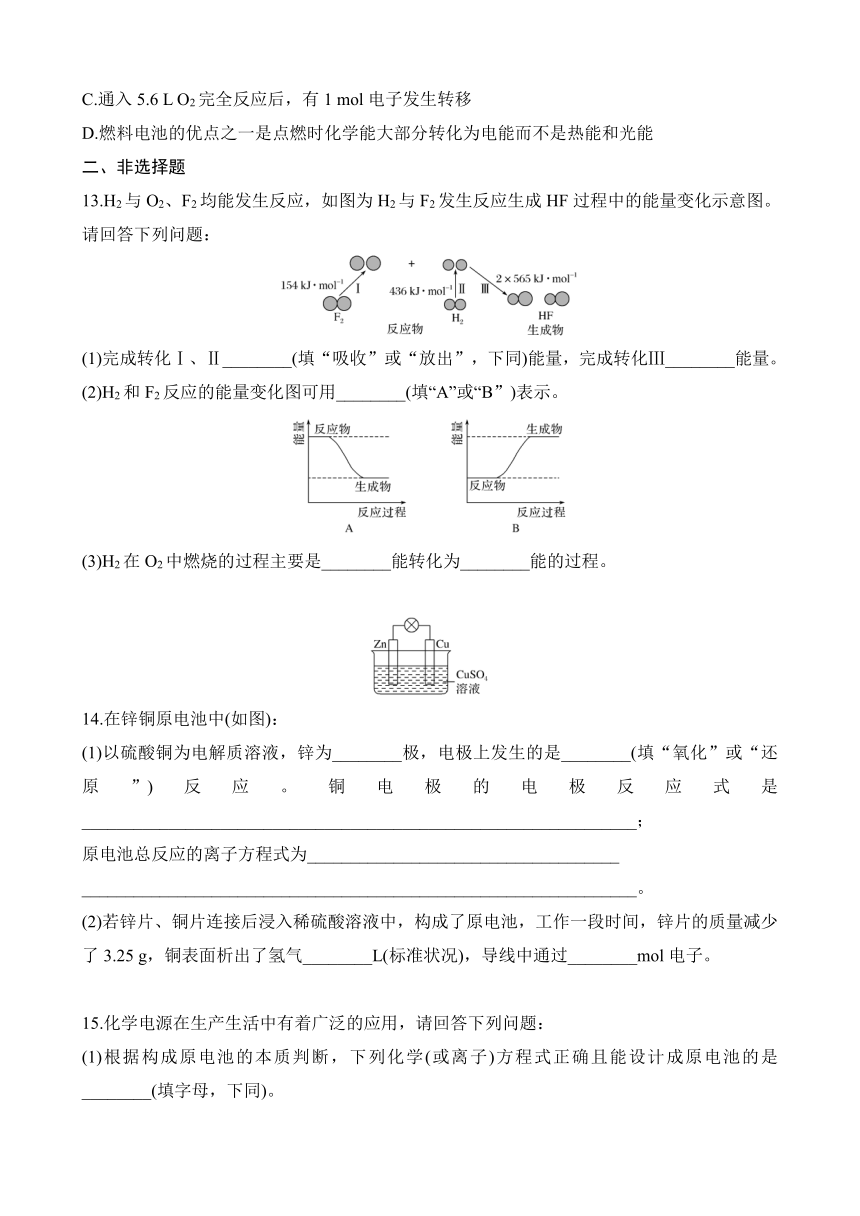
5.环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( )
A.燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.该反应中,热能转化为生成物的内部能量
B.反应物的总能量高于生成物的总能量
C.由实验现象可知反应:NH4HCO3(aq)+HCl(aq)===NH4Cl(aq)+CO2(g)+H2O(l)一定为吸热反应
D.该反应可以设计成原电池装置
7.氢镍电池是可充电电池,它的总反应是:H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是( )
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,H2是负极
8.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O22H2O
A.①② B.②④
C.②③ D.③④
9.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-===Zn2+,2MnO2+2NH+2e-===Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是( )
A.干电池中锌筒为负极,石墨棒为正极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能的转化
10.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过电解质溶液移到碳棒上
B.闭合K,Cu2+移向铁棒
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-===Cu
11.将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )
A.该电池的负极反应为Mg-2e-===Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内电路中,阳离子向负极迁移
D.Al作原电池负极,开始工作时溶液中会立即有白色沉淀析出
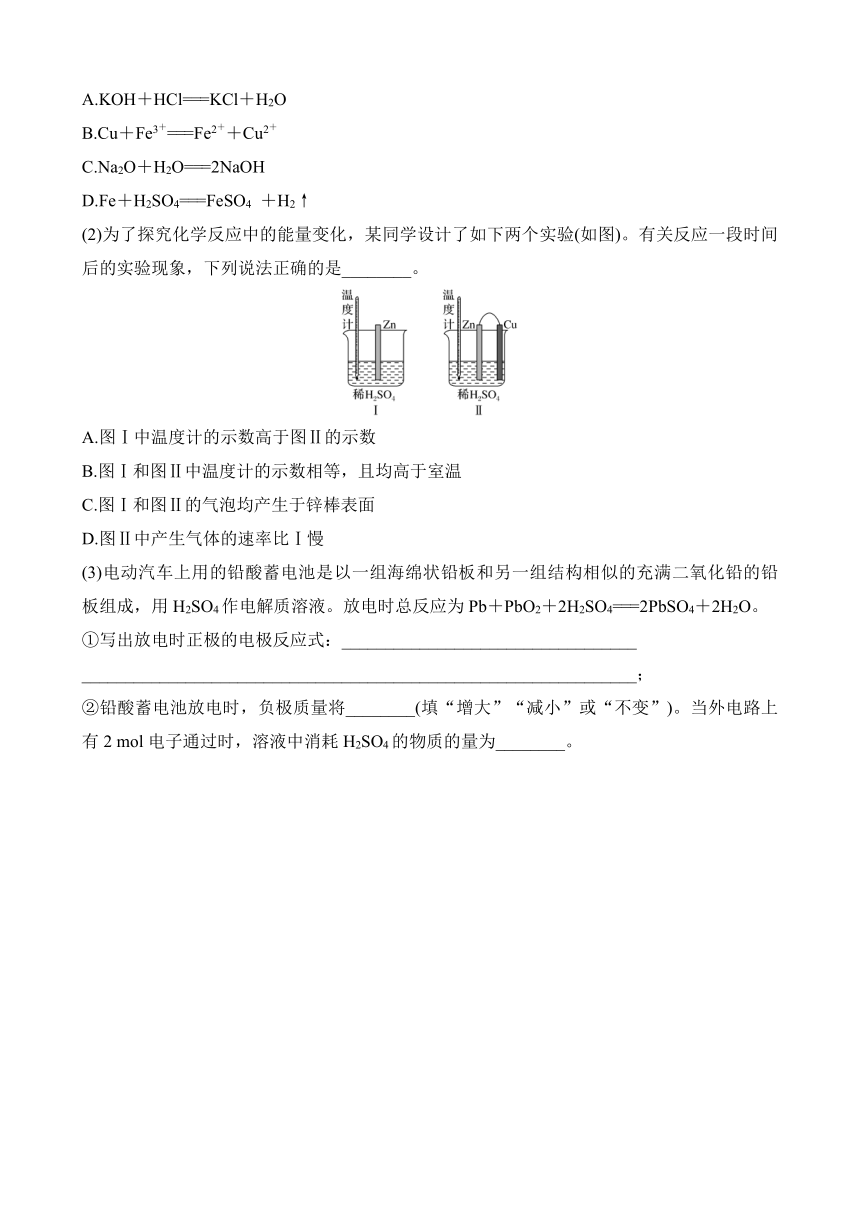
12.燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A.该电池工作时,正极附近溶液的碱性减弱
B.负极反应式:C2H6+18OH--14e-===2CO+12H2O
C.通入5.6 L O2完全反应后,有1 mol电子发生转移
D.燃料电池的优点之一是点燃时化学能大部分转化为电能而不是热能和光能
二、非选择题
13.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ________能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
14.在锌铜原电池中(如图):
(1)以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应。铜电极的电极反应式是________________________________________________________________;
原电池总反应的离子方程式为____________________________________
________________________________________________________________。
(2)若锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况),导线中通过________mol电子。
15.化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________(填字母,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4 +H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是________。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
(3)电动汽车上用的铅酸蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:__________________________________
________________________________________________________________;
②铅酸蓄电池放电时,负极质量将________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
第六章 化学反应与能量 阶段重点突破练(三)
一、选择题(每小题只有一个选项符合题意)
1.下列说法错误的是( )
A.任何化学反应中都有化学键的变化
B.化学变化中的能量变化主要是由化学键的变化引起的
C.充电电池充电时电能转化为化学能
D.燃料电池是将燃料燃烧释放的热能转化为电能的装置
答案 D
解析 A.化学反应的本质是旧化学键的断裂和新化学键的形成,所以任何化学反应中都有化学键的变化,故A正确;B.断裂化学键吸收能量,形成化学键释放能量,所以化学变化中的能量变化主要是由化学键的变化引起的,故B正确;C.充电电池在充电时,消耗电能,产生化学能,所以是电能转化为化学能的过程,故C正确;D.燃料电池并不经过燃烧,是直接将化学能转化为电能的装置,故D错误。
2.下列有关叙述正确的是( )
A.“中华有为”华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B.根据能量守恒定律,化学反应中反应物的总能量等于生成物的总能量
C.等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫蒸气放出的热量多
D.原电池中的电极一定要由两种不同的金属组成
答案 C
解析 华为Mate系列手机采用的超大容量高密度电池是可充电可放电的电池,是二次电池,故A错误;根据能量守恒定律可知,反应物总能量和生成物总能量不等,反应过程中有能量变化,如果正反应为放热反应,则反应物总能量大于生成物总能量,如果正反应为吸热反应,则反应物总能量小于生成物总能量,故B错误;生成物相同,反应物中气态S比固态S能量高,且为放热反应,则硫蒸气反应放出热量多,故C正确;原电池中的电极可能由可导电的非金属和金属组成,如Zn、石墨和稀硫酸构成的原电池,故D错误。
3.关于化学反应和能量变化,下列判断不正确的是( )
A.Ba(OH)2·8H2O晶体与NH4Cl固体的反应属于吸热反应
B.当盐酸和氢氧化钠反应时,会放出热量
C.化学反应过程实际上就是原子或原子团的重新组合的过程
D.Po→He +Pb,该过程属于化学变化
答案 D
解析 A.Ba(OH)2·8H2O晶体,与氯化铵反应时吸热,A正确;B.酸和碱的中和反应为放热反应,B正确;C.化学反应前后原子种类和数目不发生改变,但有新的物质生成,实际上就是原子或原子团重新组合的过程,C正确;D.该反应中元素种类发生改变,不是化学变化,D错误。
4.下列图示变化为吸热反应的是( )
答案 A
解析 A项中生成物的总能量大于反应物的总能量,需吸收能量才能实现;B项则恰好相反;C项中浓硫酸溶于水放出热量,此过程是物理变化,没有发生化学反应;D项是放热反应。
5.环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( )
A.燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
答案 A
解析 丙烷燃烧时部分化学能转化为光能,A项错;燃烧反应都是放热反应,B项对;因为丙烷燃烧为放热反应,所以根据反应的化学方程式可知,C项对;丙烷完全燃烧时产物为CO2与H2O,对环境无污染,D项对。
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.该反应中,热能转化为生成物的内部能量
B.反应物的总能量高于生成物的总能量
C.由实验现象可知反应:NH4HCO3(aq)+HCl(aq)===NH4Cl(aq)+CO2(g)+H2O(l)一定为吸热反应
D.该反应可以设计成原电池装置
答案 A
解析 A.根据现象可知NH4HCO3粉末与盐酸反应吸热,没有向外界释放能量,所以该反应中,吸收外界的热能转化为生成物的内部能量,A正确;B.该反应吸热,所以反应物的总能量低于生成物的总能量,B错误;C.该反应中NH4HCO3为固体,所以NH4HCO3溶液与盐酸反应不一定吸热,C错误;D.该反应不是氧化还原反应,不能设计成原电池,D错误。
7.氢镍电池是可充电电池,它的总反应是:H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是( )
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,H2是负极
答案 D
解析 A.电池放电时,负极反应式为:H2-2e-+2OH-===2H2O,所以负极周围溶液的氢氧根离子减少,溶液的pH值减小,A错误;B.电池放电时,正极反应式为:NiO(OH)+H2O+e-===OH-+Ni(OH)2,镍元素被还原,B错误;C.电池放电时,负极反应式为H2-2e-+2OH-===2H2O,氢元素化合价升高,被氧化,C错误;D.电池放电时,负极反应式为H2-2e-+2OH-===2H2O,H2是负极,D正确。
8.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O22H2O
A.①② B.②④
C.②③ D.③④
答案 D
解析 图中电子由多孔电极b通过导线流向多孔电极a,多孔电极b为负极,多孔电极a为正极,①错误;a极对应的电极反应式为O2+4e-===2O2-,②错误;b极的电极反应式为H2-2e-+O2-===H2O,③正确;根据正负极得失电子数相等,将正负极电极反应式相加,该电池的总反应式为2H2+O22H2O,④正确。
9.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-===Zn2+,2MnO2+2NH+2e-===Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是( )
A.干电池中锌筒为负极,石墨棒为正极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能的转化
答案 C
解析 A.在该电池中,由于Zn失去电子变为Zn2+,MnO2在石墨电极上发生得到电子的还原反应,则锌筒为负极,石墨棒为正极,A正确;B.干电池长时间连续工作后,锌筒不断消耗而腐蚀,锌筒变薄,导致糊状物可能流出而腐蚀用电器,B正确;C.在干电池工作时,电流方向是正电荷移动方向,是由石墨棒经外电路流向锌筒,C错误;D.干电池工作时,发生化学反应,产生了电能,因此可实现化学能向电能的转化,D正确。
10.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过电解质溶液移到碳棒上
B.闭合K,Cu2+移向铁棒
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-===Cu
答案 C
解析 该装置为原电池,铁棒做原电池的负极,铁失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-===Fe2+,碳棒为正极,溶液中铜离子在正极得到电子发生还原反应生成铜,电极反应式为Cu2++2e-===Cu。A.闭合K,电子由铁棒通过导线移到碳棒上,故A错误;B.Cu2+移向碳棒,故B错误;C.闭合K,当电路中有0.3NA个电子通过时,负极上减少的质量为=8.4 g,正极上增加的质量为=9.6 g,则理论上碳棒与铁棒的质量差为(8.4 g+9.6 g)=18 g,故C正确;D.由分析可知,闭合K,铁棒做原电池的负极,铁失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-===Fe2+,故D错误。
11.将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )
A.该电池的负极反应为Mg-2e-===Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内电路中,阳离子向负极迁移
D.Al作原电池负极,开始工作时溶液中会立即有白色沉淀析出
答案 B
解析 A.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,镁不会参加反应,所以在该反应中铝失电子作原电池的负极,电极反应为Al-3e-+4OH-===AlO+2H2O,A错误;B.由于铝片表面的氧化膜(Al2O3)也能与NaOH溶液反应,故其不必处理,B正确;C.原电池中阳离子向正极迁移,阴离子向负极迁移,C错误;D.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于电池开始工作时,生成的铝离子的量较少,NaOH过量,此时不会有Al(OH)3白色沉淀生成,D错误。
12.燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A.该电池工作时,正极附近溶液的碱性减弱
B.负极反应式:C2H6+18OH--14e-===2CO+12H2O
C.通入5.6 L O2完全反应后,有1 mol电子发生转移
D.燃料电池的优点之一是点燃时化学能大部分转化为电能而不是热能和光能
答案 B
解析 A.该电池工作时,正极发生的电极反应为O2+4e-+2H2O===4OH-,c(OH-)增大,正极附近溶液的碱性增强,选项A错误;B.乙烷(C2H6)在负极失电子生成CO,负极反应式为:C2H6+18OH--14e-===2CO+12H2O,选项B正确;C.没有说明标准状况下,无法计算氧气的物质的量,也就无法计算转移电子数,选项C错误;D.燃料电池的突出优点是将化学能直接转变为电能,而不经过热能这一中间环节,能量利用率高,不需要点燃,选项D错误。
二、非选择题
13.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ________能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
答案 (1)吸收 放出 (2)A (3)化学 热
解析 (1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。(2)由图可知,H2和F2生成HF的反应能量变化为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A正确。(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
14.在锌铜原电池中(如图):
(1)以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应。铜电极的电极反应式是________________________________________________________________;
原电池总反应的离子方程式为____________________________________
________________________________________________________________。
(2)若锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况),导线中通过________mol电子。
答案 (1)负 氧化 Cu2++2e-===Cu Cu2++Zn===Cu+Zn2+ (2)1.12 0.1
解析 (1)锌比铜活泼,Zn失去电子生成Zn2+,锌做负极,发生氧化反应,铜电极上发生的是还原反应,电极反应式为Cu2++2e-===Cu,总反应的离子方程式为:Cu2++Zn===Cu+Zn2+;(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-===Zn2+,锌片的质量减少了3.25 g,则物质的量为n=m/M=3.25 g/65 g·mol-1=0.05 mol,铜为正极,电极反应为2H++2e-===H2↑,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05 mol=0.1 mol,则:V(H2)=0.05 mol×22.4 L·mol-1=1.12 L。
15.化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________(填字母,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4 +H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是________。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
(3)电动汽车上用的铅酸蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:__________________________________
________________________________________________________________;
②铅酸蓄电池放电时,负极质量将________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
答案 (1)D (2)A (3)①PbO2+2e-+SO+4H+===PbSO4+2H2O ②增大 2 mol
解析 (1)自发进行的氧化还原反应在理论上可以设计成原电池。KOH+HCl===KCl+H2O是复分解反应,不是氧化还原反应,故A错误;Cu+Fe3+===Fe2++Cu2+中的电荷不守恒,离子方程式不正确,故B错误;Na2O+H2O===2NaOH不是氧化还原反应,故C错误;Fe+H2SO4===FeSO4+H2↑是自发进行的氧化还原反应,可以设计成原电池,故D正确。(2)图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成锌铜原电池。图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,故A正确;由A中分析可知,图Ⅰ和图Ⅱ中温度计的示数不相等,但均高于室温,故B错误;图 Ⅱ 中铜为正极,铜棒的表面有气泡产生,故C错误;利用原电池反应可以使金属与酸的反应速率加快,故图Ⅱ中产生气体的速率比Ⅰ快,故D错误。(3)①依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,正极上PbO2得电子发生还原反应,生成难溶于水的PbSO4,故正极反应式PbO2+2e-+SO+4H+===PbSO4+2H2O可知。②依据放电时总反应Pb+PbO2+2H2SO4===2PbSO4+2H2O可知,负极上Pb失电子发生氧化反应,产生的Pb2+结合SO生成难溶于水的PbSO4,故负极质量将增大;根据总反应,当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为2 mol。
一、选择题(每小题只有一个选项符合题意)
1.下列说法错误的是( )
A.任何化学反应中都有化学键的变化
B.化学变化中的能量变化主要是由化学键的变化引起的
C.充电电池充电时电能转化为化学能
D.燃料电池是将燃料燃烧释放的热能转化为电能的装置
2.下列有关叙述正确的是( )
A.“中华有为”华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B.根据能量守恒定律,化学反应中反应物的总能量等于生成物的总能量
C.等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫蒸气放出的热量多
D.原电池中的电极一定要由两种不同的金属组成
3.关于化学反应和能量变化,下列判断不正确的是( )
A.Ba(OH)2·8H2O晶体与NH4Cl固体的反应属于吸热反应
B.当盐酸和氢氧化钠反应时,会放出热量
C.化学反应过程实际上就是原子或原子团的重新组合的过程
D.Po→He +Pb,该过程属于化学变化
4.下列图示变化为吸热反应的是( )
5.环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( )
A.燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.该反应中,热能转化为生成物的内部能量
B.反应物的总能量高于生成物的总能量
C.由实验现象可知反应:NH4HCO3(aq)+HCl(aq)===NH4Cl(aq)+CO2(g)+H2O(l)一定为吸热反应
D.该反应可以设计成原电池装置
7.氢镍电池是可充电电池,它的总反应是:H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是( )
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,H2是负极
8.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O22H2O
A.①② B.②④
C.②③ D.③④
9.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-===Zn2+,2MnO2+2NH+2e-===Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是( )
A.干电池中锌筒为负极,石墨棒为正极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能的转化
10.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过电解质溶液移到碳棒上
B.闭合K,Cu2+移向铁棒
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-===Cu
11.将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )
A.该电池的负极反应为Mg-2e-===Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内电路中,阳离子向负极迁移
D.Al作原电池负极,开始工作时溶液中会立即有白色沉淀析出
12.燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A.该电池工作时,正极附近溶液的碱性减弱
B.负极反应式:C2H6+18OH--14e-===2CO+12H2O
C.通入5.6 L O2完全反应后,有1 mol电子发生转移
D.燃料电池的优点之一是点燃时化学能大部分转化为电能而不是热能和光能
二、非选择题
13.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ________能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
14.在锌铜原电池中(如图):
(1)以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应。铜电极的电极反应式是________________________________________________________________;
原电池总反应的离子方程式为____________________________________
________________________________________________________________。
(2)若锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况),导线中通过________mol电子。
15.化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________(填字母,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4 +H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是________。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
(3)电动汽车上用的铅酸蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:__________________________________
________________________________________________________________;
②铅酸蓄电池放电时,负极质量将________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
第六章 化学反应与能量 阶段重点突破练(三)
一、选择题(每小题只有一个选项符合题意)
1.下列说法错误的是( )
A.任何化学反应中都有化学键的变化
B.化学变化中的能量变化主要是由化学键的变化引起的
C.充电电池充电时电能转化为化学能
D.燃料电池是将燃料燃烧释放的热能转化为电能的装置
答案 D
解析 A.化学反应的本质是旧化学键的断裂和新化学键的形成,所以任何化学反应中都有化学键的变化,故A正确;B.断裂化学键吸收能量,形成化学键释放能量,所以化学变化中的能量变化主要是由化学键的变化引起的,故B正确;C.充电电池在充电时,消耗电能,产生化学能,所以是电能转化为化学能的过程,故C正确;D.燃料电池并不经过燃烧,是直接将化学能转化为电能的装置,故D错误。
2.下列有关叙述正确的是( )
A.“中华有为”华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B.根据能量守恒定律,化学反应中反应物的总能量等于生成物的总能量
C.等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫蒸气放出的热量多
D.原电池中的电极一定要由两种不同的金属组成
答案 C
解析 华为Mate系列手机采用的超大容量高密度电池是可充电可放电的电池,是二次电池,故A错误;根据能量守恒定律可知,反应物总能量和生成物总能量不等,反应过程中有能量变化,如果正反应为放热反应,则反应物总能量大于生成物总能量,如果正反应为吸热反应,则反应物总能量小于生成物总能量,故B错误;生成物相同,反应物中气态S比固态S能量高,且为放热反应,则硫蒸气反应放出热量多,故C正确;原电池中的电极可能由可导电的非金属和金属组成,如Zn、石墨和稀硫酸构成的原电池,故D错误。
3.关于化学反应和能量变化,下列判断不正确的是( )
A.Ba(OH)2·8H2O晶体与NH4Cl固体的反应属于吸热反应
B.当盐酸和氢氧化钠反应时,会放出热量
C.化学反应过程实际上就是原子或原子团的重新组合的过程
D.Po→He +Pb,该过程属于化学变化
答案 D
解析 A.Ba(OH)2·8H2O晶体,与氯化铵反应时吸热,A正确;B.酸和碱的中和反应为放热反应,B正确;C.化学反应前后原子种类和数目不发生改变,但有新的物质生成,实际上就是原子或原子团重新组合的过程,C正确;D.该反应中元素种类发生改变,不是化学变化,D错误。
4.下列图示变化为吸热反应的是( )
答案 A
解析 A项中生成物的总能量大于反应物的总能量,需吸收能量才能实现;B项则恰好相反;C项中浓硫酸溶于水放出热量,此过程是物理变化,没有发生化学反应;D项是放热反应。
5.环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O23CO2+4H2O。下列说法中不正确的是( )
A.燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
答案 A
解析 丙烷燃烧时部分化学能转化为光能,A项错;燃烧反应都是放热反应,B项对;因为丙烷燃烧为放热反应,所以根据反应的化学方程式可知,C项对;丙烷完全燃烧时产物为CO2与H2O,对环境无污染,D项对。
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列说法正确的是( )
A.该反应中,热能转化为生成物的内部能量
B.反应物的总能量高于生成物的总能量
C.由实验现象可知反应:NH4HCO3(aq)+HCl(aq)===NH4Cl(aq)+CO2(g)+H2O(l)一定为吸热反应
D.该反应可以设计成原电池装置
答案 A
解析 A.根据现象可知NH4HCO3粉末与盐酸反应吸热,没有向外界释放能量,所以该反应中,吸收外界的热能转化为生成物的内部能量,A正确;B.该反应吸热,所以反应物的总能量低于生成物的总能量,B错误;C.该反应中NH4HCO3为固体,所以NH4HCO3溶液与盐酸反应不一定吸热,C错误;D.该反应不是氧化还原反应,不能设计成原电池,D错误。
7.氢镍电池是可充电电池,它的总反应是:H2+NiO(OH)===Ni(OH)2,根据此反应判断,下列说法正确的是( )
A.电池放电时,电池负极周围溶液的碱性不断增大
B.电池放电时,镍元素被氧化
C.电池放电时,氢元素被还原
D.电池放电时,H2是负极
答案 D
解析 A.电池放电时,负极反应式为:H2-2e-+2OH-===2H2O,所以负极周围溶液的氢氧根离子减少,溶液的pH值减小,A错误;B.电池放电时,正极反应式为:NiO(OH)+H2O+e-===OH-+Ni(OH)2,镍元素被还原,B错误;C.电池放电时,负极反应式为H2-2e-+2OH-===2H2O,氢元素化合价升高,被氧化,C错误;D.电池放电时,负极反应式为H2-2e-+2OH-===2H2O,H2是负极,D正确。
8.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-===4OH-
③b极的电极反应式为H2-2e-+O2-===H2O
④该电池的总反应式为2H2+O22H2O
A.①② B.②④
C.②③ D.③④
答案 D
解析 图中电子由多孔电极b通过导线流向多孔电极a,多孔电极b为负极,多孔电极a为正极,①错误;a极对应的电极反应式为O2+4e-===2O2-,②错误;b极的电极反应式为H2-2e-+O2-===H2O,③正确;根据正负极得失电子数相等,将正负极电极反应式相加,该电池的总反应式为2H2+O22H2O,④正确。
9.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-===Zn2+,2MnO2+2NH+2e-===Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,不正确的是( )
A.干电池中锌筒为负极,石墨棒为正极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能的转化
答案 C
解析 A.在该电池中,由于Zn失去电子变为Zn2+,MnO2在石墨电极上发生得到电子的还原反应,则锌筒为负极,石墨棒为正极,A正确;B.干电池长时间连续工作后,锌筒不断消耗而腐蚀,锌筒变薄,导致糊状物可能流出而腐蚀用电器,B正确;C.在干电池工作时,电流方向是正电荷移动方向,是由石墨棒经外电路流向锌筒,C错误;D.干电池工作时,发生化学反应,产生了电能,因此可实现化学能向电能的转化,D正确。
10.由U形管、质量为m g的铁棒、质量为m g的碳棒和1 L 0.2 mol·L-1 CuCl2溶液组成的装置如图所示,下列说法正确的是( )
A.闭合K,电子通过电解质溶液移到碳棒上
B.闭合K,Cu2+移向铁棒
C.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18 g
D.闭合K,铁棒表面发生的电极反应为Cu2++2e-===Cu
答案 C
解析 该装置为原电池,铁棒做原电池的负极,铁失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-===Fe2+,碳棒为正极,溶液中铜离子在正极得到电子发生还原反应生成铜,电极反应式为Cu2++2e-===Cu。A.闭合K,电子由铁棒通过导线移到碳棒上,故A错误;B.Cu2+移向碳棒,故B错误;C.闭合K,当电路中有0.3NA个电子通过时,负极上减少的质量为=8.4 g,正极上增加的质量为=9.6 g,则理论上碳棒与铁棒的质量差为(8.4 g+9.6 g)=18 g,故C正确;D.由分析可知,闭合K,铁棒做原电池的负极,铁失去电子发生氧化反应生成亚铁离子,电极反应式为Fe-2e-===Fe2+,故D错误。
11.将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )
A.该电池的负极反应为Mg-2e-===Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内电路中,阳离子向负极迁移
D.Al作原电池负极,开始工作时溶液中会立即有白色沉淀析出
答案 B
解析 A.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,镁不会参加反应,所以在该反应中铝失电子作原电池的负极,电极反应为Al-3e-+4OH-===AlO+2H2O,A错误;B.由于铝片表面的氧化膜(Al2O3)也能与NaOH溶液反应,故其不必处理,B正确;C.原电池中阳离子向正极迁移,阴离子向负极迁移,C错误;D.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于电池开始工作时,生成的铝离子的量较少,NaOH过量,此时不会有Al(OH)3白色沉淀生成,D错误。
12.燃料电池是燃料(如CO、H2、CH4、C2H6等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于乙烷(C2H6)燃料电池的说法正确的是( )
A.该电池工作时,正极附近溶液的碱性减弱
B.负极反应式:C2H6+18OH--14e-===2CO+12H2O
C.通入5.6 L O2完全反应后,有1 mol电子发生转移
D.燃料电池的优点之一是点燃时化学能大部分转化为电能而不是热能和光能
答案 B
解析 A.该电池工作时,正极发生的电极反应为O2+4e-+2H2O===4OH-,c(OH-)增大,正极附近溶液的碱性增强,选项A错误;B.乙烷(C2H6)在负极失电子生成CO,负极反应式为:C2H6+18OH--14e-===2CO+12H2O,选项B正确;C.没有说明标准状况下,无法计算氧气的物质的量,也就无法计算转移电子数,选项C错误;D.燃料电池的突出优点是将化学能直接转变为电能,而不经过热能这一中间环节,能量利用率高,不需要点燃,选项D错误。
二、非选择题
13.H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ________能量。
(2)H2和F2反应的能量变化图可用________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是________能转化为________能的过程。
答案 (1)吸收 放出 (2)A (3)化学 热
解析 (1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。(2)由图可知,H2和F2生成HF的反应能量变化为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A正确。(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
14.在锌铜原电池中(如图):
(1)以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应。铜电极的电极反应式是________________________________________________________________;
原电池总反应的离子方程式为____________________________________
________________________________________________________________。
(2)若锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况),导线中通过________mol电子。
答案 (1)负 氧化 Cu2++2e-===Cu Cu2++Zn===Cu+Zn2+ (2)1.12 0.1
解析 (1)锌比铜活泼,Zn失去电子生成Zn2+,锌做负极,发生氧化反应,铜电极上发生的是还原反应,电极反应式为Cu2++2e-===Cu,总反应的离子方程式为:Cu2++Zn===Cu+Zn2+;(2)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-===Zn2+,锌片的质量减少了3.25 g,则物质的量为n=m/M=3.25 g/65 g·mol-1=0.05 mol,铜为正极,电极反应为2H++2e-===H2↑,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05 mol=0.1 mol,则:V(H2)=0.05 mol×22.4 L·mol-1=1.12 L。
15.化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是________(填字母,下同)。
A.KOH+HCl===KCl+H2O
B.Cu+Fe3+===Fe2++Cu2+
C.Na2O+H2O===2NaOH
D.Fe+H2SO4===FeSO4 +H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是________。
A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速率比Ⅰ慢
(3)电动汽车上用的铅酸蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
①写出放电时正极的电极反应式:__________________________________
________________________________________________________________;
②铅酸蓄电池放电时,负极质量将________(填“增大”“减小”或“不变”)。当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为________。
答案 (1)D (2)A (3)①PbO2+2e-+SO+4H+===PbSO4+2H2O ②增大 2 mol
解析 (1)自发进行的氧化还原反应在理论上可以设计成原电池。KOH+HCl===KCl+H2O是复分解反应,不是氧化还原反应,故A错误;Cu+Fe3+===Fe2++Cu2+中的电荷不守恒,离子方程式不正确,故B错误;Na2O+H2O===2NaOH不是氧化还原反应,故C错误;Fe+H2SO4===FeSO4+H2↑是自发进行的氧化还原反应,可以设计成原电池,故D正确。(2)图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成锌铜原电池。图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图Ⅰ中温度计的示数高于图Ⅱ的示数,故A正确;由A中分析可知,图Ⅰ和图Ⅱ中温度计的示数不相等,但均高于室温,故B错误;图 Ⅱ 中铜为正极,铜棒的表面有气泡产生,故C错误;利用原电池反应可以使金属与酸的反应速率加快,故图Ⅱ中产生气体的速率比Ⅰ快,故D错误。(3)①依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,正极上PbO2得电子发生还原反应,生成难溶于水的PbSO4,故正极反应式PbO2+2e-+SO+4H+===PbSO4+2H2O可知。②依据放电时总反应Pb+PbO2+2H2SO4===2PbSO4+2H2O可知,负极上Pb失电子发生氧化反应,产生的Pb2+结合SO生成难溶于水的PbSO4,故负极质量将增大;根据总反应,当外电路上有2 mol电子通过时,溶液中消耗H2SO4的物质的量为2 mol。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
