化学人教版(2019)选择性必修2 2.3.1 共价键的极性(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.1 共价键的极性(共36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 32.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-07 08:30:42 | ||
图片预览





文档简介
(共36张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
学习目标
1.掌握共价键可分为极性共价键和非极性共价键。
2.区分极性分子和非极性分子,了解分子极性与分子中键的极性及分子空间结构密切相关;能根据分子结构的特点和键的极性判断分子的极性,并据此对分子的一些典性质及其应用作出解释。
2.3.1 共价键的极性
教材内容:P52-55
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂······
臭氧分子的空间结构与水分子的相似,其分子有极性,但很微弱,仅是水分子的极性的28%。臭氧分子中的共价键是极性键,其中心氧原子是呈正电性的,而端位的两个氧原子是呈负电性的。由于臭氧的极性微弱,它在四氯化碳里的溶解度高于在水中的溶解度。
教材:P53资料卡片
为什么臭氧是极性分子?
1.了解臭氧的作用
2.了解臭氧的空间结构
臭氧是极性分子
【情境导入】
极性分子和非极性分子实验
新课引入
共价键的类型
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如N≡N键
(2)按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
(3)按原子轨道的重叠方式
σ键
π键
σ键可以独立存在,
π键不能单独存在
知识回顾
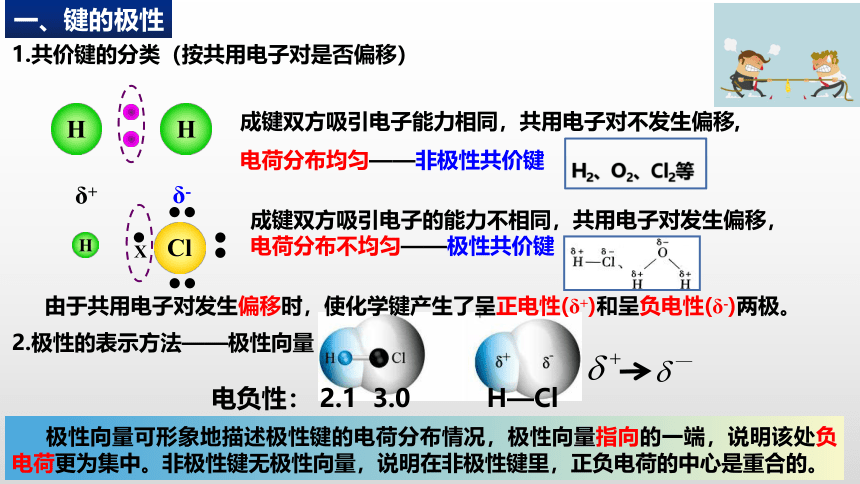
成键双方吸引电子能力相同,共用电子对不发生偏移,
电荷分布均匀——非极性共价键
成键双方吸引电子的能力不相同,共用电子对发生偏移,
电荷分布不均匀——极性共价键
H
H
H
Cl
X
δ+
δ-
由于共用电子对发生偏移时,使化学键产生了呈正电性(δ+)和呈负电性(δ-)两极。
1.共价键的分类(按共用电子对是否偏移)
2.极性的表示方法——极性向量
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
电负性: 2.1 3.0
H—Cl
H2、O2、Cl2等
一、键的极性
4.键的极性的判断方法
(1)根据组成元素
(2)根据共用电子对是否偏移
(3)根据元素的电负性
同种元素:A—A型为非极性键(特例O3)
不同种元素:A-B型为极性键
共用电子对有偏移为极性键
共用电子对无偏移为非极性健
成键原子电负性相同,为非极性键(特例O3)
成键原子电负性不同,为极性键
3.极性的影响因素
(1)电负性差值越大的两原子形成的共价键的极性越强
(2)共用电子对偏移程度越大,键的极性越强
共价键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
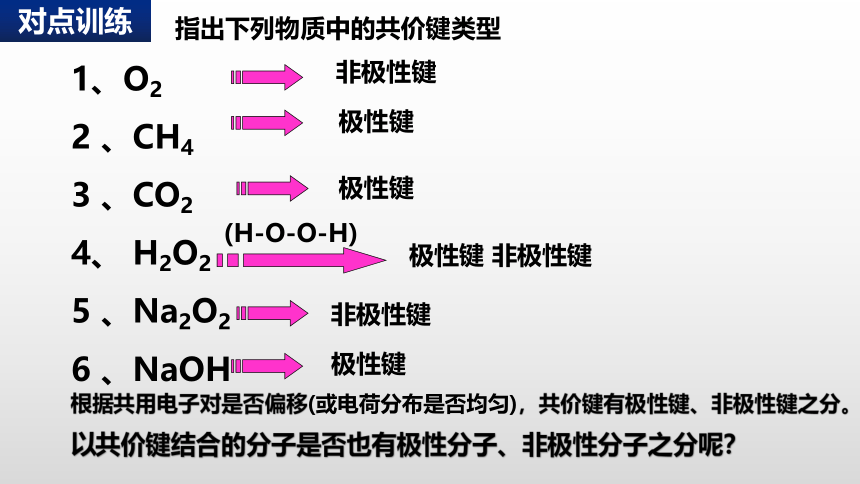
指出下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
对点训练
根据共用电子对是否偏移(或电荷分布是否均匀),共价键有极性键、非极性键之分。
以共价键结合的分子是否也有极性分子、非极性分子之分呢?
H2O
δ-
δ+
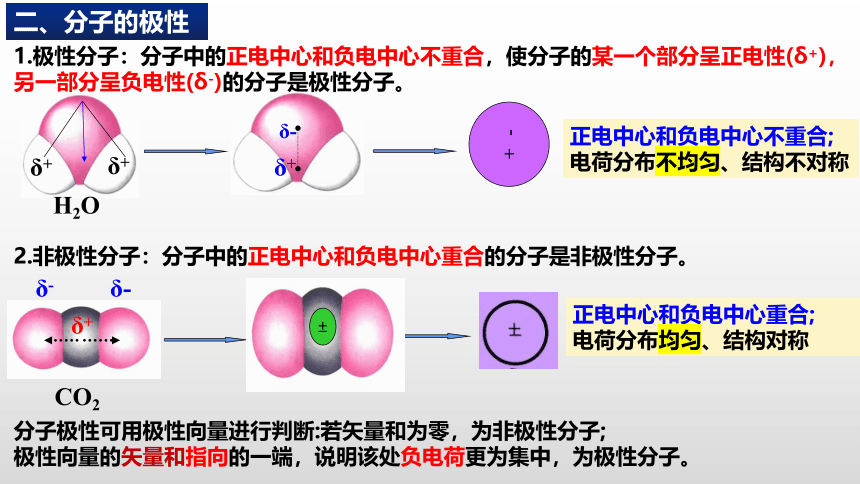
1.极性分子:分子中的正电中心和负电中心不重合,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-)的分子是极性分子。
2.非极性分子:分子中的正电中心和负电中心重合的分子是非极性分子。
δ+
δ+
+ -
正电中心和负电中心不重合;
电荷分布不均匀、结构不对称
δ+
δ-
δ-
CO2
±
正电中心和负电中心重合;
电荷分布均匀、结构对称
分子极性可用极性向量进行判断:若矢量和为零,为非极性分子;
极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。
二、分子的极性
(1)单原子分子
稀有气体——非极性分子(不含共价键)
(2)双原子分子
化合物——极性分子
单 质——非极性分子(O3除外)
取决于原子间的共价键是否有极性
H
Cl
H
Cl
δ+
δ-
Cl
Cl
Cl
Cl
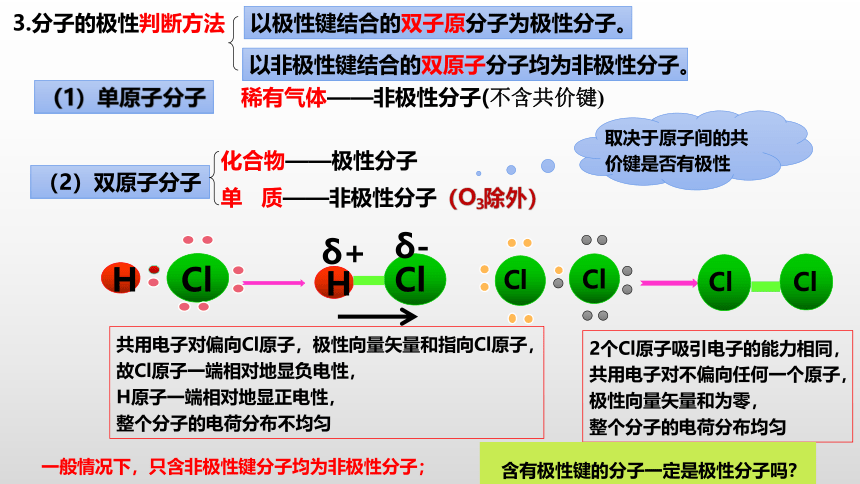
3.分子的极性判断方法
共用电子对偏向Cl原子,极性向量矢量和指向Cl原子,
故Cl原子一端相对地显负电性,
H原子一端相对地显正电性,
整个分子的电荷分布不均匀
以极性键结合的双子原分子为极性分子。
以非极性键结合的双原子分子均为非极性分子。
2个Cl原子吸引电子的能力相同,共用电子对不偏向任何一个原子,
极性向量矢量和为零,
整个分子的电荷分布均匀
含有极性键的分子一定是极性分子吗?
一般情况下,只含非极性键分子均为非极性分子;
三原子分子:CO2
δ+
δ-
δ-
δ-
F1
F2
F合=0
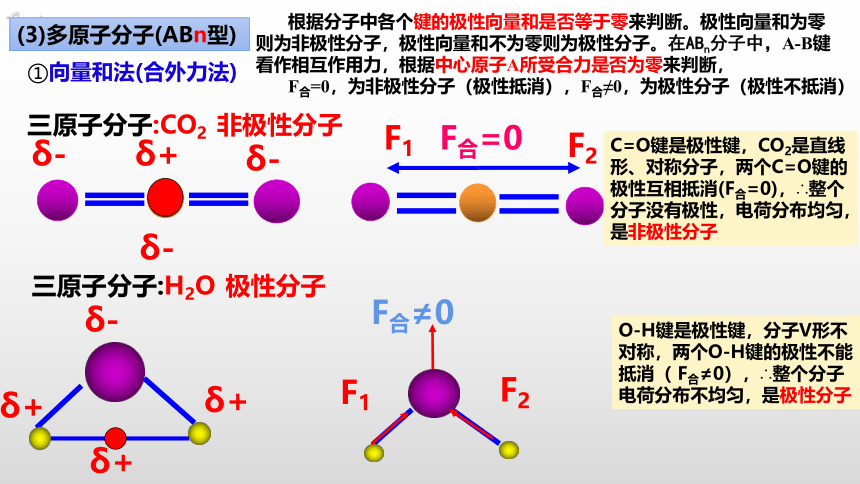
(3)多原子分子(ABn型)
C=O键是极性键,CO2是直线形、对称分子,两个C=O键的极性互相抵消(F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
①向量和法(合外力法)
根据分子中各个键的极性向量和是否等于零来判断。极性向量和为零则为非极性分子,极性向量和不为零则为极性分子。在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断,
F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)
三原子分子:H2O
O-H键是极性键,分子V形不对称,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
δ-
δ+
δ+
δ+
F1
F合≠0
F2
非极性分子
极性分子
δ+
δ-
δ+
δ+
δ+
F合≠0
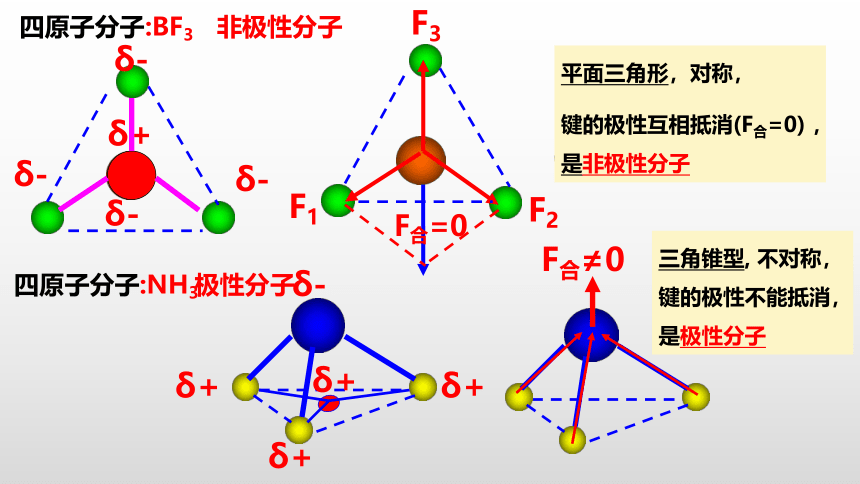
三角锥型, 不对称,键的极性不能抵消,是极性分子
四原子分子:BF3
δ+
δ-
δ-
δ-
δ-
F1
F2
F3
F合=0
平面三角形,对称,
键的极性互相抵消(F合=0) ,是非极性分子
非极性分子
四原子分子:NH3
极性分子
非极性分子
δ+
δ-
δ+
δ+
δ+
δ+
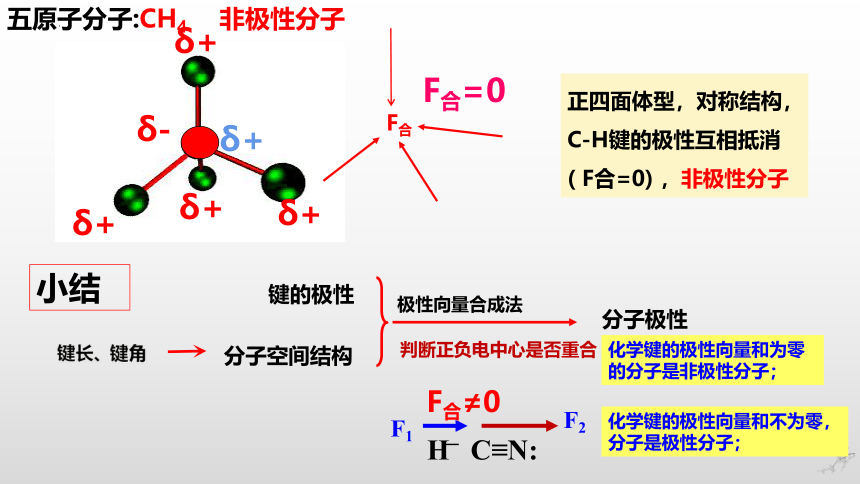
五原子分子:CH4
F合
分子极性
分子空间结构
键的极性
小结
F合=0
极性向量合成法
判断正负电中心是否重合
化学键的极性向量和为零的分子是非极性分子;
F2
F1
F合≠0
H C≡N:
键长、键角
化学键的极性向量和不为零,分子是极性分子;
正四面体型,对称结构,C-H键的极性互相抵消( F合=0) ,非极性分子
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价层电子数
分子极性
非极性
非极性
非极性
非极性
极性
极性
极性
3
3
4
4
5
5
6
6
6
6
3
4
2
5
中心原子A的化合价的绝对值
≠价电子数
极性分子
=价电子数(主族序数)
非极性分子
(3)多原子分子(ABn型)
②中心原子化合价法
③空间结构对称法:
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性分子
极性分子
极性分子
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
平面正三角形
三角锥
非极性分子
极性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性分子
CH4、CCl4
直线形
非极性分子
极性分子
O2、H2
HF、CO
σ键电子对数
价层电子对数
VSEPR模型
孤电子对数
空间结构
非中心对称
中心对称
非极性分子
极性分子
经验规律:若中心原子有孤对电子,则为极性分子;若无孤对电子,则为非极性分子。
HCN,CHnX4-n等中心原子孤电子对数为0但属于极性分子(类别与上表不同,上述方法不适用)。
图2-18 常见的极性分子和非极性分子
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)上述九种物质中含非极性共价键的物质有哪些
(3)图2-18九种物质中,哪些是非极性分子?哪些是极性分子?
HCl是极性分子,
H2 、O2、 Cl2 是非极性分子
教材:P52
P4中的P—P为非极性共价键,
C60中的C—C为非极性共价键
P4、C60、CO2、BF3、CH4为非极性分子
HCN、H2O、NH3、CH3Cl为极性分子
思考与讨论
H2O2分子结构呈 形,分子中正电中心和负电中心 重合,是由 键 和 键 构成的为 性分子。
O3中的化学键为 。O均采用 杂化,分子结构呈 形,分子中正电中心和负电中心 重合,为 分子。
极性键
极性
极性
“半开书页”
V
不
δ+
δ-
δ-
sp2
不
注意:由同种元素组成的非金属单质分子不一定是非性分子。
非极性
极性
思考与讨论
电子云密度大
电子云密度小
水分子的表面静电势图
颜色表示静电势的数值:
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
结论:
水分子存在带正电荷的正极和带负电荷的负极。四氯化碳分子中无正极和负极之分。
情景再现
现象:水流发生偏转,四氯化碳液流无变化
1.用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示。下列说法正确的是( )
A.可能A是CH3COOH , B是H2O
B.可能A是苯, B是H2O
C.可能A、B分别为苯、CCl4
D.可能A、B分别为CCl4、CHCl3
BD
对点训练
(1)极性分子中不可能含有非极性键。 ( )
(2)离子化合物中不可能含有非极性键。 ( )
(3)非极性分子中不可能含有极性键。( )
(4)极性分子中一定含有极性键。( )
(5)H2O、CO2、CH4都是非极性分子。( )
(6)以极性键结合起来的分子一定是极性分子。( )
(7)以非极性键结合起来的双原子分子一定是非极性分子。( )
(8)非极性分子只能是双原子单质分子。( )
(9)非极性分子中一定含有非极性共价键。( )
(10)同种元素之间的共价键一定是非极性键。( )
(11)H2O2是由极性键和非极性键构成的极性分子。( )
×
×
√
×
×
×
√
对点训练
2.正误判断:
×
×
×
√
3.在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是____。
(2)以极性键相结合,具有直线形结构的非极性分子是_____。
(3)以极性键相结合,具有三角锥形结构的极性分子是_____。
(4)以极性键相结合,具有正四面体结构的非极性分子是_____。
(5)以极性键相结合,具有V形结构的极性分子是_____。
(6)以极性键相结合,而且分子极性最大的是____。
N2
CS2
NH3
CH4
H2O
HF
对点训练
1.只含非极性键的双原子分子或多原子分子一定是非极性分子(O3是极性键的极性分子) 如:O2、H2、P4、C60、S8
2.由极性键形成的双原子分子都是极性分子。如:HCl、HF、HBr
3.含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子, 否则为极性分子。
4.极性分子中一定有极性键,非极性分子中不一定含有非极性键。
例如CH4是非极性分子,只含有极性键。
含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
5.判断ABn型分子极性的经验规律:
①若中心原子A的化合价的绝对值等于该元素的价电子数(主族序数/原子最外层电子数),则为非极性分子;若不等,则为极性分子。
②中心原子A没有孤对电子(直线形,平面正三角形,正四面体形),则为非极性分子,若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
分子不带电(不管是极性分子还是非极性分子)
分子的极性的判断
以极性键结合的多原子分子,判断分子的极性,一定要结合分子的立体构型来看。
方法:对于ABn型分子,
当其空间构型是高度对称的结构时,分子的正负电荷中心能够重合,故为非极性分子(如CO2、BF3、CH4等等);
当分子的空间构型不是高度对称结构,例如只有对称轴而无对称中心时,为极性分子(如H2O、SO2、NH3等等)。
小结
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
正四面体:CH4、CCl4、SiF4
空间对称
小结
补充:乙烯、苯(均为平面形)、异戊烷
都是含有极性键的非极性分子;
甲醛是极性分子。
键的极性对化学性质的影响
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
有机羧基的酸性大小与分子组成和结构的关系:
1.只含烃基的一元羧酸的酸性
2.含卤素原子的一元羧酸的酸性
①含不同数目的同种卤素原子的羧酸的酸性
②含相同个数的不同卤素原子的羧酸的酸性
共价键的极性还与相邻基团有关
硝基使O—H共用电子对靠近硝基,我们把像硝基这样的基团称为吸电子基团。
甲基使O—H共用电子对远离甲基,我们把像甲基这样的基团称为推(给)电子基团。
对于有机羧酸,R的吸电子能力越强,
O—H极性增强,更容易电离,酸性增强!
R的推电子能力越强,O—H极性减弱,
更不容易电离,酸性减弱!
三、分子键的极性对化学性质的影响
NO2 > CN > F > Cl > Br > I > C C > OCH3 > OH > C6H5 > C=C > H
常见的吸电子基团:
常见的推电子基团
(CH3)3C > (CH3)2C > CH3CH2 > CH3 > H
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
烃基(符号R—)是推电子基团,使O—H键极性变小,烃基越长推电子效应越大,使羧基中的羟基的极性越小,O—H越难断开,羧酸的酸性越弱。
所以酸性:甲酸>乙酸>丙酸
随着烃基加长,酸性的差异越来越小
1.只含烃基的一元羧酸的酸性
说明:pKa=-lgKa,可用pKa的大小来衡量酸性强弱,
pKa越小,酸性越强。
H
O
H
δ+
δ-
O
C
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
比较氯乙酸和三氯乙酸的酸性
强弱,并解释其原因。
由于电负性:Cl(3.0)>H(2.1) ,极性:Cl—C>H—C,通过传导作用使Cl3C—极性 > Cl2CH— > ClCH2— ,三氯乙酸中的羧基的极性最大,更易电离出氢离子
2.含卤素原子的一元羧酸的酸性
①含不同数目的同种卤素原子的羧酸的酸性
CH2
O
H
δ+
δ-
O
C
Cl
CH
O
H
δ+
δ-
O
C
Cl
Cl
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
比较三氟乙酸和三氯乙酸的
酸性强弱,并解释其原因。
2.含卤素原子的一元羧酸的酸性
②含相同个数的不同卤素原子的羧酸的酸性
电负性:F (4.0)>Cl(3.0) ,极性:F—C>Cl—C,使F3C—的极性> Cl3C—的极性,通过传导作用导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+。所以三氟乙酸的酸性大于三氯乙酸
F—C—C—O—H
F
F
O
δ-
δ-
δ-
Cl—C—C—O—H
Cl
Cl
O
>
δ-
δ-
δ-
有机羧基的酸性大小与分子组成和结构的关系
1.只含烃基的一元羧酸的酸性:烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减弱。
随着烃基加长,推电子效应越大,羧酸的酸性越弱。
补充:只含烃基的多元羧酸的酸性
烃基所含碳原子数越少,羧基个数越多,酸性越强。
2.含卤素原子的一元羧酸的酸性:与羧基相邻的共价键的极性越大,通过传导作用使羧基中羟基的极性越大,则羧酸的酸性越强。
①含不同数目的同种卤素原子,卤素原子的数目越多,羧酸的酸性越强。
②含相同个数的不同卤素原子,卤素原子的电负性数值越大,酸性越强。
归纳小结
(HO)mROn,如果成酸元素R相同,则n值越大, R的正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
两种常见含氧酸的结构式:
如:酸性H2SO3②当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
①无机含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
拓展延伸
无机含氧酸酸性强弱的经验规律(O-H极性角度分析)
(2) (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,酸性越强。
n=0,弱酸,如硼酸(H3BO3)
n=1,中强酸,如亚硫酸(H2SO3)
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)
n=3,极强酸,如高氯酸(HClO4)
特例:碳酸n=1,酸性应该和亚硝酸、亚硫酸、磷酸相近是中强酸,实际是弱酸,主要是因为溶于水的二氧化碳分子只有约几百分之一与水结合成碳酸。与按全部转化估算的酸的强度相比小了近百倍
S
O
O
OH
HO
H2SO4
S
O
OH
HO
H2SO3
HClO4
Cl
O
O
O
HO
HClO3
Cl
O
O
HO
HClO2
Cl
O
HO
HClO
Cl
HO
H3PO4
P
OH
O
OH
HO
HNO2
HNO3
N
O
HO
N
O
HO
O
无机含氧酸的结构
(HO)Cl
(HO)ClO
(HO)ClO2
(HO)ClO3
(HO)NO
(HO)NO2
(HO)2SO2
(HO)2SO
(HO)3PO
通式:(HO)mROn
拓展延伸
已知:硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸
(1)写出这两种酸的结构式:________、________。
(2)写出亚磷酸和过量的NaOH溶液反应的化学方程式:
H-O-B-O-H
O
H
H-O-P-O-H
H
O
2NaOH + H3PO3 ═ Na2PO3 + 2H2O
对点训练
1.下列物质中,酸性最强的是( )
A.HCOOH B.HOCOOH C.CH3COOH D.C6H13COOH
2.试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
A
①>②>③>④>⑤>⑥
对点训练
3.已知含氧酸可用通式(HO) mXOn来表示。一般而言,该式中n大的是强酸,n小的是弱酸。下列各含氧酸中酸性最强的是( )
A.HClO4 B.H2SeO3 C.H3BO3 D.H3PO4
4.判断下列含氧酸中成酸元素的化合价并比较酸性
H2SO3 H2SO4 、HNO2 HNO3 、 HClO HClO4
<
<
<
A
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
②什么是单分子膜?双分子膜?举例说明。
③为什么双分子膜以头向外而尾向内的方向排列?
表面活性剂分散在水表面形成一层疏水基团朝空气的单分子层。细胞和细胞膜是双分子膜,由大量两性分子组装而成。
由于细胞膜两侧都是水溶液,水是极性分子,而构成膜两性分子的头基是极性基团而尾基是非极性基团 。
①简要回答表面活性剂的去污原理
科学 技术 社会—表面活性剂和细胞膜
教材:P53
科学 技术 社会—分子结构修饰与分子的性质
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
布诺芬的成酯修饰
甜度增加600倍,热量值极低,可供糖尿病患者食用
提高药物疗效、降低对胃、肠道的刺激性
教材:P55
第二章 分子结构与性质
第三节 分子结构与物质的性质
学习目标
1.掌握共价键可分为极性共价键和非极性共价键。
2.区分极性分子和非极性分子,了解分子极性与分子中键的极性及分子空间结构密切相关;能根据分子结构的特点和键的极性判断分子的极性,并据此对分子的一些典性质及其应用作出解释。
2.3.1 共价键的极性
教材内容:P52-55
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂······
臭氧分子的空间结构与水分子的相似,其分子有极性,但很微弱,仅是水分子的极性的28%。臭氧分子中的共价键是极性键,其中心氧原子是呈正电性的,而端位的两个氧原子是呈负电性的。由于臭氧的极性微弱,它在四氯化碳里的溶解度高于在水中的溶解度。
教材:P53资料卡片
为什么臭氧是极性分子?
1.了解臭氧的作用
2.了解臭氧的空间结构
臭氧是极性分子
【情境导入】
极性分子和非极性分子实验
新课引入
共价键的类型
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如N≡N键
(2)按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
(3)按原子轨道的重叠方式
σ键
π键
σ键可以独立存在,
π键不能单独存在
知识回顾
成键双方吸引电子能力相同,共用电子对不发生偏移,
电荷分布均匀——非极性共价键
成键双方吸引电子的能力不相同,共用电子对发生偏移,
电荷分布不均匀——极性共价键
H
H
H
Cl
X
δ+
δ-
由于共用电子对发生偏移时,使化学键产生了呈正电性(δ+)和呈负电性(δ-)两极。
1.共价键的分类(按共用电子对是否偏移)
2.极性的表示方法——极性向量
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
电负性: 2.1 3.0
H—Cl
H2、O2、Cl2等
一、键的极性
4.键的极性的判断方法
(1)根据组成元素
(2)根据共用电子对是否偏移
(3)根据元素的电负性
同种元素:A—A型为非极性键(特例O3)
不同种元素:A-B型为极性键
共用电子对有偏移为极性键
共用电子对无偏移为非极性健
成键原子电负性相同,为非极性键(特例O3)
成键原子电负性不同,为极性键
3.极性的影响因素
(1)电负性差值越大的两原子形成的共价键的极性越强
(2)共用电子对偏移程度越大,键的极性越强
共价键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
指出下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
对点训练
根据共用电子对是否偏移(或电荷分布是否均匀),共价键有极性键、非极性键之分。
以共价键结合的分子是否也有极性分子、非极性分子之分呢?
H2O
δ-
δ+
1.极性分子:分子中的正电中心和负电中心不重合,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-)的分子是极性分子。
2.非极性分子:分子中的正电中心和负电中心重合的分子是非极性分子。
δ+
δ+
+ -
正电中心和负电中心不重合;
电荷分布不均匀、结构不对称
δ+
δ-
δ-
CO2
±
正电中心和负电中心重合;
电荷分布均匀、结构对称
分子极性可用极性向量进行判断:若矢量和为零,为非极性分子;
极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。
二、分子的极性
(1)单原子分子
稀有气体——非极性分子(不含共价键)
(2)双原子分子
化合物——极性分子
单 质——非极性分子(O3除外)
取决于原子间的共价键是否有极性
H
Cl
H
Cl
δ+
δ-
Cl
Cl
Cl
Cl
3.分子的极性判断方法
共用电子对偏向Cl原子,极性向量矢量和指向Cl原子,
故Cl原子一端相对地显负电性,
H原子一端相对地显正电性,
整个分子的电荷分布不均匀
以极性键结合的双子原分子为极性分子。
以非极性键结合的双原子分子均为非极性分子。
2个Cl原子吸引电子的能力相同,共用电子对不偏向任何一个原子,
极性向量矢量和为零,
整个分子的电荷分布均匀
含有极性键的分子一定是极性分子吗?
一般情况下,只含非极性键分子均为非极性分子;
三原子分子:CO2
δ+
δ-
δ-
δ-
F1
F2
F合=0
(3)多原子分子(ABn型)
C=O键是极性键,CO2是直线形、对称分子,两个C=O键的极性互相抵消(F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
①向量和法(合外力法)
根据分子中各个键的极性向量和是否等于零来判断。极性向量和为零则为非极性分子,极性向量和不为零则为极性分子。在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断,
F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)
三原子分子:H2O
O-H键是极性键,分子V形不对称,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
δ-
δ+
δ+
δ+
F1
F合≠0
F2
非极性分子
极性分子
δ+
δ-
δ+
δ+
δ+
F合≠0
三角锥型, 不对称,键的极性不能抵消,是极性分子
四原子分子:BF3
δ+
δ-
δ-
δ-
δ-
F1
F2
F3
F合=0
平面三角形,对称,
键的极性互相抵消(F合=0) ,是非极性分子
非极性分子
四原子分子:NH3
极性分子
非极性分子
δ+
δ-
δ+
δ+
δ+
δ+
五原子分子:CH4
F合
分子极性
分子空间结构
键的极性
小结
F合=0
极性向量合成法
判断正负电中心是否重合
化学键的极性向量和为零的分子是非极性分子;
F2
F1
F合≠0
H C≡N:
键长、键角
化学键的极性向量和不为零,分子是极性分子;
正四面体型,对称结构,C-H键的极性互相抵消( F合=0) ,非极性分子
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价层电子数
分子极性
非极性
非极性
非极性
非极性
极性
极性
极性
3
3
4
4
5
5
6
6
6
6
3
4
2
5
中心原子A的化合价的绝对值
≠价电子数
极性分子
=价电子数(主族序数)
非极性分子
(3)多原子分子(ABn型)
②中心原子化合价法
③空间结构对称法:
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性分子
极性分子
极性分子
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
平面正三角形
三角锥
非极性分子
极性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性分子
CH4、CCl4
直线形
非极性分子
极性分子
O2、H2
HF、CO
σ键电子对数
价层电子对数
VSEPR模型
孤电子对数
空间结构
非中心对称
中心对称
非极性分子
极性分子
经验规律:若中心原子有孤对电子,则为极性分子;若无孤对电子,则为非极性分子。
HCN,CHnX4-n等中心原子孤电子对数为0但属于极性分子(类别与上表不同,上述方法不适用)。
图2-18 常见的极性分子和非极性分子
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)上述九种物质中含非极性共价键的物质有哪些
(3)图2-18九种物质中,哪些是非极性分子?哪些是极性分子?
HCl是极性分子,
H2 、O2、 Cl2 是非极性分子
教材:P52
P4中的P—P为非极性共价键,
C60中的C—C为非极性共价键
P4、C60、CO2、BF3、CH4为非极性分子
HCN、H2O、NH3、CH3Cl为极性分子
思考与讨论
H2O2分子结构呈 形,分子中正电中心和负电中心 重合,是由 键 和 键 构成的为 性分子。
O3中的化学键为 。O均采用 杂化,分子结构呈 形,分子中正电中心和负电中心 重合,为 分子。
极性键
极性
极性
“半开书页”
V
不
δ+
δ-
δ-
sp2
不
注意:由同种元素组成的非金属单质分子不一定是非性分子。
非极性
极性
思考与讨论
电子云密度大
电子云密度小
水分子的表面静电势图
颜色表示静电势的数值:
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
结论:
水分子存在带正电荷的正极和带负电荷的负极。四氯化碳分子中无正极和负极之分。
情景再现
现象:水流发生偏转,四氯化碳液流无变化
1.用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示。下列说法正确的是( )
A.可能A是CH3COOH , B是H2O
B.可能A是苯, B是H2O
C.可能A、B分别为苯、CCl4
D.可能A、B分别为CCl4、CHCl3
BD
对点训练
(1)极性分子中不可能含有非极性键。 ( )
(2)离子化合物中不可能含有非极性键。 ( )
(3)非极性分子中不可能含有极性键。( )
(4)极性分子中一定含有极性键。( )
(5)H2O、CO2、CH4都是非极性分子。( )
(6)以极性键结合起来的分子一定是极性分子。( )
(7)以非极性键结合起来的双原子分子一定是非极性分子。( )
(8)非极性分子只能是双原子单质分子。( )
(9)非极性分子中一定含有非极性共价键。( )
(10)同种元素之间的共价键一定是非极性键。( )
(11)H2O2是由极性键和非极性键构成的极性分子。( )
×
×
√
×
×
×
√
对点训练
2.正误判断:
×
×
×
√
3.在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是____。
(2)以极性键相结合,具有直线形结构的非极性分子是_____。
(3)以极性键相结合,具有三角锥形结构的极性分子是_____。
(4)以极性键相结合,具有正四面体结构的非极性分子是_____。
(5)以极性键相结合,具有V形结构的极性分子是_____。
(6)以极性键相结合,而且分子极性最大的是____。
N2
CS2
NH3
CH4
H2O
HF
对点训练
1.只含非极性键的双原子分子或多原子分子一定是非极性分子(O3是极性键的极性分子) 如:O2、H2、P4、C60、S8
2.由极性键形成的双原子分子都是极性分子。如:HCl、HF、HBr
3.含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子, 否则为极性分子。
4.极性分子中一定有极性键,非极性分子中不一定含有非极性键。
例如CH4是非极性分子,只含有极性键。
含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
5.判断ABn型分子极性的经验规律:
①若中心原子A的化合价的绝对值等于该元素的价电子数(主族序数/原子最外层电子数),则为非极性分子;若不等,则为极性分子。
②中心原子A没有孤对电子(直线形,平面正三角形,正四面体形),则为非极性分子,若无孤电子对,则为非极性分子。
如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
分子不带电(不管是极性分子还是非极性分子)
分子的极性的判断
以极性键结合的多原子分子,判断分子的极性,一定要结合分子的立体构型来看。
方法:对于ABn型分子,
当其空间构型是高度对称的结构时,分子的正负电荷中心能够重合,故为非极性分子(如CO2、BF3、CH4等等);
当分子的空间构型不是高度对称结构,例如只有对称轴而无对称中心时,为极性分子(如H2O、SO2、NH3等等)。
小结
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
正四面体:CH4、CCl4、SiF4
空间对称
小结
补充:乙烯、苯(均为平面形)、异戊烷
都是含有极性键的非极性分子;
甲醛是极性分子。
键的极性对化学性质的影响
由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。
有机羧基的酸性大小与分子组成和结构的关系:
1.只含烃基的一元羧酸的酸性
2.含卤素原子的一元羧酸的酸性
①含不同数目的同种卤素原子的羧酸的酸性
②含相同个数的不同卤素原子的羧酸的酸性
共价键的极性还与相邻基团有关
硝基使O—H共用电子对靠近硝基,我们把像硝基这样的基团称为吸电子基团。
甲基使O—H共用电子对远离甲基,我们把像甲基这样的基团称为推(给)电子基团。
对于有机羧酸,R的吸电子能力越强,
O—H极性增强,更容易电离,酸性增强!
R的推电子能力越强,O—H极性减弱,
更不容易电离,酸性减弱!
三、分子键的极性对化学性质的影响
NO2 > CN > F > Cl > Br > I > C C > OCH3 > OH > C6H5 > C=C > H
常见的吸电子基团:
常见的推电子基团
(CH3)3C > (CH3)2C > CH3CH2 > CH3 > H
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
烃基(符号R—)是推电子基团,使O—H键极性变小,烃基越长推电子效应越大,使羧基中的羟基的极性越小,O—H越难断开,羧酸的酸性越弱。
所以酸性:甲酸>乙酸>丙酸
随着烃基加长,酸性的差异越来越小
1.只含烃基的一元羧酸的酸性
说明:pKa=-lgKa,可用pKa的大小来衡量酸性强弱,
pKa越小,酸性越强。
H
O
H
δ+
δ-
O
C
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
比较氯乙酸和三氯乙酸的酸性
强弱,并解释其原因。
由于电负性:Cl(3.0)>H(2.1) ,极性:Cl—C>H—C,通过传导作用使Cl3C—极性 > Cl2CH— > ClCH2— ,三氯乙酸中的羧基的极性最大,更易电离出氢离子
2.含卤素原子的一元羧酸的酸性
①含不同数目的同种卤素原子的羧酸的酸性
CH2
O
H
δ+
δ-
O
C
Cl
CH
O
H
δ+
δ-
O
C
Cl
Cl
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
比较三氟乙酸和三氯乙酸的
酸性强弱,并解释其原因。
2.含卤素原子的一元羧酸的酸性
②含相同个数的不同卤素原子的羧酸的酸性
电负性:F (4.0)>Cl(3.0) ,极性:F—C>Cl—C,使F3C—的极性> Cl3C—的极性,通过传导作用导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H+。所以三氟乙酸的酸性大于三氯乙酸
F—C—C—O—H
F
F
O
δ-
δ-
δ-
Cl—C—C—O—H
Cl
Cl
O
>
δ-
δ-
δ-
有机羧基的酸性大小与分子组成和结构的关系
1.只含烃基的一元羧酸的酸性:烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减弱。
随着烃基加长,推电子效应越大,羧酸的酸性越弱。
补充:只含烃基的多元羧酸的酸性
烃基所含碳原子数越少,羧基个数越多,酸性越强。
2.含卤素原子的一元羧酸的酸性:与羧基相邻的共价键的极性越大,通过传导作用使羧基中羟基的极性越大,则羧酸的酸性越强。
①含不同数目的同种卤素原子,卤素原子的数目越多,羧酸的酸性越强。
②含相同个数的不同卤素原子,卤素原子的电负性数值越大,酸性越强。
归纳小结
(HO)mROn,如果成酸元素R相同,则n值越大, R的正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。
两种常见含氧酸的结构式:
如:酸性H2SO3
①无机含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
拓展延伸
无机含氧酸酸性强弱的经验规律(O-H极性角度分析)
(2) (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,酸性越强。
n=0,弱酸,如硼酸(H3BO3)
n=1,中强酸,如亚硫酸(H2SO3)
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)
n=3,极强酸,如高氯酸(HClO4)
特例:碳酸n=1,酸性应该和亚硝酸、亚硫酸、磷酸相近是中强酸,实际是弱酸,主要是因为溶于水的二氧化碳分子只有约几百分之一与水结合成碳酸。与按全部转化估算的酸的强度相比小了近百倍
S
O
O
OH
HO
H2SO4
S
O
OH
HO
H2SO3
HClO4
Cl
O
O
O
HO
HClO3
Cl
O
O
HO
HClO2
Cl
O
HO
HClO
Cl
HO
H3PO4
P
OH
O
OH
HO
HNO2
HNO3
N
O
HO
N
O
HO
O
无机含氧酸的结构
(HO)Cl
(HO)ClO
(HO)ClO2
(HO)ClO3
(HO)NO
(HO)NO2
(HO)2SO2
(HO)2SO
(HO)3PO
通式:(HO)mROn
拓展延伸
已知:硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸
(1)写出这两种酸的结构式:________、________。
(2)写出亚磷酸和过量的NaOH溶液反应的化学方程式:
H-O-B-O-H
O
H
H-O-P-O-H
H
O
2NaOH + H3PO3 ═ Na2PO3 + 2H2O
对点训练
1.下列物质中,酸性最强的是( )
A.HCOOH B.HOCOOH C.CH3COOH D.C6H13COOH
2.试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
A
①>②>③>④>⑤>⑥
对点训练
3.已知含氧酸可用通式(HO) mXOn来表示。一般而言,该式中n大的是强酸,n小的是弱酸。下列各含氧酸中酸性最强的是( )
A.HClO4 B.H2SeO3 C.H3BO3 D.H3PO4
4.判断下列含氧酸中成酸元素的化合价并比较酸性
H2SO3 H2SO4 、HNO2 HNO3 、 HClO HClO4
<
<
<
A
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
②什么是单分子膜?双分子膜?举例说明。
③为什么双分子膜以头向外而尾向内的方向排列?
表面活性剂分散在水表面形成一层疏水基团朝空气的单分子层。细胞和细胞膜是双分子膜,由大量两性分子组装而成。
由于细胞膜两侧都是水溶液,水是极性分子,而构成膜两性分子的头基是极性基团而尾基是非极性基团 。
①简要回答表面活性剂的去污原理
科学 技术 社会—表面活性剂和细胞膜
教材:P53
科学 技术 社会—分子结构修饰与分子的性质
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
布诺芬的成酯修饰
甜度增加600倍,热量值极低,可供糖尿病患者食用
提高药物疗效、降低对胃、肠道的刺激性
教材:P55
