2.3.1 苯-【精美课件】2022-2023学年高二化学同步课件(62张ppt)(人教版2019选择性必修3)
文档属性
| 名称 | 2.3.1 苯-【精美课件】2022-2023学年高二化学同步课件(62张ppt)(人教版2019选择性必修3) |  | |
| 格式 | pptx | ||
| 文件大小 | 119.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-07 09:01:35 | ||
图片预览






文档简介
(共62张PPT)
第1课时 苯
第三节 芳香烃
新课引入
我国芳香油的利用具有悠久的历史,远在2300多年前,诗人屈原在《楚辞》中就写下了“蕙肴蒸兮兰藉”的诗文。
在之后科学家的研究中发现,有芳香气味的物质中的很多化合物有一个共同的特点:含有一个相同的结构单元——苯环。
在有机化学发展的初期,便有芳香族化合物这一分类,其是指具有芳香气味的物质。
—CH3
CH CH2
—
—CH3
—CH3
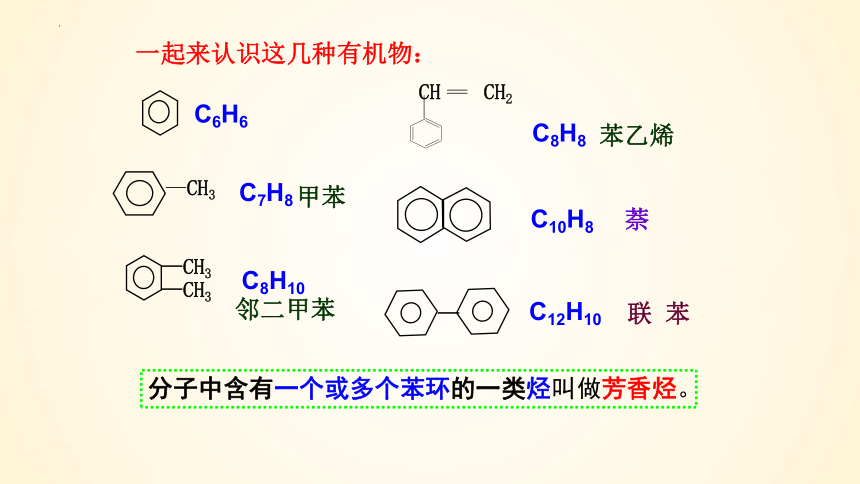
C6H6
C8H10
C7H8
C12H10
C10H8
C8H8
一起来认识这几种有机物:
分子中含有一个或多个苯环的一类烃叫做芳香烃。
甲苯
联 苯
萘
邻二甲苯
苯乙烯
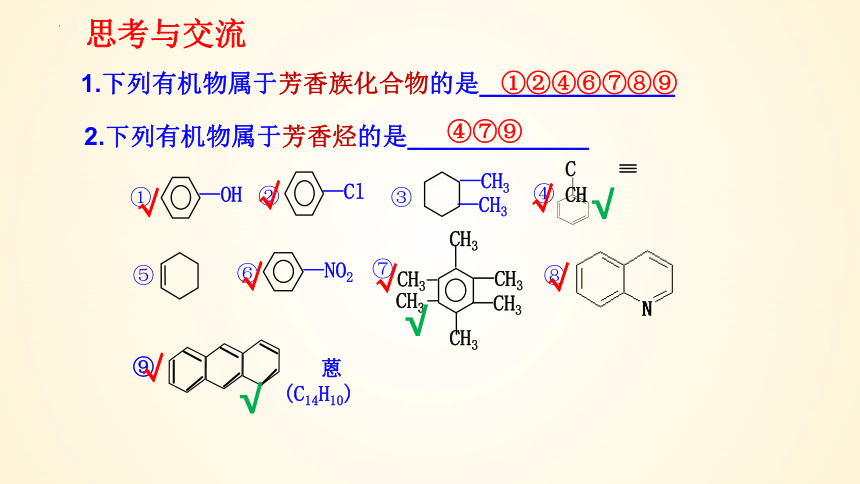
1.下列有机物属于芳香族化合物的是______________
2.下列有机物属于芳香烃的是_____________
—OH
—Cl
—CH3
—CH3
—NO2
⑦
①
②
③
④
⑤
⑥
①②④⑥⑦⑧⑨
④⑦⑨
⑧
思考与交流
C ≡ CH
—CH3
—CH3
CH3
CH3
CH3
CH3
⑨
蒽
(C14H10)
√
√
√
√
√
√
√
√
√
√
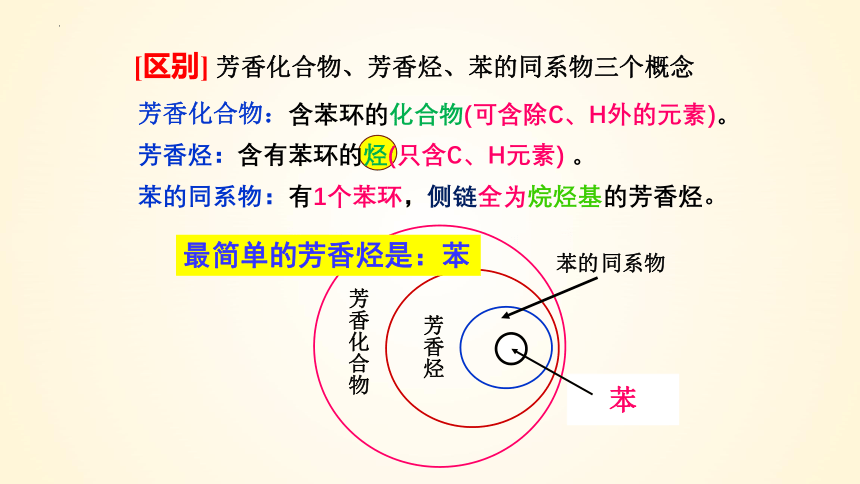
[区别] 芳香化合物、芳香烃、苯的同系物三个概念
芳香化合物:含苯环的化合物(可含除C、H外的元素)。
芳香烃:含有苯环的烃(只含C、H元素) 。
苯的同系物:有1个苯环,侧链全为烷烃基的芳香烃。
芳香烃
同系物
苯的
芳香化合物
苯
最简单的芳香烃是:苯
颜 色:
气 味:
状 态:
密 度:
溶解性:
挥发性:
熔沸点:
无色透明
特殊芳香气味
液体
比水 。
不溶于水, 易溶于有机溶剂
易挥发
熔点5.5℃,沸点80.1 ℃
一.苯的结构和性质
[1] 苯的物理性质
有 毒
用冰冷却时结成无色的晶体。
(密封保存)
小
苯有毒!苯是一种重要的化工原料和有机溶剂.
P41
(0.88g/cm3)
苯是一种对人体危害较大的化学品,人短期内吸入大量的苯可发生急性中毒,症状与酒精中毒相似。慢性苯中毒可引发再生障碍性贫血,还可引起白血病。苯中毒需要治疗的时间很长,往往花费大笔医疗费还难以治愈。
可 怕 的 苯
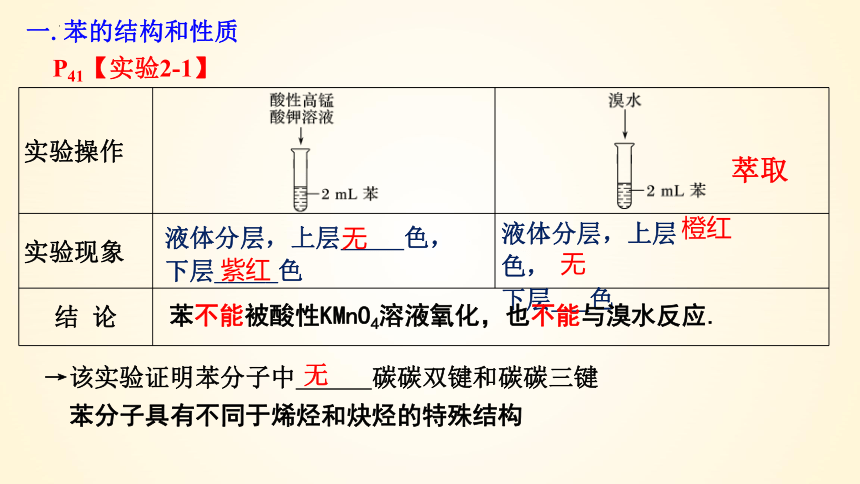
P41【实验2-1】
一.苯的结构和性质
向两只各盛有2 ml苯的试管中分别加入酸性高锰酸钾溶液和溴水,用力振荡,观察现象。
实验操作
实验现象
结 论
液体分层,上层 色,
下层_____色
液体分层,上层 色,
下层___色
P41【实验2-1】
无
紫红
橙红
无
一.苯的结构和性质
苯不能被酸性KMnO4溶液氧化,也不能与溴水反应.
→该实验证明苯分子中 碳碳双键和碳碳三键
苯分子具有不同于烯烃和炔烃的特殊结构
萃取
无
σ键
②结构式:
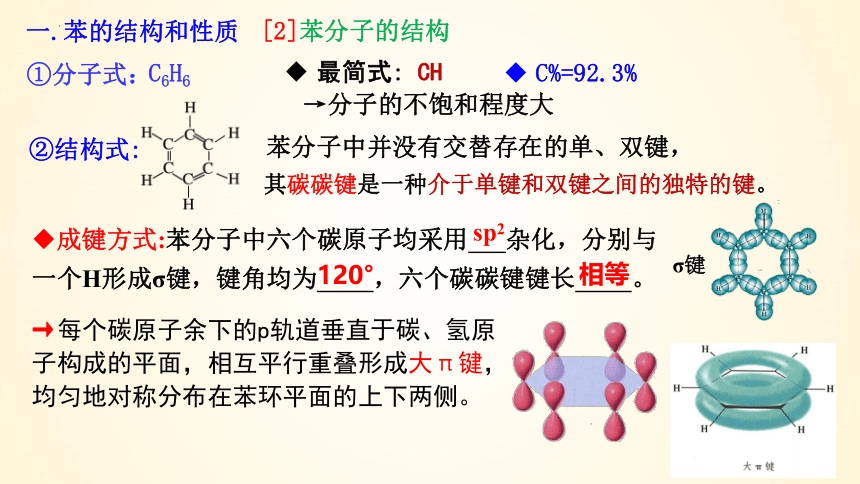
[2]苯分子的结构
①分子式:
C6H6
最简式: CH
C%=92.3%
一.苯的结构和性质
→分子的不饱和程度大
成键方式:苯分子中六个碳原子均采用 杂化,分别与一个H形成σ键,键角均为 ,六个碳碳键键长 。
120°
相等
sp2
其碳碳键是一种介于单键和双键之间的独特的键。
苯分子中并没有交替存在的单、双键,
→每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
与碳碳双键中的π键有什么不同?
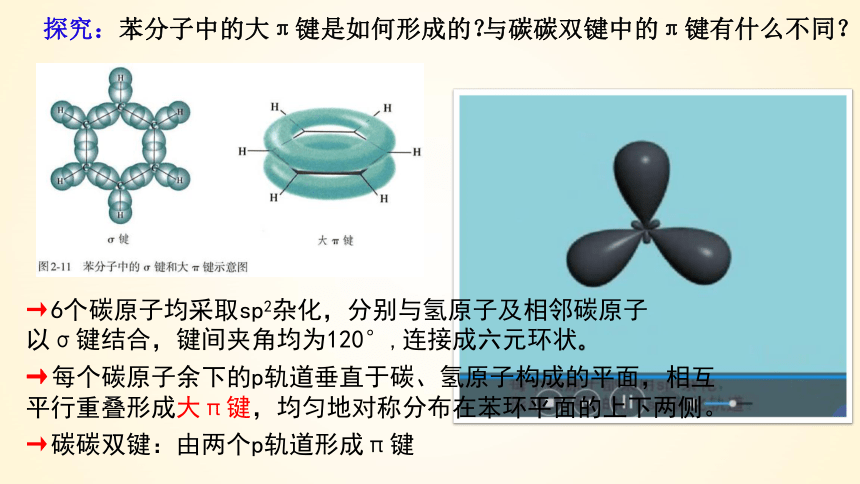
探究:苯分子中的大π键是如何形成的?
→每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
→6个碳原子均采取sp2杂化,分别与氢原子及相邻碳原子以σ键结合,键间夹角均为120°,连接成六元环状。
→碳碳双键:由两个p轨道形成π键
③结构简式:
④苯分子的结构特点:
1)平面正六边形结构:6个碳碳键完全相同,12个原子共平面,键角1200
2)苯分子中的碳碳键是一种介于单键和双键之间的独特的键。
为了纪念凯库勒,凯库勒式,现仍被使用。
3)苯分子中并没有交替存在的单、双键。
凯库勒式
苯分子的结构
苯的大π键结构使苯的性质比烯烃稳定。
一.苯的结构和性质
②结构式:
①分子式:
C6H6
最简式: CH
C%=92.3%
→分子的不饱和程度大
球棍模型
空间填充模型
苯的分子结构可表示为:
苯分子的空间构型
键线式
苯分子是平面正六边形的结构,6个C原子和6个H原子都在同一平面上。
键角 键 能(KJ/mol) 键 长
(10-10 m)
C—C 109o28’ 348 1.54
C=C 120o 615 1.33
苯中碳碳键 120o 约494 1.39
键参数的比较
现代技术对苯分子结构的进一步研究表明:
【进一步探究】
(1) CH2=C=CH-HC=C=CH2
(2) CH≡C-CH2-CH2-C≡CH
(3) CH≡C-C≡C- CH2- CH3
(4) CH3- C ≡ C - C ≡ C- CH3
(5) CH2= CH-CH= CH-C≡CH
苯分子C6H6可能的同分异构体
(了解)
(不稳定)
(6)
(7)
(8)
课本 P42
但在一定条件下,还是能发生氧化、取代、加成等反应。
→苯的大π键比较稳定。
1)苯的氧化反应:在空气中燃烧
[3]苯的化学性质
一.苯的结构和性质
课本 P42
在一定条件下,能发生氧化、取代、加成等反应。
→苯的大π键比较稳定。
1)苯的氧化反应:在空气中燃烧
2C6H6 + 15O2 12CO2+ 6H2O
点燃
现象:火焰明亮,
伴有浓烈的黑烟
【注意】①苯不能使酸性KMnO4溶液褪色
②苯和溴水发生萃取而使之褪色。
[3]苯的化学性质
一.苯的结构和性质
→烃CH4(1:4)、C2H4(1:2)、C2H2及C6H6(1:1)
碳的质量分数越高,黑烟越明显。
苯能够发生取代反应
纯净的溴苯是一种 液体,有 气味, 溶于水,密度比水 。
(溴苯)
——断裂C-H键
2.取代反应
(1)卤代反应
[3]苯的化学性质
一.苯的结构和性质
无色
特殊
不
大
FeBr3可以催化苯和溴反应,生成溴苯。
【知识链接】
思考与交流
(一)苯与溴的实验设计
1.溴是一种易挥发有剧毒的药品
2.液溴的密度比苯的大
3.溴与苯的反应非常缓慢,常用铁粉或FeBr3作为催化剂
4.该反应是放热反应,不需要加热
5.反应最后苯和溴会有剩余,它们易挥发
6.长导管在很多实验中被用作冷凝蒸气使之回流
7. HBr的性质与HCl相似
+ Br2
FeBr3
Br
+ HBr
A
B
C
√
D
1.根据以上信息,请选择最合适的装置制溴苯
2. 实验方案
步骤:在烧瓶中加入苯后再加少量液态溴,
同时加入少量铁屑,用带长导管的瓶塞塞紧瓶口,
反应完毕后,把烧瓶里的液体倒在盛有冷水的烧杯里。
---苯与液溴的取代反应
2. 实验方案
步骤:在烧瓶中加入苯后再加少量液态溴,
同时加入少量铁屑,用带长导管的瓶塞塞紧瓶口,
反应完毕后,把烧瓶里的液体倒在盛有冷水的烧杯里。
烧瓶中:液体轻微沸腾,充满红棕色气体;
锥形瓶中:导管口有白雾。
烧瓶底部:有褐色不溶于水的液体。
现象?
---苯与液溴的取代反应
苯
液溴
混合
长导管口处
锥形瓶内
①滴入AgNO3溶液
烧瓶内液体
倒入烧杯内水中
Fe屑
互溶、
不反应
深红棕色
剧烈
反应
大量白雾
淡黄色沉淀
烧杯底部有褐色油状物、不溶于水
实验小结:
取溶液:
②加入镁粉
产生大量气体
加入NaOH搅拌
得到无色油状物
上层清液中加入KSCN(aq)溶液变血红色
(HBr与水蒸汽的小液滴)
说明瓶内有H+ 和Br—
说明Fe被Br2氧化成了Fe3+
生成了有机物溴苯
从这些现象中分别可以得出什么结论呢?
实验思考题:
1.苯、溴、Fe屑等试剂加入烧瓶的顺序是怎样的?
2.Fe屑的作用是什么?
3.将Fe屑加入烧瓶后,烧瓶内有什么现象?这说明什么?
4.长导管的作用是什么?
5.为什么导管末端不插入液面下?
6.哪些现象说明发生了取代反应而不是加成反应?
苯 液溴 Fe屑
剧烈反应,烧瓶中充满红棕色蒸气。
用于导气和冷凝回流
HBr易溶于水,防止倒吸。
苯与Br2反应生成溴苯的同时有HBr生成,说明它们发生了取代反应因加成反应不会生成HBr。
FeBr3
反应放热
2Fe + 3Br2 = 2FeBr3
与溴反应生成催化剂
7. 纯净的溴苯应是无色的,为什么反应所得的溴苯为褐色?
因为反应剩余液溴、苯等溶解在溴苯中。
8.应如何分离提纯反应得到的粗溴苯?
1)水洗:除去FeBr3、氢溴酸
2)NaOH溶液洗涤:除去溴单质
3)再水洗:除去NaOH等无机物
4)干燥:除去水分
5)蒸馏:除去苯
Br2 + 2NaOH = NaBr + NaBrO + H2O
实验思考题:
9.生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?为什么?如何除去混在HBr中的溴蒸气?
将产生的气体①通过CCl4中洗气(除去其中的溴和苯)
紫色石蕊试液
或AgNO3溶液
不可靠,因为溴易挥发。
AgNO3 +HBr = AgBr↓ +HNO3
长导管
:用于导气和冷凝回流
防止倒吸
除去其中的溴和苯
实验思考题:
②再通入AgNO3溶液中
AgNO3溶液
冷凝水
出口
冷凝水
进口
冷凝管竖直放置时,进水方向与蒸气流向一致;
设计制备溴苯实验方案——再改进1
改 进
创新装置的优点:
①有分液漏斗,可控制液溴的量。
②加装一个用CCl4除溴蒸气的装置。
③倒扣的漏斗可以防倒吸,还有利于尾气吸收。
设计制备溴苯实验方案——再改进2
改 进
苯的溴代反应注意事项总结:
1. 苯只与纯卤素反应。遇到溴水只发生萃取而分层。
2. 必须有FeBr3做催化剂;
3. 苯与Br2只发生一元取代反应
4. 试剂的加入顺序为:先加苯,再加溴,最后加铁粉
5. 长导管的作用:
a.导气:因为苯和溴都易挥发
b.冷凝回流:该反应为放热反应
6. 产物的位置:
HBr由于其易挥发,挥发到锥形瓶中
7.除杂:
为了除去溴苯中的溴,可用NaOH溶液进行除杂。
产物→蒸馏水→NaOH→蒸馏水→分液→无水CaCl2干燥→蒸馏→纯物质
1.苯与液溴在一定条件下反应除生成溴苯外,同时会生成邻二溴苯、对二溴苯等副产物,最终形成的混合物中的某些物质的熔、沸点如表所示。下列说法正确的是
同步练习
苯 溴苯 邻二溴苯 对二溴苯
沸点/℃ 80.5 156.2 225.0 220.1
熔点/℃ 5.5 -30.7 5.0 87.3
A.苯易与H2、Br2等发生加成反应
B.溴苯与对二溴苯互为同系物
C.邻二溴苯分子中所有原子都在同一平面内
D.用蒸馏的方法可以从该混合物中首先分离出对二溴
C
2.下列实验方案能达到实验目的的是
同步练习
A.用甲装置配制一定物质的量浓度的硫酸
B.用乙装置可以制备并收集纯净的NH3
C.粗盐提纯后,用丙装置蒸发结晶得到NaCl晶体
D.丁装置制备溴苯时,通过硝酸银溶液变浑浊证明该反应为取代反应
C
同步练习
3.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述正确的是
A.制备过程中将液溴替换为溴水可减少溴的挥发
B.装置b中的试剂换为AgNO3溶液可检验反应过程中有HBr生成
C.为减少反应物的挥发,先向圆底烧瓶中滴加苯和溴的混合液,后打开开关K
D.反应后的混合液经稀碱溶液洗涤、分液、蒸馏,即可得到溴苯
D
苯能够发生取代反应
纯净的硝基苯是一种 液体,有 气味, 溶于水,密度比水 。
——断裂C-H键
2.取代反应
(2)硝化反应
[3]苯的化学性质
一.苯的结构和性质
无色
苦杏仁
不
大
浓硫酸可催化苯和浓硝酸在50~60℃反应,生成硝基苯。
(硝基苯)
催化剂和脱水剂
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
(二)设计苯的硝化反应实验方案
2)苯与硝酸的反应在50℃--60℃ 时产物是硝基苯。
【知识链接】
1)硝基苯,无色,油状液体,苦杏仁味,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
5)苯和硝酸都易挥发。
4)反应过程中硝酸会部分分解。
3) 浓硫酸和硝酸混合时剧烈放热。
思考与交流
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
温度低于50℃,不易反应;
温度过高会有副产物。
1.根据以上信息,请选择最合适的装置制硝基苯
√
A
B
C
D
玻璃管
温度计
(二)设计苯的硝化反应实验方案
思考与交流
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
①先向反应容器中注入浓硝酸, 再慢慢注入浓硫酸,并及时摇匀和冷却.
②向冷却后的混合酸中, 逐滴加入苯
③将混合物控制在50-60℃的条件下水浴加热
④将反应后的液体倒入盛冷水的烧杯中。
苯的硝化反应
现象
冷凝、回流作用
有黄色油状物生成.
实验步骤:
苯
浓HNO3
浓H2SO4
硝基苯的制取实验装置
←敞口玻璃管
(溶解了NO2的硝基苯)
便于控温,且能使反应物受热均匀
导气兼冷凝回流
先加浓HNO3,再缓慢加入浓H2SO4,待混合酸冷却后再加入苯。
【苯的硝化反应——实验思考】
②为什么要水浴加热?温度计水银球的位置?
③长导管的作用是什么?
①如何混合硫酸和硝酸的混合液?
(温度过高,苯、硝酸易挥发,硝酸也会分解。)
温度计水银球的在水浴中,且不能触底
【苯的硝化反应——实验思考】
⑤如何从上述粗产品中得到纯净的硝基苯?
除杂:
①蒸馏水洗涤(除去NO2)
②NaOH溶液洗涤(除去未反应的硝酸和硫酸)
③蒸馏水洗涤(除去NaOH溶液及与其反应生成的盐)
④无水CaCl2干燥
⑤蒸馏(除去苯)
产物→蒸馏水→NaOH→蒸馏水→分液→无水CaCl2干燥→蒸馏→纯物质
④纯净的硝基苯是无色的,为何反应得到的硝基苯为黄色?
因为在硝基苯中溶有HNO3分解产生的NO2
4. 50~60℃时,苯与浓硝酸在浓硫酸催化下可制取硝基苯。下列对该实验的描述错误的是( )
A.最好用水浴加热,并用温度计控温
B.长玻璃管起冷凝回流作用
C.提纯硝基苯时只需直接用蒸馏水洗涤,便可洗去混在硝基苯中的杂质
D.加入过量硝酸可以提高苯的转化率
同步练习
C
5.在实验室中,下列除去杂质的方法正确的是
A.除去Cl2中的少量HCl:通入饱和食盐水中洗气
B.除去CO2中的少量SO2:通入饱和Na2CO3溶液中洗气
C.除去硝基苯中混有的少量浓HNO3和浓H2SO4:倒入水中,静置,分液
D.除去乙烯中混有的SO2:通入酸性KMnO4溶液中洗气
同步练习
A
+ HO-SO3H
70℃~80℃
-SO3H
+ H2O
P42 资料卡片
磺酸基
苯磺酸
☆★苯的溴代反应、硝化反应、磺化反应都属于取代反应。
苯能够发生取代反应
——断裂C-H键
2.取代反应
(3) 苯的磺化反应
[3]苯的化学性质
一.苯的结构和性质
→该反应可用于制备合成洗涤剂。
(易溶于水的有机强酸)
3.苯的加成反应(难)
+ H2
催化剂(Ni)
△
环己烷
3
①苯与H2加成:
②苯与Cl2在紫外线作用下加成
六氯环己烷
或
(农药六六六)
[3]苯的化学性质
一.苯的结构和性质
苯的大π键比较稳定,通常状态下不易发生加成反应
C6H6 + 3Cl2 C6H6Cl6
紫外线
(Pt或Ni作为催化剂并且加热)
注意:反应条件不同,反应原理相差很大。
+ Cl2
Cl
+ HCl
FeCl3
取代反应
加成反应
苯的化学性质小结:
(2)可燃
(1)稳定
(3)易取代:
(4) 难加成:
2C6H6 + 15O2 12CO2 + 6H2O
点燃
磺化反应
与氢气、氯气加成
不能使溴水和酸性高锰酸钾溶液褪色。
卤代反应
硝化反应
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
+HO-SO3H
70℃~80℃
-SO3H
+ H2O
+ Br2
FeBr3
Br
+ HBr
总体来说,苯的化学性质是“易取代,能加成,难氧化”
课堂检测
1.下列关于苯的性质的叙述中,不正确的是
A.苯是无色带有特殊气味的液体
B.常温下苯是不溶于水且密度小于水的液体
C.苯在一定条件下能与溴发生取代反应
D.苯不含真正的双键,故不能发生加成反应
D
2.下列关于苯的叙述正确的是
A.常温下反应①不能进行,需要加热
B.反应②不能发生,但是仍有分层现象,紫色层在下层
C.反应③为加成反应
D.反应④能发生,证明苯中是单双键交替结构
B
课堂检测
课堂检测
3.关于化合物2-苯基丙烯
,下列说法中正确的是
A.不能使酸性高锰酸钾溶液褪色
B.可以发生加成反应
C.分子中所有原子共平面
D.易溶于水
B
课堂检测
4.立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物。萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等)。
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物
A.①②③ B.①②④ C.①③④ D.②③④
A
课堂检测
5.下列有关苯与乙烯的比较中,正确的是
A.两者碳的百分含量都大于80%
B.都能被酸性高锰酸钾溶液氧化
C.都能与溴水反应使溴水褪色
D.等质量的苯和乙烯完全燃烧时,苯耗氧量大
A
课堂检测
6.苯分子的结构中,不存在C—C键和C=C键的简单交替结构,下列事实中:①苯不能使酸性高锰酸钾溶液褪色;
②苯分子中碳碳键的键长均相等;
③苯在加热和催化剂存在条件下氢化生成环己烷;
④经实验测得邻二甲苯只有一种结构;
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色。可以作为依据的有:
A.①②④⑤ B.①②③④ C.①③④⑤ D.②③④⑤
A
课堂检测
7.关于苯的硝化反应,下列说法正确的是
A.试剂的添加顺序:先将浓硫酸加入试管中再缓慢加入浓硝酸,摇匀冷却后加入苯
B.由粗产品得到纯硝基苯的操作:①水洗后分液②氢氧化钠溶液洗涤后分液③水洗后分液④无水CaCl2干燥⑤蒸馏
C.将反应后的液体倒入盛有水的烧杯中,可以观察到烧杯上部有黄色油状物质生成
D.水浴加热温度应控制在70-80℃
B
C
课堂检测
8.下列装置正确,且能达到实验目的的是
A.图甲探究温度对过氧化氢分解速率的影响
B.图乙装置用K2Cr2O7溶液滴定FeSO4溶液
C.图丙装置进行喷泉实验
D.图丁装置制粗溴苯
课堂检测
9.某同学分别用下列装置a和b制备溴苯,下列说法正确的是( )
A.a装置锥形瓶中有淡黄色沉淀生成,说明烧瓶中发生了取代反应
B.b装置试管中CCl4是用来吸收溴蒸气中HBr
C.b装置中漏斗内有白烟生成,说明烧瓶中生成了溴苯
D.烧瓶中液体经过水洗、碱洗、水洗、结晶得到溴苯
C
10.已知:MnO2+2NaBr+2H2SO4 MnSO4+Na2SO4+Br2↑+2H2O,实验室利用如图所示的装置制备溴苯。下列说法正确的是( )
课堂检测
A.装置接口按气流方向连接顺序为:d→a→b→f→e→c
B.装置甲中进行水浴加热的目的是防止溴蒸气冷凝
C.装置乙中有淡黄色沉淀产生,可证明苯与溴发生了取代反应
D.可用乙醇作洗涤剂除去溴苯中溶解的少量Br2
→e→f
B
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
2)实验开始时,关闭 (填“K1”或“K2”,下同)、打开 。
1)仪器A的名称为 。
分液漏斗
K1
K2
三颈烧瓶中发生主要反应的化学方程式为 .
+ Br2
FeBr3
Br
+ HBr
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
3)能说明苯与液溴发生了取代反应的现象是 。
Ⅲ中硝酸银溶液内有浅黄色沉淀生成
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
4)生成的溴苯因溶有未反应的溴而显橙黄色,提纯的方法是 。
将溶有溴的溴苯倒入盛有NaOH溶液的烧杯中,振荡,
溴苯的密度大于水,沉在下层,用分液漏斗分离出溴苯
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
5)装置Ⅲ小试管中试剂X可选用 (填标号),原因是 。
AC
苯和CCl4能吸收挥发出来的溴蒸气
A.苯 B.水 C.四氯化碳
6)装置Ⅳ的作用是 。
吸收未反应的HBr,防止污染环境且能防止倒吸
第1课时 苯
第三节 芳香烃
新课引入
我国芳香油的利用具有悠久的历史,远在2300多年前,诗人屈原在《楚辞》中就写下了“蕙肴蒸兮兰藉”的诗文。
在之后科学家的研究中发现,有芳香气味的物质中的很多化合物有一个共同的特点:含有一个相同的结构单元——苯环。
在有机化学发展的初期,便有芳香族化合物这一分类,其是指具有芳香气味的物质。
—CH3
CH CH2
—
—CH3
—CH3
C6H6
C8H10
C7H8
C12H10
C10H8
C8H8
一起来认识这几种有机物:
分子中含有一个或多个苯环的一类烃叫做芳香烃。
甲苯
联 苯
萘
邻二甲苯
苯乙烯
1.下列有机物属于芳香族化合物的是______________
2.下列有机物属于芳香烃的是_____________
—OH
—Cl
—CH3
—CH3
—NO2
⑦
①
②
③
④
⑤
⑥
①②④⑥⑦⑧⑨
④⑦⑨
⑧
思考与交流
C ≡ CH
—CH3
—CH3
CH3
CH3
CH3
CH3
⑨
蒽
(C14H10)
√
√
√
√
√
√
√
√
√
√
[区别] 芳香化合物、芳香烃、苯的同系物三个概念
芳香化合物:含苯环的化合物(可含除C、H外的元素)。
芳香烃:含有苯环的烃(只含C、H元素) 。
苯的同系物:有1个苯环,侧链全为烷烃基的芳香烃。
芳香烃
同系物
苯的
芳香化合物
苯
最简单的芳香烃是:苯
颜 色:
气 味:
状 态:
密 度:
溶解性:
挥发性:
熔沸点:
无色透明
特殊芳香气味
液体
比水 。
不溶于水, 易溶于有机溶剂
易挥发
熔点5.5℃,沸点80.1 ℃
一.苯的结构和性质
[1] 苯的物理性质
有 毒
用冰冷却时结成无色的晶体。
(密封保存)
小
苯有毒!苯是一种重要的化工原料和有机溶剂.
P41
(0.88g/cm3)
苯是一种对人体危害较大的化学品,人短期内吸入大量的苯可发生急性中毒,症状与酒精中毒相似。慢性苯中毒可引发再生障碍性贫血,还可引起白血病。苯中毒需要治疗的时间很长,往往花费大笔医疗费还难以治愈。
可 怕 的 苯
P41【实验2-1】
一.苯的结构和性质
向两只各盛有2 ml苯的试管中分别加入酸性高锰酸钾溶液和溴水,用力振荡,观察现象。
实验操作
实验现象
结 论
液体分层,上层 色,
下层_____色
液体分层,上层 色,
下层___色
P41【实验2-1】
无
紫红
橙红
无
一.苯的结构和性质
苯不能被酸性KMnO4溶液氧化,也不能与溴水反应.
→该实验证明苯分子中 碳碳双键和碳碳三键
苯分子具有不同于烯烃和炔烃的特殊结构
萃取
无
σ键
②结构式:
[2]苯分子的结构
①分子式:
C6H6
最简式: CH
C%=92.3%
一.苯的结构和性质
→分子的不饱和程度大
成键方式:苯分子中六个碳原子均采用 杂化,分别与一个H形成σ键,键角均为 ,六个碳碳键键长 。
120°
相等
sp2
其碳碳键是一种介于单键和双键之间的独特的键。
苯分子中并没有交替存在的单、双键,
→每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
与碳碳双键中的π键有什么不同?
探究:苯分子中的大π键是如何形成的?
→每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
→6个碳原子均采取sp2杂化,分别与氢原子及相邻碳原子以σ键结合,键间夹角均为120°,连接成六元环状。
→碳碳双键:由两个p轨道形成π键
③结构简式:
④苯分子的结构特点:
1)平面正六边形结构:6个碳碳键完全相同,12个原子共平面,键角1200
2)苯分子中的碳碳键是一种介于单键和双键之间的独特的键。
为了纪念凯库勒,凯库勒式,现仍被使用。
3)苯分子中并没有交替存在的单、双键。
凯库勒式
苯分子的结构
苯的大π键结构使苯的性质比烯烃稳定。
一.苯的结构和性质
②结构式:
①分子式:
C6H6
最简式: CH
C%=92.3%
→分子的不饱和程度大
球棍模型
空间填充模型
苯的分子结构可表示为:
苯分子的空间构型
键线式
苯分子是平面正六边形的结构,6个C原子和6个H原子都在同一平面上。
键角 键 能(KJ/mol) 键 长
(10-10 m)
C—C 109o28’ 348 1.54
C=C 120o 615 1.33
苯中碳碳键 120o 约494 1.39
键参数的比较
现代技术对苯分子结构的进一步研究表明:
【进一步探究】
(1) CH2=C=CH-HC=C=CH2
(2) CH≡C-CH2-CH2-C≡CH
(3) CH≡C-C≡C- CH2- CH3
(4) CH3- C ≡ C - C ≡ C- CH3
(5) CH2= CH-CH= CH-C≡CH
苯分子C6H6可能的同分异构体
(了解)
(不稳定)
(6)
(7)
(8)
课本 P42
但在一定条件下,还是能发生氧化、取代、加成等反应。
→苯的大π键比较稳定。
1)苯的氧化反应:在空气中燃烧
[3]苯的化学性质
一.苯的结构和性质
课本 P42
在一定条件下,能发生氧化、取代、加成等反应。
→苯的大π键比较稳定。
1)苯的氧化反应:在空气中燃烧
2C6H6 + 15O2 12CO2+ 6H2O
点燃
现象:火焰明亮,
伴有浓烈的黑烟
【注意】①苯不能使酸性KMnO4溶液褪色
②苯和溴水发生萃取而使之褪色。
[3]苯的化学性质
一.苯的结构和性质
→烃CH4(1:4)、C2H4(1:2)、C2H2及C6H6(1:1)
碳的质量分数越高,黑烟越明显。
苯能够发生取代反应
纯净的溴苯是一种 液体,有 气味, 溶于水,密度比水 。
(溴苯)
——断裂C-H键
2.取代反应
(1)卤代反应
[3]苯的化学性质
一.苯的结构和性质
无色
特殊
不
大
FeBr3可以催化苯和溴反应,生成溴苯。
【知识链接】
思考与交流
(一)苯与溴的实验设计
1.溴是一种易挥发有剧毒的药品
2.液溴的密度比苯的大
3.溴与苯的反应非常缓慢,常用铁粉或FeBr3作为催化剂
4.该反应是放热反应,不需要加热
5.反应最后苯和溴会有剩余,它们易挥发
6.长导管在很多实验中被用作冷凝蒸气使之回流
7. HBr的性质与HCl相似
+ Br2
FeBr3
Br
+ HBr
A
B
C
√
D
1.根据以上信息,请选择最合适的装置制溴苯
2. 实验方案
步骤:在烧瓶中加入苯后再加少量液态溴,
同时加入少量铁屑,用带长导管的瓶塞塞紧瓶口,
反应完毕后,把烧瓶里的液体倒在盛有冷水的烧杯里。
---苯与液溴的取代反应
2. 实验方案
步骤:在烧瓶中加入苯后再加少量液态溴,
同时加入少量铁屑,用带长导管的瓶塞塞紧瓶口,
反应完毕后,把烧瓶里的液体倒在盛有冷水的烧杯里。
烧瓶中:液体轻微沸腾,充满红棕色气体;
锥形瓶中:导管口有白雾。
烧瓶底部:有褐色不溶于水的液体。
现象?
---苯与液溴的取代反应
苯
液溴
混合
长导管口处
锥形瓶内
①滴入AgNO3溶液
烧瓶内液体
倒入烧杯内水中
Fe屑
互溶、
不反应
深红棕色
剧烈
反应
大量白雾
淡黄色沉淀
烧杯底部有褐色油状物、不溶于水
实验小结:
取溶液:
②加入镁粉
产生大量气体
加入NaOH搅拌
得到无色油状物
上层清液中加入KSCN(aq)溶液变血红色
(HBr与水蒸汽的小液滴)
说明瓶内有H+ 和Br—
说明Fe被Br2氧化成了Fe3+
生成了有机物溴苯
从这些现象中分别可以得出什么结论呢?
实验思考题:
1.苯、溴、Fe屑等试剂加入烧瓶的顺序是怎样的?
2.Fe屑的作用是什么?
3.将Fe屑加入烧瓶后,烧瓶内有什么现象?这说明什么?
4.长导管的作用是什么?
5.为什么导管末端不插入液面下?
6.哪些现象说明发生了取代反应而不是加成反应?
苯 液溴 Fe屑
剧烈反应,烧瓶中充满红棕色蒸气。
用于导气和冷凝回流
HBr易溶于水,防止倒吸。
苯与Br2反应生成溴苯的同时有HBr生成,说明它们发生了取代反应因加成反应不会生成HBr。
FeBr3
反应放热
2Fe + 3Br2 = 2FeBr3
与溴反应生成催化剂
7. 纯净的溴苯应是无色的,为什么反应所得的溴苯为褐色?
因为反应剩余液溴、苯等溶解在溴苯中。
8.应如何分离提纯反应得到的粗溴苯?
1)水洗:除去FeBr3、氢溴酸
2)NaOH溶液洗涤:除去溴单质
3)再水洗:除去NaOH等无机物
4)干燥:除去水分
5)蒸馏:除去苯
Br2 + 2NaOH = NaBr + NaBrO + H2O
实验思考题:
9.生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?为什么?如何除去混在HBr中的溴蒸气?
将产生的气体①通过CCl4中洗气(除去其中的溴和苯)
紫色石蕊试液
或AgNO3溶液
不可靠,因为溴易挥发。
AgNO3 +HBr = AgBr↓ +HNO3
长导管
:用于导气和冷凝回流
防止倒吸
除去其中的溴和苯
实验思考题:
②再通入AgNO3溶液中
AgNO3溶液
冷凝水
出口
冷凝水
进口
冷凝管竖直放置时,进水方向与蒸气流向一致;
设计制备溴苯实验方案——再改进1
改 进
创新装置的优点:
①有分液漏斗,可控制液溴的量。
②加装一个用CCl4除溴蒸气的装置。
③倒扣的漏斗可以防倒吸,还有利于尾气吸收。
设计制备溴苯实验方案——再改进2
改 进
苯的溴代反应注意事项总结:
1. 苯只与纯卤素反应。遇到溴水只发生萃取而分层。
2. 必须有FeBr3做催化剂;
3. 苯与Br2只发生一元取代反应
4. 试剂的加入顺序为:先加苯,再加溴,最后加铁粉
5. 长导管的作用:
a.导气:因为苯和溴都易挥发
b.冷凝回流:该反应为放热反应
6. 产物的位置:
HBr由于其易挥发,挥发到锥形瓶中
7.除杂:
为了除去溴苯中的溴,可用NaOH溶液进行除杂。
产物→蒸馏水→NaOH→蒸馏水→分液→无水CaCl2干燥→蒸馏→纯物质
1.苯与液溴在一定条件下反应除生成溴苯外,同时会生成邻二溴苯、对二溴苯等副产物,最终形成的混合物中的某些物质的熔、沸点如表所示。下列说法正确的是
同步练习
苯 溴苯 邻二溴苯 对二溴苯
沸点/℃ 80.5 156.2 225.0 220.1
熔点/℃ 5.5 -30.7 5.0 87.3
A.苯易与H2、Br2等发生加成反应
B.溴苯与对二溴苯互为同系物
C.邻二溴苯分子中所有原子都在同一平面内
D.用蒸馏的方法可以从该混合物中首先分离出对二溴
C
2.下列实验方案能达到实验目的的是
同步练习
A.用甲装置配制一定物质的量浓度的硫酸
B.用乙装置可以制备并收集纯净的NH3
C.粗盐提纯后,用丙装置蒸发结晶得到NaCl晶体
D.丁装置制备溴苯时,通过硝酸银溶液变浑浊证明该反应为取代反应
C
同步练习
3.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述正确的是
A.制备过程中将液溴替换为溴水可减少溴的挥发
B.装置b中的试剂换为AgNO3溶液可检验反应过程中有HBr生成
C.为减少反应物的挥发,先向圆底烧瓶中滴加苯和溴的混合液,后打开开关K
D.反应后的混合液经稀碱溶液洗涤、分液、蒸馏,即可得到溴苯
D
苯能够发生取代反应
纯净的硝基苯是一种 液体,有 气味, 溶于水,密度比水 。
——断裂C-H键
2.取代反应
(2)硝化反应
[3]苯的化学性质
一.苯的结构和性质
无色
苦杏仁
不
大
浓硫酸可催化苯和浓硝酸在50~60℃反应,生成硝基苯。
(硝基苯)
催化剂和脱水剂
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
(二)设计苯的硝化反应实验方案
2)苯与硝酸的反应在50℃--60℃ 时产物是硝基苯。
【知识链接】
1)硝基苯,无色,油状液体,苦杏仁味,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
5)苯和硝酸都易挥发。
4)反应过程中硝酸会部分分解。
3) 浓硫酸和硝酸混合时剧烈放热。
思考与交流
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
温度低于50℃,不易反应;
温度过高会有副产物。
1.根据以上信息,请选择最合适的装置制硝基苯
√
A
B
C
D
玻璃管
温度计
(二)设计苯的硝化反应实验方案
思考与交流
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
①先向反应容器中注入浓硝酸, 再慢慢注入浓硫酸,并及时摇匀和冷却.
②向冷却后的混合酸中, 逐滴加入苯
③将混合物控制在50-60℃的条件下水浴加热
④将反应后的液体倒入盛冷水的烧杯中。
苯的硝化反应
现象
冷凝、回流作用
有黄色油状物生成.
实验步骤:
苯
浓HNO3
浓H2SO4
硝基苯的制取实验装置
←敞口玻璃管
(溶解了NO2的硝基苯)
便于控温,且能使反应物受热均匀
导气兼冷凝回流
先加浓HNO3,再缓慢加入浓H2SO4,待混合酸冷却后再加入苯。
【苯的硝化反应——实验思考】
②为什么要水浴加热?温度计水银球的位置?
③长导管的作用是什么?
①如何混合硫酸和硝酸的混合液?
(温度过高,苯、硝酸易挥发,硝酸也会分解。)
温度计水银球的在水浴中,且不能触底
【苯的硝化反应——实验思考】
⑤如何从上述粗产品中得到纯净的硝基苯?
除杂:
①蒸馏水洗涤(除去NO2)
②NaOH溶液洗涤(除去未反应的硝酸和硫酸)
③蒸馏水洗涤(除去NaOH溶液及与其反应生成的盐)
④无水CaCl2干燥
⑤蒸馏(除去苯)
产物→蒸馏水→NaOH→蒸馏水→分液→无水CaCl2干燥→蒸馏→纯物质
④纯净的硝基苯是无色的,为何反应得到的硝基苯为黄色?
因为在硝基苯中溶有HNO3分解产生的NO2
4. 50~60℃时,苯与浓硝酸在浓硫酸催化下可制取硝基苯。下列对该实验的描述错误的是( )
A.最好用水浴加热,并用温度计控温
B.长玻璃管起冷凝回流作用
C.提纯硝基苯时只需直接用蒸馏水洗涤,便可洗去混在硝基苯中的杂质
D.加入过量硝酸可以提高苯的转化率
同步练习
C
5.在实验室中,下列除去杂质的方法正确的是
A.除去Cl2中的少量HCl:通入饱和食盐水中洗气
B.除去CO2中的少量SO2:通入饱和Na2CO3溶液中洗气
C.除去硝基苯中混有的少量浓HNO3和浓H2SO4:倒入水中,静置,分液
D.除去乙烯中混有的SO2:通入酸性KMnO4溶液中洗气
同步练习
A
+ HO-SO3H
70℃~80℃
-SO3H
+ H2O
P42 资料卡片
磺酸基
苯磺酸
☆★苯的溴代反应、硝化反应、磺化反应都属于取代反应。
苯能够发生取代反应
——断裂C-H键
2.取代反应
(3) 苯的磺化反应
[3]苯的化学性质
一.苯的结构和性质
→该反应可用于制备合成洗涤剂。
(易溶于水的有机强酸)
3.苯的加成反应(难)
+ H2
催化剂(Ni)
△
环己烷
3
①苯与H2加成:
②苯与Cl2在紫外线作用下加成
六氯环己烷
或
(农药六六六)
[3]苯的化学性质
一.苯的结构和性质
苯的大π键比较稳定,通常状态下不易发生加成反应
C6H6 + 3Cl2 C6H6Cl6
紫外线
(Pt或Ni作为催化剂并且加热)
注意:反应条件不同,反应原理相差很大。
+ Cl2
Cl
+ HCl
FeCl3
取代反应
加成反应
苯的化学性质小结:
(2)可燃
(1)稳定
(3)易取代:
(4) 难加成:
2C6H6 + 15O2 12CO2 + 6H2O
点燃
磺化反应
与氢气、氯气加成
不能使溴水和酸性高锰酸钾溶液褪色。
卤代反应
硝化反应
+ HO-NO2
浓H2SO4
500C—600C
NO2
+ H2O
+HO-SO3H
70℃~80℃
-SO3H
+ H2O
+ Br2
FeBr3
Br
+ HBr
总体来说,苯的化学性质是“易取代,能加成,难氧化”
课堂检测
1.下列关于苯的性质的叙述中,不正确的是
A.苯是无色带有特殊气味的液体
B.常温下苯是不溶于水且密度小于水的液体
C.苯在一定条件下能与溴发生取代反应
D.苯不含真正的双键,故不能发生加成反应
D
2.下列关于苯的叙述正确的是
A.常温下反应①不能进行,需要加热
B.反应②不能发生,但是仍有分层现象,紫色层在下层
C.反应③为加成反应
D.反应④能发生,证明苯中是单双键交替结构
B
课堂检测
课堂检测
3.关于化合物2-苯基丙烯
,下列说法中正确的是
A.不能使酸性高锰酸钾溶液褪色
B.可以发生加成反应
C.分子中所有原子共平面
D.易溶于水
B
课堂检测
4.立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物。萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等)。
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物
A.①②③ B.①②④ C.①③④ D.②③④
A
课堂检测
5.下列有关苯与乙烯的比较中,正确的是
A.两者碳的百分含量都大于80%
B.都能被酸性高锰酸钾溶液氧化
C.都能与溴水反应使溴水褪色
D.等质量的苯和乙烯完全燃烧时,苯耗氧量大
A
课堂检测
6.苯分子的结构中,不存在C—C键和C=C键的简单交替结构,下列事实中:①苯不能使酸性高锰酸钾溶液褪色;
②苯分子中碳碳键的键长均相等;
③苯在加热和催化剂存在条件下氢化生成环己烷;
④经实验测得邻二甲苯只有一种结构;
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色。可以作为依据的有:
A.①②④⑤ B.①②③④ C.①③④⑤ D.②③④⑤
A
课堂检测
7.关于苯的硝化反应,下列说法正确的是
A.试剂的添加顺序:先将浓硫酸加入试管中再缓慢加入浓硝酸,摇匀冷却后加入苯
B.由粗产品得到纯硝基苯的操作:①水洗后分液②氢氧化钠溶液洗涤后分液③水洗后分液④无水CaCl2干燥⑤蒸馏
C.将反应后的液体倒入盛有水的烧杯中,可以观察到烧杯上部有黄色油状物质生成
D.水浴加热温度应控制在70-80℃
B
C
课堂检测
8.下列装置正确,且能达到实验目的的是
A.图甲探究温度对过氧化氢分解速率的影响
B.图乙装置用K2Cr2O7溶液滴定FeSO4溶液
C.图丙装置进行喷泉实验
D.图丁装置制粗溴苯
课堂检测
9.某同学分别用下列装置a和b制备溴苯,下列说法正确的是( )
A.a装置锥形瓶中有淡黄色沉淀生成,说明烧瓶中发生了取代反应
B.b装置试管中CCl4是用来吸收溴蒸气中HBr
C.b装置中漏斗内有白烟生成,说明烧瓶中生成了溴苯
D.烧瓶中液体经过水洗、碱洗、水洗、结晶得到溴苯
C
10.已知:MnO2+2NaBr+2H2SO4 MnSO4+Na2SO4+Br2↑+2H2O,实验室利用如图所示的装置制备溴苯。下列说法正确的是( )
课堂检测
A.装置接口按气流方向连接顺序为:d→a→b→f→e→c
B.装置甲中进行水浴加热的目的是防止溴蒸气冷凝
C.装置乙中有淡黄色沉淀产生,可证明苯与溴发生了取代反应
D.可用乙醇作洗涤剂除去溴苯中溶解的少量Br2
→e→f
B
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
2)实验开始时,关闭 (填“K1”或“K2”,下同)、打开 。
1)仪器A的名称为 。
分液漏斗
K1
K2
三颈烧瓶中发生主要反应的化学方程式为 .
+ Br2
FeBr3
Br
+ HBr
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
3)能说明苯与液溴发生了取代反应的现象是 。
Ⅲ中硝酸银溶液内有浅黄色沉淀生成
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
4)生成的溴苯因溶有未反应的溴而显橙黄色,提纯的方法是 。
将溶有溴的溴苯倒入盛有NaOH溶液的烧杯中,振荡,
溴苯的密度大于水,沉在下层,用分液漏斗分离出溴苯
课堂检测
11.某校学生用如图所示装置进行实验(夹持装置略),探究苯与液溴发生反应的原理,并分离、提纯反应产物。
5)装置Ⅲ小试管中试剂X可选用 (填标号),原因是 。
AC
苯和CCl4能吸收挥发出来的溴蒸气
A.苯 B.水 C.四氯化碳
6)装置Ⅳ的作用是 。
吸收未反应的HBr,防止污染环境且能防止倒吸
