人教版化学九下:11.1.1 常见的盐 探究课件(共34张PPT)
文档属性
| 名称 | 人教版化学九下:11.1.1 常见的盐 探究课件(共34张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-06 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
R·九年级化学下册
第1课时常见的盐
第十一单元 盐 化肥
课题1 生活中常见的盐
学习目标
1. 了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途。
2. 知道粗盐提纯的步骤。
课前自学准备
课标要求
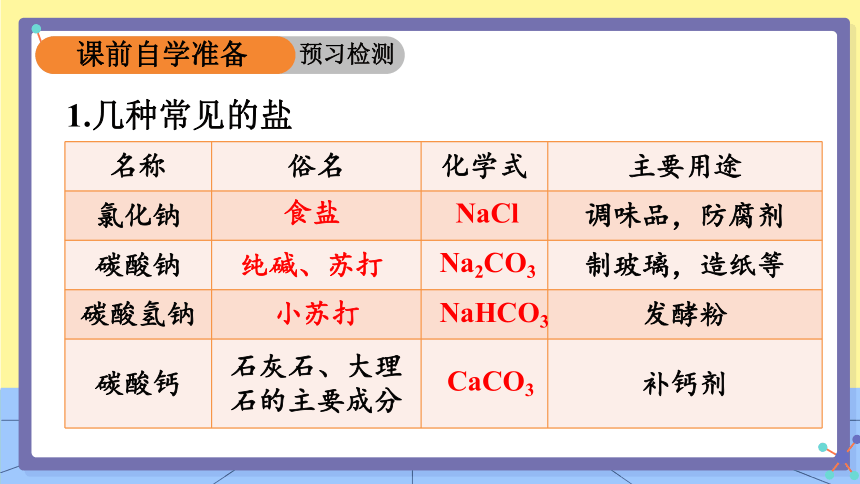
1.几种常见的盐
名称 俗名 化学式 主要用途
氯化钠 调味品,防腐剂
碳酸钠 制玻璃,造纸等
碳酸氢钠 发酵粉
碳酸钙 石灰石、大理石的主要成分 补钙剂
CaCO3
NaHCO3
Na2CO3
纯碱、苏打
小苏打
NaCl
食盐
课前自学准备
预习检测
2. 的检验方法:加入____________,有气泡产生,将生成的气体通入___________________中,有白色沉淀生成。
3. Na2CO3 溶液与澄清的石灰水反应,产生的现象为有_______________,反应的化学方程式为
________________________________________。
白色沉淀生成
足量稀盐酸
澄清的石灰水
日常生活中所说的盐,通常指食盐(主要成分是NaCl),而化学中的盐是指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物,如氯化钠、碳酸铜、碳酸钙等,不仅仅是指食盐。
生活中常见盐还有碳酸钠,俗称纯碱、苏打,碳酸氢钠俗称小苏打,高锰酸钾和大理石(主要成分是CaCO3)等,都属于盐。
知识点1 氯化钠、碳酸钠、碳酸氢钠、碳酸钙
一、氯化钠
炒菜时,我们都要用到食盐,食盐的主要成分是氯化钠。你对氯化钠了解有多少呢?
氯化钠
钠离子
氯离子
课堂教学展示
课堂探究
(1)生活中用做调味品
(2)腌制食品
(3)医疗上,制取生理盐水
(4)雪后公路上撒盐
(5)工业上做化工原料
(6)农业上选种 ……
你知道食盐是怎么来的吗?
氯化钠的溶解度随着温度的升高而增大,受温度影响变化不大。饱和溶液蒸发水分会析出晶体。
海水晒盐
粗盐经溶解、沉淀、过滤、蒸发、结晶等处理可制得精盐。
海水、湖水、井水
提纯,除去不溶物
除去可溶物
精盐
蒸发
粗盐
(含泥沙、MgCl2、CaCl2)
海水晒盐
1.氯化钠是由氯离子和钠离子组成。
2.氯化钠的用途:①化工原料;②调味品;③生理盐水;④防止食物腐败。
3.氯化钠的分布:海水、盐井、盐湖。
4.制备方法:蒸发溶剂——粗盐。
归纳
1.物理性质:
二、碳酸钠、碳酸氢钠和碳酸钙
Na2CO3俗称纯碱或苏打,是易溶于水的白色粉末
NaHCO3俗称小苏打,是易溶于水的白色粉末
CaCO3是难溶于水的白色固体
2.用途:
碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
碳酸钙是重要的建筑材料,还可用作补钙剂。
碳酸氢钠是焙制糕点所用发酵粉的主要成分之一,在医疗上它是治疗胃酸过多症的一种药剂。
名称 碳酸钠 碳酸氢钠 碳酸钙
俗名
性质
主要用途
苏打、纯碱
小苏打
大理石、石灰石
易溶于水的白色粉末,水溶液呈碱性
易溶于水的白色粉末,水溶液呈碱性
难溶于水的白色固体
用于玻璃、造纸、纺织、洗涤剂的生产
发酵粉的主要成分、治疗胃酸过多的药剂
建筑材料,补钙剂
归纳
例 碳酸钠可用于制造玻璃,其俗称是( )
A.小苏打 B.熟石灰
C.生石灰 D.纯碱
解析:碳酸钠是一种重要的盐,具有广泛的用途,可用于制造玻璃,碳酸钠俗称纯碱或苏打。
D
课堂教学展示
典例剖析
知识点2 碳酸钠、碳酸氢钠、碳酸钙的化学性质
【回顾】 请书写出实验室制取CO2的方程式。
CO2↑+H2O
盐酸腐蚀含CaCO3的建材
讨论
比较碳酸钠与碳酸氢钠的组成,推断碳酸钠与碳酸氢钠是否也能发生上述类似的反应。
向盛有0.5 g碳酸钠的试管里加入2 mL盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象。
用碳酸氢钠代替碳酸钠进行上述实验,并分析现象。
实验11-1
实验11-1
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
固体溶解,产生大量气泡,澄清石灰水变浑浊。
它们都能和盐酸反应生成CO2
探究碳酸钠和碳酸氢钠是否和盐酸发生反应
观察与思考
①观察:三个反应有什么共同特点?
②总结:鉴定碳酸根离子(或碳酸氢根离子)的方法。
(1)检验试剂:稀盐酸和澄清石灰水
(2)检验方法:取盐的样品少量于试管中,滴加稀盐酸,若有气泡产生,将生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明原盐的样品中含有 (或 )。
鉴定碳酸根(或碳酸氢根)离子的方法
归纳
例 图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
△△牌发酵粉
【主要成分】NaHCO3、酒石酸
【用途】面粉发酵,焙制糕点
【用法】取本品适量加水溶解与面团揉和或直接与面团揉和后加热
图 1
图 2
课堂教学展示
典例剖析
【查阅资料】(1)酒石酸是一种易溶于水的固 体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO3受热不分解。
【提出问题】NaHCO3在发酵粉加水或加热时如何产生CO2?
【假设猜想】甲:……
乙:酒石酸与NaHCO3在溶液中反应产生 CO2。
丙:NaHCO3加热产生CO2。
【实验探究】
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是
________________________________。
小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是
______________________。
(2)小英同学为探究猜想丙设计了图2所示的实验装置:小英另取适量NaHCO3粉末加入a试管中,
NaHCO3和水反应产生二氧化碳
NaHCO3能与酸反应
加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为
_________________________________________。
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是_______。
【实验小结】NaHCO3在发酵粉中产生CO2的条件是_______;NaHCO3受热发生变化的化学方程式为
__________________________________。
Na2CO3
加热
△
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象。
碳酸钠溶液+澄清石灰水
现象
分析
实验11-2
碳酸钠溶液+澄清石灰水
现象
分析
出现白色沉淀
可溶性碳酸盐和石灰水反应产生白色沉淀
工业制取烧碱的反应
本节课我们主要学习了:
1.碳酸钠、碳酸氢钠和碳酸钙等几种常见的盐在生活中的重要用途,以及在自然界中的分布。
2.碳酸根离子或碳酸氢根离子的检验方法:
①加稀盐酸,产生气泡;
②气体通入澄清石灰水,变浑浊。
课堂教学展示
课堂小结
1.解释下述现象。
(1)鸡蛋壳的主要成分是碳酸钙。将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。
练习与应用(P78)
课后反馈总结
课本习题
解:1.(1)当鸡蛋放入盛有足量稀盐酸的玻璃杯中时,其主要成分碳酸钙就和盐酸反应生成二氧化碳气体,产生气泡。此时反应刚开始,鸡蛋的重力大于浮力,所以鸡蛋一边冒气泡一边沉到杯底;随着反应的进行,生成的二氧化碳气体附着在蛋壳表面上,浮力不断增大;当浮力大于重力时,鸡蛋慢慢上浮;当鸡蛋上浮到接近液面时,二氧化碳气体不断逸出进入空气中,使浮力小于重力,因此鸡蛋又下沉。如此不断循环反复,直至反应结束,鸡蛋沉入液面下。
(2)馒头、面包等发面食品的一个特点是面团中有许多小孔(如右图),它们使发面食品松软可口。根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用。
解:(2)NaHCO3和有机酸溶于水后,在蒸食品过程中生成CO2气体,使食品松软可口。
6.氯化钠在生活、生产中的用途非常广泛。请通过查阅报纸、书刊、网络和访谈等,了解氯化钠的用途,并以“氯化钠的妙用”为题编制资料卡片。
解:氯化钠的妙用
①医疗:生理盐水是0.9%的NaCl溶液;
②农业生产:用氯化钠溶液选种;
③生活:用食盐腌制蔬菜、鱼、肉、蛋等;
④交通:用氯化钠消除公路上的积雪;
⑤化工生产:以NaCl为原料制取Na2CO3、NaOH、Cl2、盐酸等。
R·九年级化学下册
第1课时常见的盐
第十一单元 盐 化肥
课题1 生活中常见的盐
学习目标
1. 了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的组成及其在生活中的主要用途。
2. 知道粗盐提纯的步骤。
课前自学准备
课标要求
1.几种常见的盐
名称 俗名 化学式 主要用途
氯化钠 调味品,防腐剂
碳酸钠 制玻璃,造纸等
碳酸氢钠 发酵粉
碳酸钙 石灰石、大理石的主要成分 补钙剂
CaCO3
NaHCO3
Na2CO3
纯碱、苏打
小苏打
NaCl
食盐
课前自学准备
预习检测
2. 的检验方法:加入____________,有气泡产生,将生成的气体通入___________________中,有白色沉淀生成。
3. Na2CO3 溶液与澄清的石灰水反应,产生的现象为有_______________,反应的化学方程式为
________________________________________。
白色沉淀生成
足量稀盐酸
澄清的石灰水
日常生活中所说的盐,通常指食盐(主要成分是NaCl),而化学中的盐是指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物,如氯化钠、碳酸铜、碳酸钙等,不仅仅是指食盐。
生活中常见盐还有碳酸钠,俗称纯碱、苏打,碳酸氢钠俗称小苏打,高锰酸钾和大理石(主要成分是CaCO3)等,都属于盐。
知识点1 氯化钠、碳酸钠、碳酸氢钠、碳酸钙
一、氯化钠
炒菜时,我们都要用到食盐,食盐的主要成分是氯化钠。你对氯化钠了解有多少呢?
氯化钠
钠离子
氯离子
课堂教学展示
课堂探究
(1)生活中用做调味品
(2)腌制食品
(3)医疗上,制取生理盐水
(4)雪后公路上撒盐
(5)工业上做化工原料
(6)农业上选种 ……
你知道食盐是怎么来的吗?
氯化钠的溶解度随着温度的升高而增大,受温度影响变化不大。饱和溶液蒸发水分会析出晶体。
海水晒盐
粗盐经溶解、沉淀、过滤、蒸发、结晶等处理可制得精盐。
海水、湖水、井水
提纯,除去不溶物
除去可溶物
精盐
蒸发
粗盐
(含泥沙、MgCl2、CaCl2)
海水晒盐
1.氯化钠是由氯离子和钠离子组成。
2.氯化钠的用途:①化工原料;②调味品;③生理盐水;④防止食物腐败。
3.氯化钠的分布:海水、盐井、盐湖。
4.制备方法:蒸发溶剂——粗盐。
归纳
1.物理性质:
二、碳酸钠、碳酸氢钠和碳酸钙
Na2CO3俗称纯碱或苏打,是易溶于水的白色粉末
NaHCO3俗称小苏打,是易溶于水的白色粉末
CaCO3是难溶于水的白色固体
2.用途:
碳酸钠广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
碳酸钙是重要的建筑材料,还可用作补钙剂。
碳酸氢钠是焙制糕点所用发酵粉的主要成分之一,在医疗上它是治疗胃酸过多症的一种药剂。
名称 碳酸钠 碳酸氢钠 碳酸钙
俗名
性质
主要用途
苏打、纯碱
小苏打
大理石、石灰石
易溶于水的白色粉末,水溶液呈碱性
易溶于水的白色粉末,水溶液呈碱性
难溶于水的白色固体
用于玻璃、造纸、纺织、洗涤剂的生产
发酵粉的主要成分、治疗胃酸过多的药剂
建筑材料,补钙剂
归纳
例 碳酸钠可用于制造玻璃,其俗称是( )
A.小苏打 B.熟石灰
C.生石灰 D.纯碱
解析:碳酸钠是一种重要的盐,具有广泛的用途,可用于制造玻璃,碳酸钠俗称纯碱或苏打。
D
课堂教学展示
典例剖析
知识点2 碳酸钠、碳酸氢钠、碳酸钙的化学性质
【回顾】 请书写出实验室制取CO2的方程式。
CO2↑+H2O
盐酸腐蚀含CaCO3的建材
讨论
比较碳酸钠与碳酸氢钠的组成,推断碳酸钠与碳酸氢钠是否也能发生上述类似的反应。
向盛有0.5 g碳酸钠的试管里加入2 mL盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象。
用碳酸氢钠代替碳酸钠进行上述实验,并分析现象。
实验11-1
实验11-1
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
固体溶解,产生大量气泡,澄清石灰水变浑浊。
它们都能和盐酸反应生成CO2
探究碳酸钠和碳酸氢钠是否和盐酸发生反应
观察与思考
①观察:三个反应有什么共同特点?
②总结:鉴定碳酸根离子(或碳酸氢根离子)的方法。
(1)检验试剂:稀盐酸和澄清石灰水
(2)检验方法:取盐的样品少量于试管中,滴加稀盐酸,若有气泡产生,将生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明原盐的样品中含有 (或 )。
鉴定碳酸根(或碳酸氢根)离子的方法
归纳
例 图1是“△△牌发酵粉”的部分信息,课外化学兴趣小组的同学对其进行了如下探究(请你完成相应填空):
△△牌发酵粉
【主要成分】NaHCO3、酒石酸
【用途】面粉发酵,焙制糕点
【用法】取本品适量加水溶解与面团揉和或直接与面团揉和后加热
图 1
图 2
课堂教学展示
典例剖析
【查阅资料】(1)酒石酸是一种易溶于水的固 体有机酸;
(2)发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致;
(3)Na2CO3受热不分解。
【提出问题】NaHCO3在发酵粉加水或加热时如何产生CO2?
【假设猜想】甲:……
乙:酒石酸与NaHCO3在溶液中反应产生 CO2。
丙:NaHCO3加热产生CO2。
【实验探究】
(1)小明同学取少量NaHCO3粉末于试管中,加入适量水,无气体产生,从而否定了猜想甲,则猜想甲是
________________________________。
小明又将酒石酸溶液和NaHCO3溶液混合,产生了CO2,从而验证了猜想乙,说明了NaHCO3具有的性质之一是
______________________。
(2)小英同学为探究猜想丙设计了图2所示的实验装置:小英另取适量NaHCO3粉末加入a试管中,
NaHCO3和水反应产生二氧化碳
NaHCO3能与酸反应
加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。b试管中反应的化学方程式为
_________________________________________。
持续加热直至两支试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末,向该粉末中滴加稀盐酸,有CO2产生,说明该粉末是_______。
【实验小结】NaHCO3在发酵粉中产生CO2的条件是_______;NaHCO3受热发生变化的化学方程式为
__________________________________。
Na2CO3
加热
△
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象。
碳酸钠溶液+澄清石灰水
现象
分析
实验11-2
碳酸钠溶液+澄清石灰水
现象
分析
出现白色沉淀
可溶性碳酸盐和石灰水反应产生白色沉淀
工业制取烧碱的反应
本节课我们主要学习了:
1.碳酸钠、碳酸氢钠和碳酸钙等几种常见的盐在生活中的重要用途,以及在自然界中的分布。
2.碳酸根离子或碳酸氢根离子的检验方法:
①加稀盐酸,产生气泡;
②气体通入澄清石灰水,变浑浊。
课堂教学展示
课堂小结
1.解释下述现象。
(1)鸡蛋壳的主要成分是碳酸钙。将一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。
练习与应用(P78)
课后反馈总结
课本习题
解:1.(1)当鸡蛋放入盛有足量稀盐酸的玻璃杯中时,其主要成分碳酸钙就和盐酸反应生成二氧化碳气体,产生气泡。此时反应刚开始,鸡蛋的重力大于浮力,所以鸡蛋一边冒气泡一边沉到杯底;随着反应的进行,生成的二氧化碳气体附着在蛋壳表面上,浮力不断增大;当浮力大于重力时,鸡蛋慢慢上浮;当鸡蛋上浮到接近液面时,二氧化碳气体不断逸出进入空气中,使浮力小于重力,因此鸡蛋又下沉。如此不断循环反复,直至反应结束,鸡蛋沉入液面下。
(2)馒头、面包等发面食品的一个特点是面团中有许多小孔(如右图),它们使发面食品松软可口。根据发酵粉(含碳酸氢钠和有机酸等)可与面粉、水混合直接制作发面食品的事实,说明碳酸氢钠在其中的作用。
解:(2)NaHCO3和有机酸溶于水后,在蒸食品过程中生成CO2气体,使食品松软可口。
6.氯化钠在生活、生产中的用途非常广泛。请通过查阅报纸、书刊、网络和访谈等,了解氯化钠的用途,并以“氯化钠的妙用”为题编制资料卡片。
解:氯化钠的妙用
①医疗:生理盐水是0.9%的NaCl溶液;
②农业生产:用氯化钠溶液选种;
③生活:用食盐腌制蔬菜、鱼、肉、蛋等;
④交通:用氯化钠消除公路上的积雪;
⑤化工生产:以NaCl为原料制取Na2CO3、NaOH、Cl2、盐酸等。
同课章节目录
