初中化学九年级下鲁教版 常见金属材料 导学案
文档属性
| 名称 | 初中化学九年级下鲁教版 常见金属材料 导学案 |

|
|
| 格式 | zip | ||
| 文件大小 | 53.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-03-11 00:00:00 | ||
图片预览

文档简介
常见金属元素导学案
一、学习目标:
学习目标:1、知道常见金属的物理性质,能运用相关性质解决实际问题。
2、掌握合金的定义及种类,能理解合金性质的优越性
3、知道常见的铁矿石,炼铁的原理和装置,及实验装置中需要注意的问题,并由此掌握氢气还原氧化铜的步骤。
4、了解氧化还原反应,会判断氧化剂与还原剂。
二、学习重点及难点:
学习重点与难点:
(1)重点:铁矿石炼铁的原理及装置
(2)难点:能从熟悉的化学反应中判断氧化、还原剂
三、学法指导:课本导学、小组合作、
四、导学过程:
(一)基础知识回顾(阅读教材,复习旧知)
一、常见的金属材料
1、金属的物理性质
1)大多数金属具有金属光泽,呈 色,但铜呈 色,金呈 色。
2)常温下大多为固体,但 是液体。
3)金属具有良好的 性、 性和 性,密度和硬度 ,熔沸点 ,但这些物理性质差别较大。
2多识一点:
1.熔点最高的金属 ; 2、.熔点最低的金属 ; 3、.硬度最大的金属 ; 4.产量最高的金属 ; 6.地壳中含量最高的金属元素 ; 7人体中含量最高的金属元素 ;8.海水中含量最高的金属元素 。
3、合金
1)概念:在一种金属中加热熔合其它 或 而形成的具有 的性质。
注:a、合金是混合物;b、合金中至少含有一种金属;c、合金一定具有金属的性能。
2)性质特性:合金的很多性能与组成它们的纯金属不同,合金的强度和硬度一般比它们的纯金属 ,抗腐蚀性能 ,合金的熔点一般 它们所含纯金属的熔点。
3)合金与纯金属性质存在差异的原因:金属在熔合了其它 后不仅 发生了变化,其 也发生改变,从而引起性质的变化。
4)常见合金
生铁:2%~4% 青铜:铜锡合金
铁合金 铜合金 铝合金、钛合金等。
钢:0.03%~2% 黄铜: 铜锌合金
二、常见金属的冶炼
1、炼铁的原理
1)常见的铁矿石:赤铁矿 、磁铁矿 、菱铁矿 、黄铁矿
,其中 、 因含铁量高,有害元素少,可用来炼铁。
2)铁的冶炼
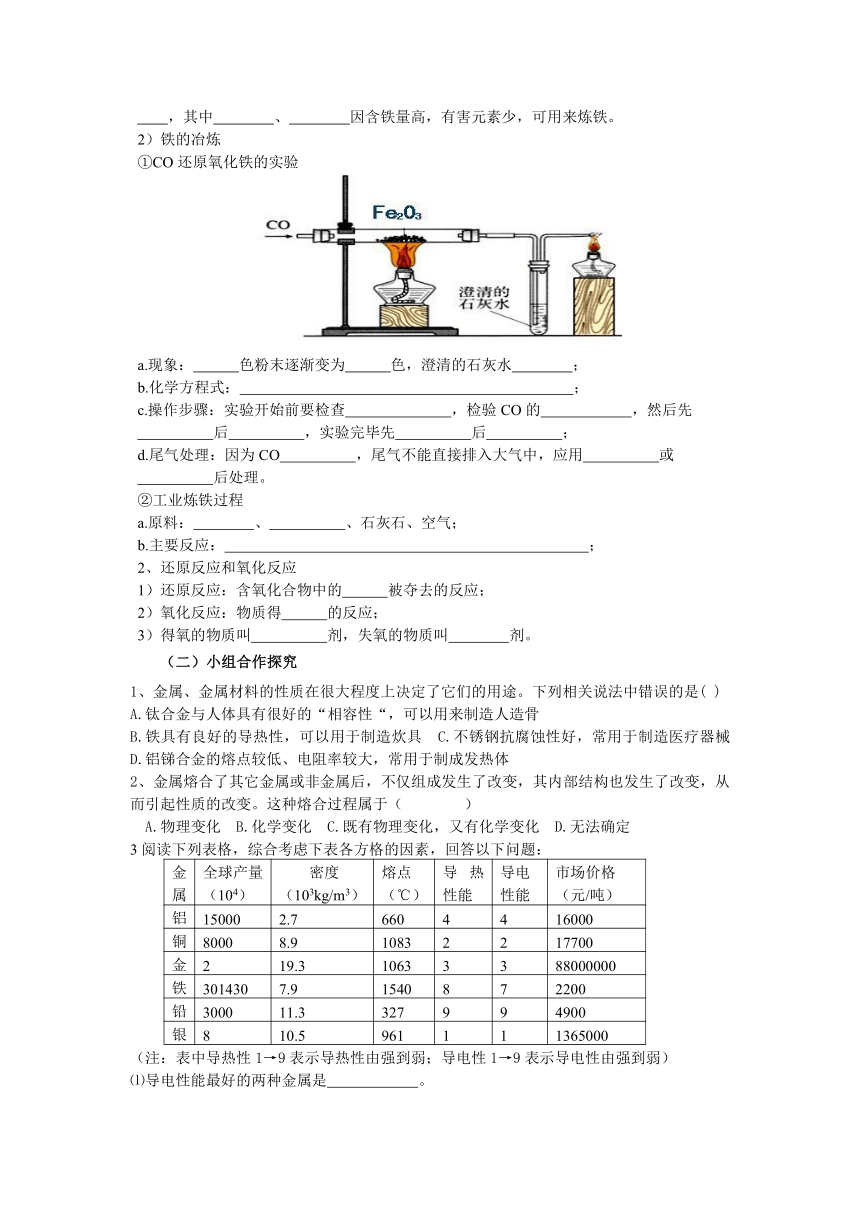
①CO还原氧化铁的实验
a.现象: 色粉末逐渐变为 色,澄清的石灰水 ;
b.化学方程式: ;
c.操作步骤:实验开始前要检查 ,检验CO的 ,然后先
后 ,实验完毕先 后 ;
d.尾气处理:因为CO ,尾气不能直接排入大气中,应用 或
后处理。
②工业炼铁过程
a.原料: 、 、石灰石、空气;
b.主要反应: ;
2、还原反应和氧化反应
1)还原反应:含氧化合物中的 被夺去的反应;
2)氧化反应:物质得 的反应;
3)得氧的物质叫 剂,失氧的物质叫 剂。
(二)小组合作探究
1、金属、金属材料的性质在很大程度上决定了它们的用途。下列相关说法中错误的是( )
A.钛合金与人体具有很好的“相容性“,可以用来制造人造骨
B.铁具有良好的导热性,可以用于制造炊具 C.不锈钢抗腐蚀性好,常用于制造医疗器械 D.铝锑合金的熔点较低、电阻率较大,常用于制成发热体
2、金属熔合了其它金属或非金属后,不仅组成发生了改变,其内部结构也发生了改变,从而引起性质的改变。这种熔合过程属于( )
A.物理变化 B.化学变化 C.既有物理变化,又有化学变化 D.无法确定
3阅读下列表格,综合考虑下表各方格的因素,回答以下问题:
金属 全球产量(104) 密度(103kg/m3) 熔点(℃) 导热性能 导电性能 市场价格(元/吨)
铝 15000 2.7 660 4 4 16000
铜 8000 8.9 1083 2 2 17700
金 2 19.3 1063 3 3 88000000
铁 301430 7.9 1540 8 7 2200
铅 3000 11.3 327 9 9 4900
银 8 10.5 961 1 1 1365000
(注:表中导热性1→9表示导热性由强到弱;导电性1→9表示导电性由强到弱)
⑴导电性能最好的两种金属是 。
⑵在你认为导电性能好的金属中,哪种更适宜作导线? 。为什么? 。
⑶为什么用铝锅炒菜时锅底易产生变形,而用铁锅则不会? 。
(三)课堂练习
1、氧化银纽扣电池常用于手表和计算器,总反应可表示为Zn+Ag2O=ZnO+2Ag,在该反应中( )A.发生了置换反应 B.银由+2价变为0价 C.锌发生了还原反应 D.Ag2O起还原剂作用
2、钢铁是使用最多的金属材料。
⑴早在春秋战国时期,我国就开始生产和使用铁器。写出以赤铁矿(Fe2O3)为原料炼铁的化学方程式 ;
⑵利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢的 (填序号)。
A.耐腐蚀性 B.延展性 C.导热性 D.导电性
⑶市场上有一种含铁粉的麦片,食用后在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。这种麦片必须真空保存,原因是 。
1、下列物质中,不属于合金的是( )A.水银 B.青铜 C.18K白金 D.焊锡
2、焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是( )
A.增加强度 B.降低熔点 C.增加延展性 D.增强抗腐蚀性
4、炼铁厂高炉炼铁的原料有赤铁矿、焦炭、空气等,主要反应过程如下:
⑴请在上述方框中写出有关的反应物或生成物的名称。
⑵焦炭的作用是:a. ,反应的方程式为: ;
b. ,反应的方程式为: 。
(四)课堂反馈
1、某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如图所示。请回答有关问题:
⑴为避免一氧化碳污染空气并回收利用一氧化碳,方框中连接的是C和D,导管接口的连接顺序为a→( )→( )→( )。C装置中NaOH的作用是 。
⑵实验开始时,应先 后 ,目的是 。
⑶实验进行一段时间后,玻璃管A中出现的现象为 ,反应方程式为 。
⑷除CO外,还有哪些物质可以还原Fe2O3: (填化学式)。
2、已知某金属X有下列相关信息:①它的主要矿物的化学成分是X2O3②它主要通过热还原法冶炼而成③它的年产量位于金属之首。
⑴据此推断X是 (填选项字母)。A.钛 B.铁 C.铝 D.铜
⑵高炉中用含X2O3的矿物冶炼该金属的原理是 (化学方程式)
⑶同学们设计了如下实验方案测定该矿物中X2O3的质量分数(装置气密性良好;矿物中的杂质不参加反应;假设矿物样品中的X2O3完全反应):
①取矿物样品并称量该样品的质量;②测出反应前广口瓶和瓶内物质总质量;
③测出反应后广口瓶和瓶内物质总质量;④计算得出矿物样品中X2O3的质量分数。
你认为该实验方案 (填“一定”或“不一定”)能准确测出矿物中X2O3的质量分数,理由是 。不改变装置和药品,你还可以通过测定哪些数据,再通过计算得出矿物中X2O3的质量分数:
从环保角度看,该装置的不足之处是
过量空气,高温
碳,高温
铁矿石,高温
一、学习目标:
学习目标:1、知道常见金属的物理性质,能运用相关性质解决实际问题。
2、掌握合金的定义及种类,能理解合金性质的优越性
3、知道常见的铁矿石,炼铁的原理和装置,及实验装置中需要注意的问题,并由此掌握氢气还原氧化铜的步骤。
4、了解氧化还原反应,会判断氧化剂与还原剂。
二、学习重点及难点:
学习重点与难点:
(1)重点:铁矿石炼铁的原理及装置
(2)难点:能从熟悉的化学反应中判断氧化、还原剂
三、学法指导:课本导学、小组合作、
四、导学过程:
(一)基础知识回顾(阅读教材,复习旧知)
一、常见的金属材料
1、金属的物理性质
1)大多数金属具有金属光泽,呈 色,但铜呈 色,金呈 色。
2)常温下大多为固体,但 是液体。
3)金属具有良好的 性、 性和 性,密度和硬度 ,熔沸点 ,但这些物理性质差别较大。
2多识一点:
1.熔点最高的金属 ; 2、.熔点最低的金属 ; 3、.硬度最大的金属 ; 4.产量最高的金属 ; 6.地壳中含量最高的金属元素 ; 7人体中含量最高的金属元素 ;8.海水中含量最高的金属元素 。
3、合金
1)概念:在一种金属中加热熔合其它 或 而形成的具有 的性质。
注:a、合金是混合物;b、合金中至少含有一种金属;c、合金一定具有金属的性能。
2)性质特性:合金的很多性能与组成它们的纯金属不同,合金的强度和硬度一般比它们的纯金属 ,抗腐蚀性能 ,合金的熔点一般 它们所含纯金属的熔点。
3)合金与纯金属性质存在差异的原因:金属在熔合了其它 后不仅 发生了变化,其 也发生改变,从而引起性质的变化。
4)常见合金
生铁:2%~4% 青铜:铜锡合金
铁合金 铜合金 铝合金、钛合金等。
钢:0.03%~2% 黄铜: 铜锌合金
二、常见金属的冶炼
1、炼铁的原理
1)常见的铁矿石:赤铁矿 、磁铁矿 、菱铁矿 、黄铁矿
,其中 、 因含铁量高,有害元素少,可用来炼铁。
2)铁的冶炼
①CO还原氧化铁的实验
a.现象: 色粉末逐渐变为 色,澄清的石灰水 ;
b.化学方程式: ;
c.操作步骤:实验开始前要检查 ,检验CO的 ,然后先
后 ,实验完毕先 后 ;
d.尾气处理:因为CO ,尾气不能直接排入大气中,应用 或
后处理。
②工业炼铁过程
a.原料: 、 、石灰石、空气;
b.主要反应: ;
2、还原反应和氧化反应
1)还原反应:含氧化合物中的 被夺去的反应;
2)氧化反应:物质得 的反应;
3)得氧的物质叫 剂,失氧的物质叫 剂。
(二)小组合作探究
1、金属、金属材料的性质在很大程度上决定了它们的用途。下列相关说法中错误的是( )
A.钛合金与人体具有很好的“相容性“,可以用来制造人造骨
B.铁具有良好的导热性,可以用于制造炊具 C.不锈钢抗腐蚀性好,常用于制造医疗器械 D.铝锑合金的熔点较低、电阻率较大,常用于制成发热体
2、金属熔合了其它金属或非金属后,不仅组成发生了改变,其内部结构也发生了改变,从而引起性质的改变。这种熔合过程属于( )
A.物理变化 B.化学变化 C.既有物理变化,又有化学变化 D.无法确定
3阅读下列表格,综合考虑下表各方格的因素,回答以下问题:
金属 全球产量(104) 密度(103kg/m3) 熔点(℃) 导热性能 导电性能 市场价格(元/吨)
铝 15000 2.7 660 4 4 16000
铜 8000 8.9 1083 2 2 17700
金 2 19.3 1063 3 3 88000000
铁 301430 7.9 1540 8 7 2200
铅 3000 11.3 327 9 9 4900
银 8 10.5 961 1 1 1365000
(注:表中导热性1→9表示导热性由强到弱;导电性1→9表示导电性由强到弱)
⑴导电性能最好的两种金属是 。
⑵在你认为导电性能好的金属中,哪种更适宜作导线? 。为什么? 。
⑶为什么用铝锅炒菜时锅底易产生变形,而用铁锅则不会? 。
(三)课堂练习
1、氧化银纽扣电池常用于手表和计算器,总反应可表示为Zn+Ag2O=ZnO+2Ag,在该反应中( )A.发生了置换反应 B.银由+2价变为0价 C.锌发生了还原反应 D.Ag2O起还原剂作用
2、钢铁是使用最多的金属材料。
⑴早在春秋战国时期,我国就开始生产和使用铁器。写出以赤铁矿(Fe2O3)为原料炼铁的化学方程式 ;
⑵利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢的 (填序号)。
A.耐腐蚀性 B.延展性 C.导热性 D.导电性
⑶市场上有一种含铁粉的麦片,食用后在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。这种麦片必须真空保存,原因是 。
1、下列物质中,不属于合金的是( )A.水银 B.青铜 C.18K白金 D.焊锡
2、焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是( )
A.增加强度 B.降低熔点 C.增加延展性 D.增强抗腐蚀性
4、炼铁厂高炉炼铁的原料有赤铁矿、焦炭、空气等,主要反应过程如下:
⑴请在上述方框中写出有关的反应物或生成物的名称。
⑵焦炭的作用是:a. ,反应的方程式为: ;
b. ,反应的方程式为: 。
(四)课堂反馈
1、某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如图所示。请回答有关问题:
⑴为避免一氧化碳污染空气并回收利用一氧化碳,方框中连接的是C和D,导管接口的连接顺序为a→( )→( )→( )。C装置中NaOH的作用是 。
⑵实验开始时,应先 后 ,目的是 。
⑶实验进行一段时间后,玻璃管A中出现的现象为 ,反应方程式为 。
⑷除CO外,还有哪些物质可以还原Fe2O3: (填化学式)。
2、已知某金属X有下列相关信息:①它的主要矿物的化学成分是X2O3②它主要通过热还原法冶炼而成③它的年产量位于金属之首。
⑴据此推断X是 (填选项字母)。A.钛 B.铁 C.铝 D.铜
⑵高炉中用含X2O3的矿物冶炼该金属的原理是 (化学方程式)
⑶同学们设计了如下实验方案测定该矿物中X2O3的质量分数(装置气密性良好;矿物中的杂质不参加反应;假设矿物样品中的X2O3完全反应):
①取矿物样品并称量该样品的质量;②测出反应前广口瓶和瓶内物质总质量;
③测出反应后广口瓶和瓶内物质总质量;④计算得出矿物样品中X2O3的质量分数。
你认为该实验方案 (填“一定”或“不一定”)能准确测出矿物中X2O3的质量分数,理由是 。不改变装置和药品,你还可以通过测定哪些数据,再通过计算得出矿物中X2O3的质量分数:
从环保角度看,该装置的不足之处是
过量空气,高温
碳,高温
铁矿石,高温
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
