化学人教版(2019)必修第二册5.1.1..硫与二氧化硫(共40张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.1..硫与二氧化硫(共40张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 18.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-07 11:42:56 | ||
图片预览








文档简介
(共40张PPT)
硫及其重要化合物
思考与讨论
1.画出硫的原子结构示意图并指出硫在元素周期表中的位置?
第三周期、第ⅥA族?
2.根据硫在周期表中的位置推测硫的化学性质?(分别与O和Cl进行比较)
①非金属性较强,单质具有氧化性,能跟活泼金属,一些非金属单质发生氧化还原反应。
S
+16
2
8
6
②非金属性小于同周期的氯,单质的氧化性小于氯气。非金属性小于同主族的氧,故其氧化物中硫显正价,氧显-2价。
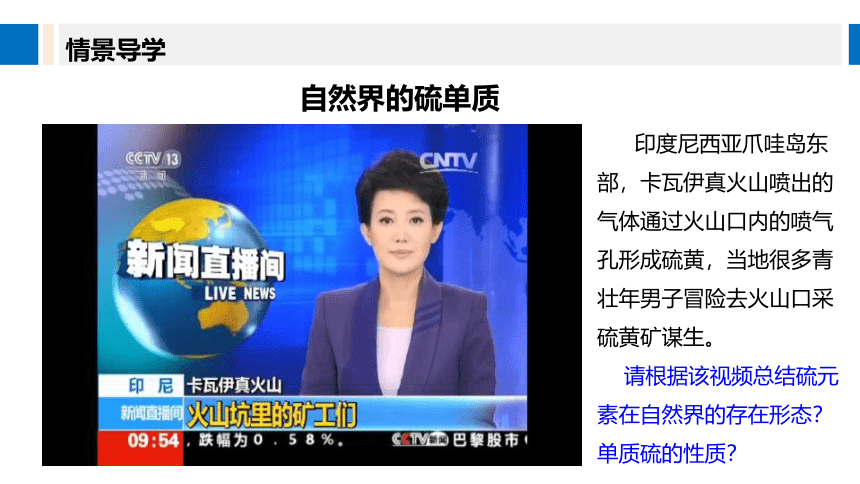
情景导学
自然界的硫单质
印度尼西亚爪哇岛东部,卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫黄,当地很多青壮年男子冒险去火山口采硫黄矿谋生。
请根据该视频总结硫元素在自然界的存在形态?单质硫的性质?
硫元素的存在
Δ 游离态:火山喷口附近或地壳的岩层里
Δ 化合态:主要以硫化物或硫酸盐形式存在
Δ 硫还是组成某些蛋白质的生命元素
一、硫单质
1.物理性质
黄色晶体,不溶于水,微溶于酒精,易溶于CS2
应用:可用CS2洗去粘在试管内壁的硫单质。
S
+6
S既有氧化性,又有还原性
S
0
S
-2
S
+4
思考:根据硫元素的化合价,推断S具有怎样的性质?
2、化学性质:
(1)与非金属的反应:
(现象:淡蓝色火焰)。
若在纯氧中燃烧现象:
(2)可与大多数金属化合:
Fe+S==FeS
Δ
与变价金属反应时,一般生成低价
(3)可与热的氢氧化钠溶液反应:
6NaOH+3S== Na2SO3+2Na2S+H2O
Δ
应用:可用热的氢氧化钠溶液洗去粘在试管内壁的硫单质。
注:氧气充足也只生成SO2
生成明亮的蓝紫色火焰。
Cu+S==Cu2S
Δ
(氧化性)
在空气中燃烧:
与氢气反应:
还原性
(氧化性)
氧化性与还原性
H2+S==H2S
Δ
3、硫的用途
(1)消除汞蒸气:实验室里不慎洒落一些汞,可撒上硫粉处理
(2)制黑火药:“一硫二硝三木炭”
S+2KNO3+3C=K2S+N2↑+3CO2↑
S+Hg == HgS
(3)制制造硫酸、化肥、农药、火药等,还可用于制造硫化橡胶。
练习应用
1.下列化合物能用相应的单质直接化合制得的是( )
①CuS ②FeS ③HCl ④SO2 ⑤SO3 ⑥FeCl2 ⑦CuCl2
A.①②③④⑤⑥⑦ B.①②③④⑦
C.②③⑤⑦ D.②③④⑦
D
二.二氧化硫的物理性质:
1.无色、有刺激性气味、有毒气体
2.比空气密度大
3.易溶于水
(1体积水溶解40体积SO2)
4.易液化(101KPa沸点是-10℃)
(NH3溶于水1:700 )
(HCl 溶于水1:500 )
思考:请设计一个实验来证明SO2易溶于水?
实验5-1:
PH<7
SO2具有酸性氧化物通性
——从物质分类的角度
与碱性氧化物反生成盐
与碱反应生成盐和水
与H2O反应生成酸
酸性氧化物
SO2 + H2O
逆反应
H2SO3
正反应
2、 二氧化硫的化学性质
① 与水反应
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
思 考
2H2O 通电 2H2↑ +O2 ↑ 与 2H2+O2 点燃 2H2O
是可逆反应吗?
(亚硫酸)
(1)酸性氧化物的通性
酸性:H2SO3(中强酸)> H2CO3(弱酸)
2H2SO3+O2=2H2SO4
这种酸雨在放置一段时间后酸性会增强。
可逆反应的特点:
1、同一条件。
2、反应物、生成物同时存在。
④与盐的反应:
SO2+ Na2SO3 + H2O = 2NaHSO3
③与碱性氧化物的反应:
SO2+Na2O = Na2SO3
SO2 +CaO = CaSO3
SO2+2NaOH=Na2SO3 + H2O
②与碱的反应:
SO2+Ca(OH)2=CaSO3↓+ H2O
SO2、CO2也能使澄清石灰水变浑浊.
总结:作为酸性氧化物,其性质与二氧化碳相同。
SO2+ NaHCO3 + H2O = NaHSO3+CO2
应用:用饱和的NaHCO3 溶液除去CO2中的SO2
S
+6
SO2既有氧化性,又有还原性
思考:根据硫元素的化合价,
推断SO2还具有怎样的性质?
S
S
0
-2
S
+4
2、强还原性
SO2 +Cl2+2H2O=H2SO4 +2HCl
3、弱氧化性:
2H2S+SO2 ==3S↓ +2H2O
2SO2 + O2 2SO3
催化剂
Δ
4.SO2的漂白性:
SO2的漂白作用是SO2跟有色物质化合生成一种无色的不稳定化合物。
——化合漂白
实验现象:品红溶液褪色加热,又恢复原来的颜色。
漂白原理:
5SO2+2KMnO4+2H2O===K2SO4 + 2MnSO4+2H2SO4
SO2+H2O2=H2SO4
漂白性:
某些有机色素+SO2
△
无色的物质
SO2能使所有有颜色的东西漂白吗?
SO2能使酸性KMnO4溶液褪色,是因为其漂白性吗?如何用实验加以证明?
特点:具有可逆性
注:不能漂白酸碱指示剂
能使品红溶液褪色的气体一定为SO2?
SO2的检验:通入品红溶液褪色,加热后又恢复原色。
Cl2、O3等
不是,
加热是否复原
除了SO2,还有哪些物质具有漂白性?
它们的漂白原理有何不同?
HClO 、 NaClO 、Na2O2 、 O3 、H2O2 —— 氧化漂白
活性炭 ——— 吸附漂白
SO2—— 化合漂白
漂白原理的比较:
利用其强氧化性,破坏有机色素的结构,达到永久漂白的目的。
多孔,疏松,表面积大,吸附力强。
和某些有机色素结合,生成不稳定的无色物质。故加热后又显红色,是由于又分解为原来的物质的缘故。不彻底的,可逆的.
不可逆的,化学变化
物理变化
可逆的、化学变化
3、二氧化硫的实验室制取
装置:圆底烧瓶,分液漏斗
收集方法:向上排空气法
检验:使品红溶液褪色
思
考
为什么用70%的硫酸制取二氧化硫?
因SO2易溶于水,用稀硫酸不利于SO2逸出;太浓H+浓度太小,反应速率太慢。
尾气处理:使用氢氧化钠溶液吸收
Na2SO3(s) + H2SO4 (浓)= Na2SO4 + SO2↑+H2O
SO2的用途
杀菌、消毒、
干果防腐剂
制造硫酸
漂白纸浆、
毛、丝、
草帽
食品添加剂
例如:二氧化硫在葡萄酒果汁中可以杀菌、抗氧化防腐的作用。
小结:
SO2
与CaO等反应
与碱反应
还原性
氧化性
酸性
氧化物
+4价
漂白性、毒性
特 性
杀菌、防腐、漂白、制硫酸
与水反应
用 途
小结 : SO2和CO2的异同点
(1)均为酸酐:酸性:H2SO3>H2CO3
(2)均有氧化性:
均能使澄清石灰水变浑浊,继续通入气体溶液又澄清
SO2 + Ca(OH)2 =CaSO3↓+H2O;SO2 +H2O+ CaSO3= Ca(HSO3)2
CO2 + Ca(OH)2 =CaCO3↓+H2O;CO2 +H2O+ CaCO3= Ca(HCO3)2
(3)SO2具有还原性,能使Cl2水、Br2水、I2水、KMnO4等溶液褪色
(4)SO2具有漂白性
深度思考
2.怎样除去CO2中的SO2
3.二氧化硫通入BaCl2溶液中是否能生成沉淀?若不能请想出生成沉淀的方法?
①若生成BaSO3沉淀可加入试剂________________________
②若生成BaSO4沉淀可加入试剂________________________
氨水或氢氧化钠等碱性溶液
氯水、双氧水等强氧化剂溶液
②通过高锰酸钾溶液洗气瓶
①通过饱和NaHCO3溶液洗气瓶
1.如何鉴别CO2与SO2
①澄清石灰水:无色无味能使其变浑浊的为CO2;无色有刺激性气味能使其变浑浊的为SO2
②高锰酸钾溶液/溴水
③品红溶液
1、指出下列反应或现象中,SO2所体现的性质:
(1)
(2)SO2+2H2S=3S+2H2O
(3)SO2+Cl2+2H2O=2HCl+H2SO4
(4)SO2使品红溶液褪色
(5)SO2使酸性高锰酸钾溶液褪色
(6)SO2使紫色石蕊试液变红色
2SO2 + O2 2 SO3
催化剂
△
还原性
[巩固训练题]
氧化性
还原性
漂白性
还原性
水溶液呈酸性
[练习]
2、下列物质:① NaOH;②氯水;③空气;④氢硫酸⑤Na2SO3;⑥Na2CO3;其中能与SO2在一定条件下发生反应的是( )
A. ①②④⑤ B. ②④⑤⑥ C. ②③④⑥ D. 全部
3、下列四种有色溶液与SO2作用,均能褪色,①品红溶液;②酸性高锰酸钾溶液;③溴水;④滴有酚酞的NaOH溶液,其实质相同的是
A. ①④ B. ①②③ C. ②③④ D. ②③
√
√
√
5、能用来鉴别SO2和CO2的溶液是( )
A、澄清石灰水 B、品红溶液
C、酚酞试液 D、Ba(OH)2溶液
B
4、下列反应中通入的气体只做氧化剂的是( ) A、SO2通入H2S溶液中 B、Cl2通入NaOH溶液中 C、SO2通入KOH溶液中 D、H2S通入溴水中
A
澄清
石灰水
品红溶液
KMnO4
溶液
紫色石蕊试液
NaOH溶液
SO2
6、将SO2依次通过下列实验装置,说出A、B、C、D各装置中的实验现象。
A B C D
褪色 褪色 红色
先浑浊
后澄清
7、如何检验某混合气体中含有SO2和CO2?
SO2、CO2
澄清
石灰水
品红溶液
KMnO4
溶液
品红溶液
NaOH溶液
褪色 褪色 不褪色
先浑浊
后澄清
总结提升
SO2和CO2混合气体的检验
流程设计 检验SO2→除去SO2→检验SO2是否除尽→检验CO2 试剂及装置 实验现象 混合气体中含有SO2 装置A中的品红溶液褪色。
混合气体中含有CO2 装置C中的品红溶液不褪色,装置D中的澄清石灰水变浑浊。
8、Cl2和SO2遇水都具有漂白作用,若将等物质的量的这两种气体混合后通入足量水中,向其中加入品红和BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.①③ C.②③ D.②④
c
9、氯化钡溶液中通入二氧化硫气体未见沉淀 ,若加入下列物质也不产生沉淀的是( )
A、NaOH B、H2S C、Cl2 D、 H2O
D
注意:将等物质的量的SO2和Cl2同时通入水中,二者发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,从而失去漂白效果。
10、某学生利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。
溶有SO2的品红
SO2气体逸出,品红恢复红色
SO2 + 2 H2S = 3 S + 2 H2O
5、二氧化硫对环境的污染
(1)直接危害人体引起呼吸道疾病,严重 时还会使人死亡。
(2)污染大气形成酸雨。
酸雨通常是指pH值小于5.6的降水,是大气污染现象之一。首先用酸雨这个名词的人是英国化化学家史密斯。1852年,他发现在工业化城市曼彻斯特上空的烟尘污染与雨水的酸性有一定关系,报道过该地区的雨水呈酸性,并于1872年编著的科学著作中首先采用了“酸雨”这一术语。
什么是酸雨
酸雨的危害
(1)危害人的身体健康。
(2)危害树木等植物。
(3)使土壤、河水酸化。
(4)腐蚀文物古迹、金属、建筑物。
酸雨的防护:
(1)减少含硫物的燃烧。
(2)工业废气、废水先处理后排放。
SO3
三氧化硫
SO3常温下是无色固体(或晶体), 熔点(16.8℃)和沸点(44.8℃) 都比较低。
SO3 也是酸酐,是酸性氧化物
△
2SO2 + O2 2SO3
催化剂
思考:1mol SO3所占的体积为22.4L?
(1)与水的反应
SO3+H2O=H2SO4
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O
(2)与碱性氧化物的反应
(3)与碱的反应
不是
练习应用
1.下列有关三氧化硫的说法中,正确的是 ( )
A.三氧化硫极易溶于水,且与水反应生成H2SO4
B.标准状况下,1 mol SO3的体积约为22.4 L
C.硫粉在过量的氧气中燃烧可以生成SO3
D.SO2、SO3均具有漂白性,二者都能使石蕊溶液褪色
A
硫及其重要化合物
思考与讨论
1.画出硫的原子结构示意图并指出硫在元素周期表中的位置?
第三周期、第ⅥA族?
2.根据硫在周期表中的位置推测硫的化学性质?(分别与O和Cl进行比较)
①非金属性较强,单质具有氧化性,能跟活泼金属,一些非金属单质发生氧化还原反应。
S
+16
2
8
6
②非金属性小于同周期的氯,单质的氧化性小于氯气。非金属性小于同主族的氧,故其氧化物中硫显正价,氧显-2价。
情景导学
自然界的硫单质
印度尼西亚爪哇岛东部,卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫黄,当地很多青壮年男子冒险去火山口采硫黄矿谋生。
请根据该视频总结硫元素在自然界的存在形态?单质硫的性质?
硫元素的存在
Δ 游离态:火山喷口附近或地壳的岩层里
Δ 化合态:主要以硫化物或硫酸盐形式存在
Δ 硫还是组成某些蛋白质的生命元素
一、硫单质
1.物理性质
黄色晶体,不溶于水,微溶于酒精,易溶于CS2
应用:可用CS2洗去粘在试管内壁的硫单质。
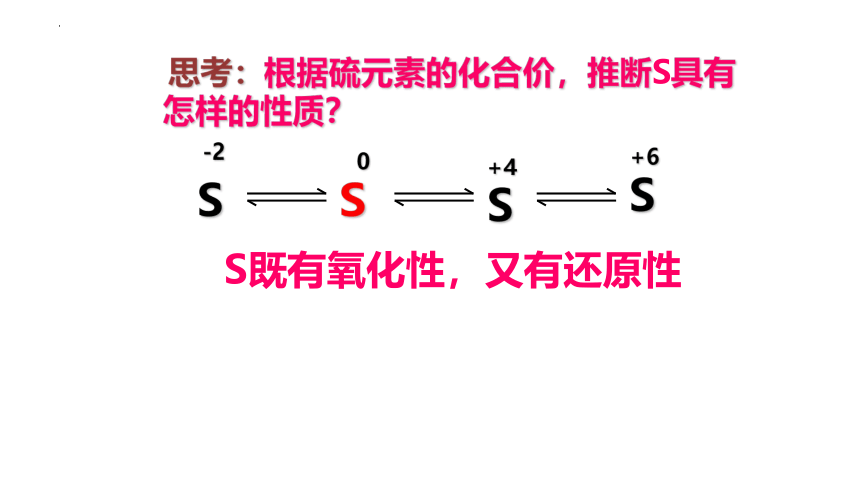
S
+6
S既有氧化性,又有还原性
S
0
S
-2
S
+4
思考:根据硫元素的化合价,推断S具有怎样的性质?
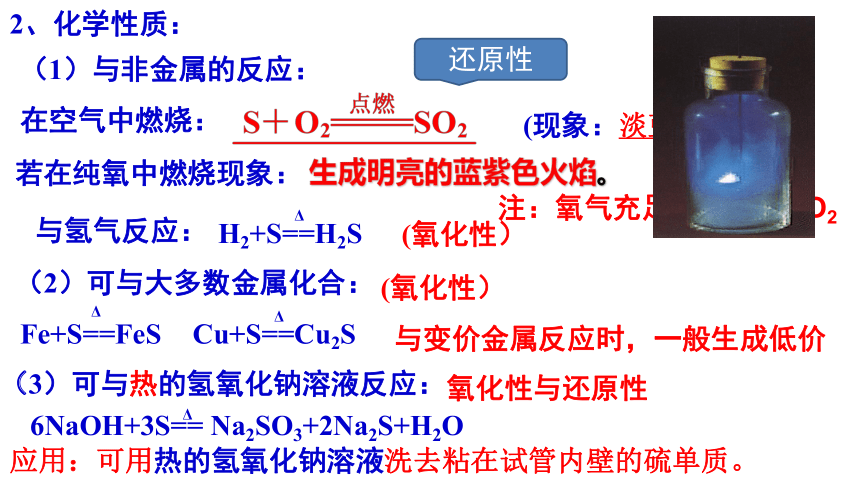
2、化学性质:
(1)与非金属的反应:
(现象:淡蓝色火焰)。
若在纯氧中燃烧现象:
(2)可与大多数金属化合:
Fe+S==FeS
Δ
与变价金属反应时,一般生成低价
(3)可与热的氢氧化钠溶液反应:
6NaOH+3S== Na2SO3+2Na2S+H2O
Δ
应用:可用热的氢氧化钠溶液洗去粘在试管内壁的硫单质。
注:氧气充足也只生成SO2
生成明亮的蓝紫色火焰。
Cu+S==Cu2S
Δ
(氧化性)
在空气中燃烧:
与氢气反应:
还原性
(氧化性)
氧化性与还原性
H2+S==H2S
Δ
3、硫的用途
(1)消除汞蒸气:实验室里不慎洒落一些汞,可撒上硫粉处理
(2)制黑火药:“一硫二硝三木炭”
S+2KNO3+3C=K2S+N2↑+3CO2↑
S+Hg == HgS
(3)制制造硫酸、化肥、农药、火药等,还可用于制造硫化橡胶。
练习应用
1.下列化合物能用相应的单质直接化合制得的是( )
①CuS ②FeS ③HCl ④SO2 ⑤SO3 ⑥FeCl2 ⑦CuCl2
A.①②③④⑤⑥⑦ B.①②③④⑦
C.②③⑤⑦ D.②③④⑦
D
二.二氧化硫的物理性质:
1.无色、有刺激性气味、有毒气体
2.比空气密度大
3.易溶于水
(1体积水溶解40体积SO2)
4.易液化(101KPa沸点是-10℃)
(NH3溶于水1:700 )
(HCl 溶于水1:500 )
思考:请设计一个实验来证明SO2易溶于水?
实验5-1:
PH<7
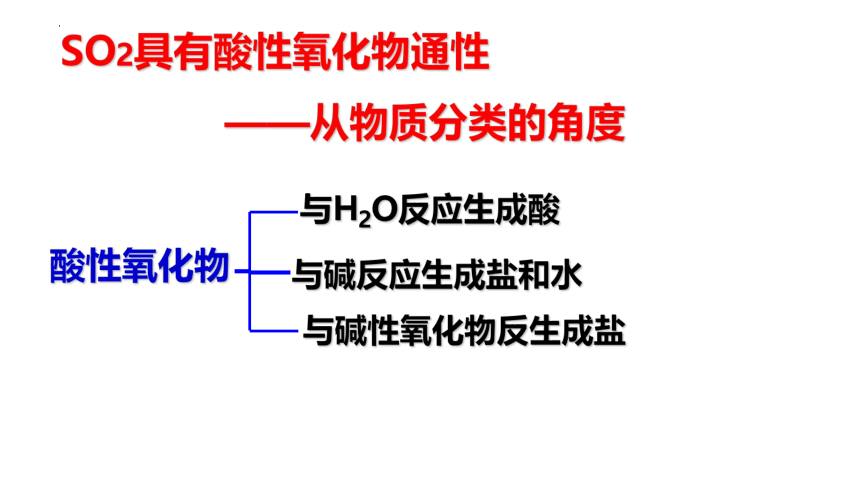
SO2具有酸性氧化物通性
——从物质分类的角度
与碱性氧化物反生成盐
与碱反应生成盐和水
与H2O反应生成酸
酸性氧化物
SO2 + H2O
逆反应
H2SO3
正反应
2、 二氧化硫的化学性质
① 与水反应
可逆反应:在相同条件下,既能向正反应方向进行、又能向逆反应方向进行的反应。
思 考
2H2O 通电 2H2↑ +O2 ↑ 与 2H2+O2 点燃 2H2O
是可逆反应吗?
(亚硫酸)
(1)酸性氧化物的通性
酸性:H2SO3(中强酸)> H2CO3(弱酸)
2H2SO3+O2=2H2SO4
这种酸雨在放置一段时间后酸性会增强。
可逆反应的特点:
1、同一条件。
2、反应物、生成物同时存在。
④与盐的反应:
SO2+ Na2SO3 + H2O = 2NaHSO3
③与碱性氧化物的反应:
SO2+Na2O = Na2SO3
SO2 +CaO = CaSO3
SO2+2NaOH=Na2SO3 + H2O
②与碱的反应:
SO2+Ca(OH)2=CaSO3↓+ H2O
SO2、CO2也能使澄清石灰水变浑浊.
总结:作为酸性氧化物,其性质与二氧化碳相同。
SO2+ NaHCO3 + H2O = NaHSO3+CO2
应用:用饱和的NaHCO3 溶液除去CO2中的SO2
S
+6
SO2既有氧化性,又有还原性
思考:根据硫元素的化合价,
推断SO2还具有怎样的性质?
S
S
0
-2
S
+4
2、强还原性
SO2 +Cl2+2H2O=H2SO4 +2HCl
3、弱氧化性:
2H2S+SO2 ==3S↓ +2H2O
2SO2 + O2 2SO3
催化剂
Δ
4.SO2的漂白性:
SO2的漂白作用是SO2跟有色物质化合生成一种无色的不稳定化合物。
——化合漂白
实验现象:品红溶液褪色加热,又恢复原来的颜色。
漂白原理:
5SO2+2KMnO4+2H2O===K2SO4 + 2MnSO4+2H2SO4
SO2+H2O2=H2SO4
漂白性:
某些有机色素+SO2
△
无色的物质
SO2能使所有有颜色的东西漂白吗?
SO2能使酸性KMnO4溶液褪色,是因为其漂白性吗?如何用实验加以证明?
特点:具有可逆性
注:不能漂白酸碱指示剂
能使品红溶液褪色的气体一定为SO2?
SO2的检验:通入品红溶液褪色,加热后又恢复原色。
Cl2、O3等
不是,
加热是否复原
除了SO2,还有哪些物质具有漂白性?
它们的漂白原理有何不同?
HClO 、 NaClO 、Na2O2 、 O3 、H2O2 —— 氧化漂白
活性炭 ——— 吸附漂白
SO2—— 化合漂白
漂白原理的比较:
利用其强氧化性,破坏有机色素的结构,达到永久漂白的目的。
多孔,疏松,表面积大,吸附力强。
和某些有机色素结合,生成不稳定的无色物质。故加热后又显红色,是由于又分解为原来的物质的缘故。不彻底的,可逆的.
不可逆的,化学变化
物理变化
可逆的、化学变化
3、二氧化硫的实验室制取
装置:圆底烧瓶,分液漏斗
收集方法:向上排空气法
检验:使品红溶液褪色
思
考
为什么用70%的硫酸制取二氧化硫?
因SO2易溶于水,用稀硫酸不利于SO2逸出;太浓H+浓度太小,反应速率太慢。
尾气处理:使用氢氧化钠溶液吸收
Na2SO3(s) + H2SO4 (浓)= Na2SO4 + SO2↑+H2O
SO2的用途
杀菌、消毒、
干果防腐剂
制造硫酸
漂白纸浆、
毛、丝、
草帽
食品添加剂
例如:二氧化硫在葡萄酒果汁中可以杀菌、抗氧化防腐的作用。
小结:
SO2
与CaO等反应
与碱反应
还原性
氧化性
酸性
氧化物
+4价
漂白性、毒性
特 性
杀菌、防腐、漂白、制硫酸
与水反应
用 途
小结 : SO2和CO2的异同点
(1)均为酸酐:酸性:H2SO3>H2CO3
(2)均有氧化性:
均能使澄清石灰水变浑浊,继续通入气体溶液又澄清
SO2 + Ca(OH)2 =CaSO3↓+H2O;SO2 +H2O+ CaSO3= Ca(HSO3)2
CO2 + Ca(OH)2 =CaCO3↓+H2O;CO2 +H2O+ CaCO3= Ca(HCO3)2
(3)SO2具有还原性,能使Cl2水、Br2水、I2水、KMnO4等溶液褪色
(4)SO2具有漂白性
深度思考
2.怎样除去CO2中的SO2
3.二氧化硫通入BaCl2溶液中是否能生成沉淀?若不能请想出生成沉淀的方法?
①若生成BaSO3沉淀可加入试剂________________________
②若生成BaSO4沉淀可加入试剂________________________
氨水或氢氧化钠等碱性溶液
氯水、双氧水等强氧化剂溶液
②通过高锰酸钾溶液洗气瓶
①通过饱和NaHCO3溶液洗气瓶
1.如何鉴别CO2与SO2
①澄清石灰水:无色无味能使其变浑浊的为CO2;无色有刺激性气味能使其变浑浊的为SO2
②高锰酸钾溶液/溴水
③品红溶液
1、指出下列反应或现象中,SO2所体现的性质:
(1)
(2)SO2+2H2S=3S+2H2O
(3)SO2+Cl2+2H2O=2HCl+H2SO4
(4)SO2使品红溶液褪色
(5)SO2使酸性高锰酸钾溶液褪色
(6)SO2使紫色石蕊试液变红色
2SO2 + O2 2 SO3
催化剂
△
还原性
[巩固训练题]
氧化性
还原性
漂白性
还原性
水溶液呈酸性
[练习]
2、下列物质:① NaOH;②氯水;③空气;④氢硫酸⑤Na2SO3;⑥Na2CO3;其中能与SO2在一定条件下发生反应的是( )
A. ①②④⑤ B. ②④⑤⑥ C. ②③④⑥ D. 全部
3、下列四种有色溶液与SO2作用,均能褪色,①品红溶液;②酸性高锰酸钾溶液;③溴水;④滴有酚酞的NaOH溶液,其实质相同的是
A. ①④ B. ①②③ C. ②③④ D. ②③
√
√
√
5、能用来鉴别SO2和CO2的溶液是( )
A、澄清石灰水 B、品红溶液
C、酚酞试液 D、Ba(OH)2溶液
B
4、下列反应中通入的气体只做氧化剂的是( ) A、SO2通入H2S溶液中 B、Cl2通入NaOH溶液中 C、SO2通入KOH溶液中 D、H2S通入溴水中
A
澄清
石灰水
品红溶液
KMnO4
溶液
紫色石蕊试液
NaOH溶液
SO2
6、将SO2依次通过下列实验装置,说出A、B、C、D各装置中的实验现象。
A B C D
褪色 褪色 红色
先浑浊
后澄清
7、如何检验某混合气体中含有SO2和CO2?
SO2、CO2
澄清
石灰水
品红溶液
KMnO4
溶液
品红溶液
NaOH溶液
褪色 褪色 不褪色
先浑浊
后澄清
总结提升
SO2和CO2混合气体的检验
流程设计 检验SO2→除去SO2→检验SO2是否除尽→检验CO2 试剂及装置 实验现象 混合气体中含有SO2 装置A中的品红溶液褪色。
混合气体中含有CO2 装置C中的品红溶液不褪色,装置D中的澄清石灰水变浑浊。
8、Cl2和SO2遇水都具有漂白作用,若将等物质的量的这两种气体混合后通入足量水中,向其中加入品红和BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.①③ C.②③ D.②④
c
9、氯化钡溶液中通入二氧化硫气体未见沉淀 ,若加入下列物质也不产生沉淀的是( )
A、NaOH B、H2S C、Cl2 D、 H2O
D
注意:将等物质的量的SO2和Cl2同时通入水中,二者发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,从而失去漂白效果。
10、某学生利用如图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。
溶有SO2的品红
SO2气体逸出,品红恢复红色
SO2 + 2 H2S = 3 S + 2 H2O
5、二氧化硫对环境的污染
(1)直接危害人体引起呼吸道疾病,严重 时还会使人死亡。
(2)污染大气形成酸雨。
酸雨通常是指pH值小于5.6的降水,是大气污染现象之一。首先用酸雨这个名词的人是英国化化学家史密斯。1852年,他发现在工业化城市曼彻斯特上空的烟尘污染与雨水的酸性有一定关系,报道过该地区的雨水呈酸性,并于1872年编著的科学著作中首先采用了“酸雨”这一术语。
什么是酸雨
酸雨的危害
(1)危害人的身体健康。
(2)危害树木等植物。
(3)使土壤、河水酸化。
(4)腐蚀文物古迹、金属、建筑物。
酸雨的防护:
(1)减少含硫物的燃烧。
(2)工业废气、废水先处理后排放。
SO3
三氧化硫
SO3常温下是无色固体(或晶体), 熔点(16.8℃)和沸点(44.8℃) 都比较低。
SO3 也是酸酐,是酸性氧化物
△
2SO2 + O2 2SO3
催化剂
思考:1mol SO3所占的体积为22.4L?
(1)与水的反应
SO3+H2O=H2SO4
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O
(2)与碱性氧化物的反应
(3)与碱的反应
不是
练习应用
1.下列有关三氧化硫的说法中,正确的是 ( )
A.三氧化硫极易溶于水,且与水反应生成H2SO4
B.标准状况下,1 mol SO3的体积约为22.4 L
C.硫粉在过量的氧气中燃烧可以生成SO3
D.SO2、SO3均具有漂白性,二者都能使石蕊溶液褪色
A
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
