安徽省安庆市桐城县中2022-2023学年高一上学期期末教学质量检测化学试题(含答案)
文档属性
| 名称 | 安徽省安庆市桐城县中2022-2023学年高一上学期期末教学质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 08:46:28 | ||
图片预览


文档简介
桐城县中2022-2023学年高一上学期期末教学质量检测
化学试卷
(时间:75分钟 满分:100分)
第Ⅰ卷选择题(共计44分)
相对原子质量:H:1 C:12 N:14 O:16 :23 :35.5 :56
一、单选题(12小题,每小题3分,共36分,每小题只有一个选项符合题意。)
1.2021年,我国科学家实现了到淀粉的人工合成,该成果可以将空气中的捕集,用于合成淀粉。下列说法正确的是( )
A.可以用检验合成的淀粉
B.属于酸性氧化物,属于电解质
C.该科研成果为实现“碳中和”提供一种新思路
D.该成果的产业化可缓解温室效应,有效遏制酸雨的产生
2.下列物质的用途对应错误的是( )
A.——制肥皂 B.——漂白剂
C.——供氧剂 D.——造纸
3.下列实验对应的离子方程式书写正确的是( )
A.小苏打溶液中加入过量澄清石灰水:
B.过氧化钠固体与水反应:
C.向溶液中加入铁粉,溶液变成浅绿色:
D.向含和的混合溶液中滴加稀盐酸:
4.根据火焰呈现的特征颜色,可以判断试样中所含的金属元素,化学上把这样的定性分析操作称为焰色试验。有关焰色试验的理解正确的是( )
A.焰色试验需要加热,所以焰色试验体现的是元素的化学性质
B.观察到火焰颜色呈黄色时,所测溶液中肯定有元素,可能有K元素
C.铜的金属性弱,可以用洁净的铜丝代替洁净的铁丝进行焰色试验
D.为了避免黄光的干扰,所以焰色试验都要透过蓝色钴玻璃观察焰色
5.代表阿伏加德罗常数,下列说法正确的是( )
A.在常温常压下,28g与混合物气体中所含的分子数目一定为
B.标准状况下,17g氨气所含原子数目为
C.在常温常压下,11.2L氮气所含的原子数目为
D.个氢分子所占有的体积一定为22.4L
6.三种气体X、Y、Z的相对分子质量关系为,下列说法正确的是( )
A.原子数目相同的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小是X
C.若一定条件下,三种气体的体积均为2.24L,则它们的物质的量一定均为
D.同温下,体积相同的两容器分别充入2gY气体和1gZ气体,则其压强比为
7.对于4℃时水中溶解了22.4L气体(标准状况下测得)后形成的溶液,下列说法中正确的是( )
A.该溶液物质的量浓度为
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
8.配制溶液,下列操作正确的是( )
A.称取10.6g无水碳酸钠,加入容量瓶中,加水溶解定容
B.称取10.6g无水碳酸钠,加入蒸馏水,搅拌、溶解
C.转移溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
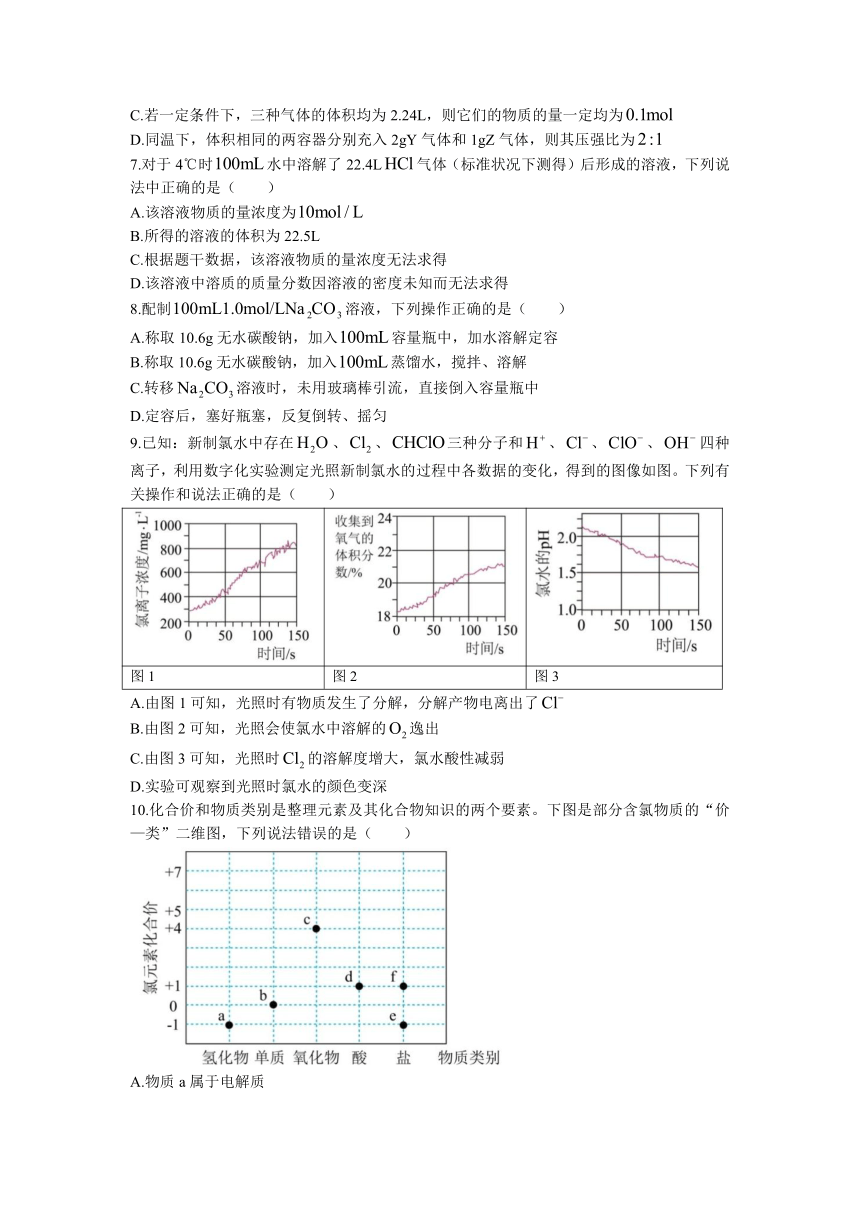
9.已知:新制氯水中存在、、三种分子和、、、四种离子,利用数字化实验测定光照新制氯水的过程中各数据的变化,得到的图像如图。下列有关操作和说法正确的是( )
图1 图2 图3
A.由图1可知,光照时有物质发生了分解,分解产物电离出了
B.由图2可知,光照会使氯水中溶解的逸出
C.由图3可知,光照时的溶解度增大,氯水酸性减弱
D.实验可观察到光照时氯水的颜色变深
10.化合价和物质类别是整理元素及其化合物知识的两个要素。下图是部分含氯物质的“价—类”二维图,下列说法错误的是( )
A.物质a属于电解质
B.物质d既有氧化性又有还原性
C.f转化为d的反应是氧化还原反应
D.e的可溶性盐中的阴离子可用溶液和稀硝酸检验
11.下列实验中,对应的操作、现象以及结论都正确的是( )
选项 操作 部分现象 结论
A 将盛有氯气(含少许空气)的试管倒扣在盛水的水槽中 试管内液面上升,黄绿色变浅 氯气会与水反应
B 向某溶液中加入足量盐酸酸化的溶液,振荡观察 溶液有白色固体出现 溶液中必含有
C 将潮湿的氯气通过盛有干燥红纸条的集气瓶 纸条红色褪去 氯气具有漂白性
D 向溶液中加入一小块钠 产生无色气泡,溶液底部有白色固体生成 不会直接与溶液中的反应
A.A B.B C.C D.D
12.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀②在人体内的血红蛋白中含有铁元素③在足量中燃烧生成,在少量中燃烧生成④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧⑤赤铁矿的主要成分是⑥铁与水蒸气在高温条件下反应生成和氢气
A.①③ B.②④⑥ C.②⑤ D.④⑥
二、不定项选择题(本题共2小题,每小题4分,共8分。每小题有一个或两个选项符合题意。若正确答案只包含一个选项,多选,该小题得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要有错误选项的得0分。)
13.把22.4g铁粉刚好完全溶解于某浓度的硝酸(强氧化性酸)中,若反应只收集到和,下列说法正确的是( )
A.反应后生成的盐只为
B.原硝酸的物质的量浓度为
C.反应过程转移电子的物质的量为
D.反应后生成的盐为和,其物质的量之比
14.现有2.0g含杂质的样品,用如图的实验装置测定试样的纯度,(可供选用的反应物只有固体、盐酸、硫酸和蒸馏水)下列说法不正确的是( )
A.装置A中液体试剂为盐酸
B.装置B的作用是除去挥发出的气体
C.若去掉装置E会导致所测试样的纯度偏低
D.若反应结束后有气体体积计算得气体质量为0.32g,则试样的纯度为39%
第Ⅱ卷 非选择题(共计56分)
15.(16分)化学是一门研究物质的组成结构、性质及变化规律的自然学科。
Ⅰ.现有下列10种物质:①铝,②纯醋酸,③,④,⑤,⑥氢氧化钡固体,⑦盐酸,⑧,⑨晶体,⑩乙醇。
(1)上述物质中属于电解质的有_______。
(2)已知与足量溶液反应生成⑤,则⑤在物质的分类中属于_____(填“酸式盐”“正盐”或“碱式盐”)。
(3)⑥与⑧在溶液中反应使溶液呈中性的离子方程式为_________。
(4)Ⅱ.已知离子还原性,则氧化性_____(填“>”“=”或“<”)。
有一混合溶液,其中只含有、、,其中、的个数比为,向该溶液中通入少量氯气,定会发生的反应的离子方程式是___________。如果要使上述溶液中、的个数比为,通入氯气与溶液中剩余的物质的量之比为_____。
(5)Ⅲ.是一种酸性氧化物,类似的性质。试写出过量的与溶液反应的离子方程式:____________。从硫元素的价态分析可知具有还原性,在溶液中可被氧化为高价态的。写出将通入氯水中发生反应的主要离子方程式:______________。
16.(10分)高铁酸盐(其中元素显价)具有极强的氧化性,可作水处理剂。
(1)低温下,在溶液中加入浓溶液可析出。写出上述得到的化学方程式:_____________;
(2)可通过多种方法得到。
①可通过溶液与溶液在碱性条件下反应制备(被还原为),此反应的离子方程式为_________;可用于氧化去除高氯(含高浓度)废水中的有机物。将溶液酸化时,迅速分解而转化为并放出。酸性溶液中的氧化性大于的氧化性。处理高氯废水中的有机物需在碱性条件下进行,其原因是_________;
②将过氧化钠和硫酸亚铁依次投入反应釜中,发生反应的化学方程式为。反应中的还原剂为________,每生成转移________。
17.(16分)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示,沉淀池反应
(1)“侯氏制碱法”誉满全球,其中的“碱”为______(填化学式),俗称___________。
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是__________
A. B.
C. D.
(3)煅烧炉中发生反应的化学方程式为___________。
(4)简单的检验方案的一般叙述过程为:①取试样,②加检验试剂,③现象,④结论。为验证产品纯碱中含有杂质,简单的检验方案是:取少量试样溶于水后,____________。
(5)用固体配制溶液。
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__________。
②下列情况中,会使所配溶液浓度偏高的是________。(填字母)
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(6)探究与盐酸的反应。向溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:、__________。
18.(14分)具有强氧化性,具有还原性,某同学根据氧化还原反应的知识推测与能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开、,在产生的氢气流经装有的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)写出A装置中发生的反应的离子方程式_____________。
(2)B装置中所盛放的试剂是_________(填“碱石灰”或“浓硫酸”),其作用是_________。
(3)步骤3中的必要操作为打开、,__________(请按正确的顺序填入下列步骤的字母)。
A.加热至逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭
D.停止加热,充分冷却
(4)由上述实验可推出与反应的化学方程式为________。
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的含量。其操作流程如下:
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、计、烧杯、酒精灯、火柴、玻璃棒、胶头滴管和______。
②在转移溶液时,若溶液转移不完全,则测得的质量分数_____(填“偏大”“偏小”或“不变”)。
桐城县中2022-2023学年高一上学期期末教学质量检测
化学答案
第Ⅰ卷选择题(共计44分)
一、单选题(12小题,每小题3分,共36分,每小题只有一个选项符合题意。)
1 2 3 4 5
C A D B A
6 7 8 9 10
B C D A C
11 12 13 14
D B BD CD
二、不定项选择题(本题共2小题,每小题4分,共8分。每小题有一个或两个选项符合题意。若正确答案只包含一个选项,多选,该小题得0分:若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要有错误选项的得0分。)
13.BD 14.CD
第Ⅱ卷非选择题(每空2分,共计56分)
15.(1)②④⑤⑥⑧⑨
(2)正盐(3)
(4)①>②③
(5)
16.(1)
(2)①
②酸性条件下,自身会分解,且会与反应产生③,④5
17.(1)①②纯碱或苏打(2)B
(3)
(4)加入足量的稀酸化,再滴加溶液,若产生白色沉淀,证明纯碱中含有杂质
(5)①容量瓶②b
(6)
18.(1)
(2)①碱石灰②干燥氢气(3)BADC
(4)
(5)①蒸发皿②偏小
化学试卷
(时间:75分钟 满分:100分)
第Ⅰ卷选择题(共计44分)
相对原子质量:H:1 C:12 N:14 O:16 :23 :35.5 :56
一、单选题(12小题,每小题3分,共36分,每小题只有一个选项符合题意。)
1.2021年,我国科学家实现了到淀粉的人工合成,该成果可以将空气中的捕集,用于合成淀粉。下列说法正确的是( )
A.可以用检验合成的淀粉
B.属于酸性氧化物,属于电解质
C.该科研成果为实现“碳中和”提供一种新思路
D.该成果的产业化可缓解温室效应,有效遏制酸雨的产生
2.下列物质的用途对应错误的是( )
A.——制肥皂 B.——漂白剂
C.——供氧剂 D.——造纸
3.下列实验对应的离子方程式书写正确的是( )
A.小苏打溶液中加入过量澄清石灰水:
B.过氧化钠固体与水反应:
C.向溶液中加入铁粉,溶液变成浅绿色:
D.向含和的混合溶液中滴加稀盐酸:
4.根据火焰呈现的特征颜色,可以判断试样中所含的金属元素,化学上把这样的定性分析操作称为焰色试验。有关焰色试验的理解正确的是( )
A.焰色试验需要加热,所以焰色试验体现的是元素的化学性质
B.观察到火焰颜色呈黄色时,所测溶液中肯定有元素,可能有K元素
C.铜的金属性弱,可以用洁净的铜丝代替洁净的铁丝进行焰色试验
D.为了避免黄光的干扰,所以焰色试验都要透过蓝色钴玻璃观察焰色
5.代表阿伏加德罗常数,下列说法正确的是( )
A.在常温常压下,28g与混合物气体中所含的分子数目一定为
B.标准状况下,17g氨气所含原子数目为
C.在常温常压下,11.2L氮气所含的原子数目为
D.个氢分子所占有的体积一定为22.4L
6.三种气体X、Y、Z的相对分子质量关系为,下列说法正确的是( )
A.原子数目相同的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小是X
C.若一定条件下,三种气体的体积均为2.24L,则它们的物质的量一定均为
D.同温下,体积相同的两容器分别充入2gY气体和1gZ气体,则其压强比为
7.对于4℃时水中溶解了22.4L气体(标准状况下测得)后形成的溶液,下列说法中正确的是( )
A.该溶液物质的量浓度为
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
8.配制溶液,下列操作正确的是( )
A.称取10.6g无水碳酸钠,加入容量瓶中,加水溶解定容
B.称取10.6g无水碳酸钠,加入蒸馏水,搅拌、溶解
C.转移溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
9.已知:新制氯水中存在、、三种分子和、、、四种离子,利用数字化实验测定光照新制氯水的过程中各数据的变化,得到的图像如图。下列有关操作和说法正确的是( )
图1 图2 图3
A.由图1可知,光照时有物质发生了分解,分解产物电离出了
B.由图2可知,光照会使氯水中溶解的逸出
C.由图3可知,光照时的溶解度增大,氯水酸性减弱
D.实验可观察到光照时氯水的颜色变深
10.化合价和物质类别是整理元素及其化合物知识的两个要素。下图是部分含氯物质的“价—类”二维图,下列说法错误的是( )
A.物质a属于电解质
B.物质d既有氧化性又有还原性
C.f转化为d的反应是氧化还原反应
D.e的可溶性盐中的阴离子可用溶液和稀硝酸检验
11.下列实验中,对应的操作、现象以及结论都正确的是( )
选项 操作 部分现象 结论
A 将盛有氯气(含少许空气)的试管倒扣在盛水的水槽中 试管内液面上升,黄绿色变浅 氯气会与水反应
B 向某溶液中加入足量盐酸酸化的溶液,振荡观察 溶液有白色固体出现 溶液中必含有
C 将潮湿的氯气通过盛有干燥红纸条的集气瓶 纸条红色褪去 氯气具有漂白性
D 向溶液中加入一小块钠 产生无色气泡,溶液底部有白色固体生成 不会直接与溶液中的反应
A.A B.B C.C D.D
12.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀②在人体内的血红蛋白中含有铁元素③在足量中燃烧生成,在少量中燃烧生成④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧⑤赤铁矿的主要成分是⑥铁与水蒸气在高温条件下反应生成和氢气
A.①③ B.②④⑥ C.②⑤ D.④⑥
二、不定项选择题(本题共2小题,每小题4分,共8分。每小题有一个或两个选项符合题意。若正确答案只包含一个选项,多选,该小题得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要有错误选项的得0分。)
13.把22.4g铁粉刚好完全溶解于某浓度的硝酸(强氧化性酸)中,若反应只收集到和,下列说法正确的是( )
A.反应后生成的盐只为
B.原硝酸的物质的量浓度为
C.反应过程转移电子的物质的量为
D.反应后生成的盐为和,其物质的量之比
14.现有2.0g含杂质的样品,用如图的实验装置测定试样的纯度,(可供选用的反应物只有固体、盐酸、硫酸和蒸馏水)下列说法不正确的是( )
A.装置A中液体试剂为盐酸
B.装置B的作用是除去挥发出的气体
C.若去掉装置E会导致所测试样的纯度偏低
D.若反应结束后有气体体积计算得气体质量为0.32g,则试样的纯度为39%
第Ⅱ卷 非选择题(共计56分)
15.(16分)化学是一门研究物质的组成结构、性质及变化规律的自然学科。
Ⅰ.现有下列10种物质:①铝,②纯醋酸,③,④,⑤,⑥氢氧化钡固体,⑦盐酸,⑧,⑨晶体,⑩乙醇。
(1)上述物质中属于电解质的有_______。
(2)已知与足量溶液反应生成⑤,则⑤在物质的分类中属于_____(填“酸式盐”“正盐”或“碱式盐”)。
(3)⑥与⑧在溶液中反应使溶液呈中性的离子方程式为_________。
(4)Ⅱ.已知离子还原性,则氧化性_____(填“>”“=”或“<”)。
有一混合溶液,其中只含有、、,其中、的个数比为,向该溶液中通入少量氯气,定会发生的反应的离子方程式是___________。如果要使上述溶液中、的个数比为,通入氯气与溶液中剩余的物质的量之比为_____。
(5)Ⅲ.是一种酸性氧化物,类似的性质。试写出过量的与溶液反应的离子方程式:____________。从硫元素的价态分析可知具有还原性,在溶液中可被氧化为高价态的。写出将通入氯水中发生反应的主要离子方程式:______________。
16.(10分)高铁酸盐(其中元素显价)具有极强的氧化性,可作水处理剂。
(1)低温下,在溶液中加入浓溶液可析出。写出上述得到的化学方程式:_____________;
(2)可通过多种方法得到。
①可通过溶液与溶液在碱性条件下反应制备(被还原为),此反应的离子方程式为_________;可用于氧化去除高氯(含高浓度)废水中的有机物。将溶液酸化时,迅速分解而转化为并放出。酸性溶液中的氧化性大于的氧化性。处理高氯废水中的有机物需在碱性条件下进行,其原因是_________;
②将过氧化钠和硫酸亚铁依次投入反应釜中,发生反应的化学方程式为。反应中的还原剂为________,每生成转移________。
17.(16分)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示,沉淀池反应
(1)“侯氏制碱法”誉满全球,其中的“碱”为______(填化学式),俗称___________。
(2)实验室模拟“侯氏制碱法”,下列操作未涉及的是__________
A. B.
C. D.
(3)煅烧炉中发生反应的化学方程式为___________。
(4)简单的检验方案的一般叙述过程为:①取试样,②加检验试剂,③现象,④结论。为验证产品纯碱中含有杂质,简单的检验方案是:取少量试样溶于水后,____________。
(5)用固体配制溶液。
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__________。
②下列情况中,会使所配溶液浓度偏高的是________。(填字母)
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(6)探究与盐酸的反应。向溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:、__________。
18.(14分)具有强氧化性,具有还原性,某同学根据氧化还原反应的知识推测与能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开、,在产生的氢气流经装有的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)写出A装置中发生的反应的离子方程式_____________。
(2)B装置中所盛放的试剂是_________(填“碱石灰”或“浓硫酸”),其作用是_________。
(3)步骤3中的必要操作为打开、,__________(请按正确的顺序填入下列步骤的字母)。
A.加热至逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭
D.停止加热,充分冷却
(4)由上述实验可推出与反应的化学方程式为________。
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的含量。其操作流程如下:
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、计、烧杯、酒精灯、火柴、玻璃棒、胶头滴管和______。
②在转移溶液时,若溶液转移不完全,则测得的质量分数_____(填“偏大”“偏小”或“不变”)。
桐城县中2022-2023学年高一上学期期末教学质量检测
化学答案
第Ⅰ卷选择题(共计44分)
一、单选题(12小题,每小题3分,共36分,每小题只有一个选项符合题意。)
1 2 3 4 5
C A D B A
6 7 8 9 10
B C D A C
11 12 13 14
D B BD CD
二、不定项选择题(本题共2小题,每小题4分,共8分。每小题有一个或两个选项符合题意。若正确答案只包含一个选项,多选,该小题得0分:若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要有错误选项的得0分。)
13.BD 14.CD
第Ⅱ卷非选择题(每空2分,共计56分)
15.(1)②④⑤⑥⑧⑨
(2)正盐(3)
(4)①>②③
(5)
16.(1)
(2)①
②酸性条件下,自身会分解,且会与反应产生③,④5
17.(1)①②纯碱或苏打(2)B
(3)
(4)加入足量的稀酸化,再滴加溶液,若产生白色沉淀,证明纯碱中含有杂质
(5)①容量瓶②b
(6)
18.(1)
(2)①碱石灰②干燥氢气(3)BADC
(4)
(5)①蒸发皿②偏小
同课章节目录
