四川省广元市重点中学2022-2023学年高一上学期期末段考化学试题(含答案)
文档属性
| 名称 | 四川省广元市重点中学2022-2023学年高一上学期期末段考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 327.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 08:51:31 | ||
图片预览




文档简介
广元市重点中学2022-2023学年高一上学期期末段考
化学试题
考试时间:90分钟 总分:100分
可能用到的相对原子质量:H:1 He:4 C:12 N:14 O:16 Na:23 Mg:24 S:32
第Ⅰ卷(共50分)
一、选择题(每小题仅一个选项符合题意,每小题2分,共50分)
1.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足图中阴影部分关系的是
① ② ③ ④
A NaCl K2SO4 KCl
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl K2SO4 KCl NH4Cl
D Na2SO4 KCl K2SO4 NH4Cl
2.以下说法正确的是
A.Na2O、Na2O2都是碱性氧化物 B.纯碱、烧碱都是碱
C.CO、CO2都是酸性氧化物 D.金刚石、石墨互为同素异形体
3.设为阿伏加德罗常数的值,下列说法正确的是
A.2.4g镁离子所含电子数目为 B.常温常压下,1molCO含原子数为
C.17gNH3所含质子数目为 D.18g水在标准状况下的体积约为22.4L
4.近期新型冠状病毒肺炎疫情在全球多地爆发,“84”消毒液是大规模环境消毒剂。下列说法不正确的是
A.“84消毒液的有效成分是NaClO
B.“洁厕灵”(主要成分为HCl)与“84"消毒液混用会发生氯气中毒
C.可以用pH试纸来测该溶液的pH值
D.检验该消毒液中是否含有Cl-的方程式为:
5.下列叙述正确的是
A.纯净的H2在Cl2中安静地燃烧,发出蓝色火焰
B.过量的Fe在Cl2中燃烧,生成FeCl2
C.加热时,金属钠剧烈燃烧,产生黄色火焰
D.金属钠着火时使用泡沫灭火器灭火
6.下列关于Na2CO3和NaHCO3的性质说法错误的是
A.二者饱和溶液的碱性强弱:NaHCO3B.与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3D.等物质的量两种固体与足量盐酸反应产生CO2的物质的量:NaHCO37.下列变化能通过一步化学反应实现的是
A. B.
C. D.
8.下列对进行焰色试验应实验操作注意事项的说明,正确的是
①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸被检物质
③每次实验后,要用硫酸把铂丝洗净
④焰色试验是物理变化
⑤没有铂丝,也可用光洁无锈的铁丝代替
A.①②④⑤ B.①②③⑤ C.①②③④ D.全部
9.能用来表示的化学反应是
A.氢氧化镁固体和稀盐酸反应 B.稀硫酸滴入氨水中
C.二氧化碳通入氢氧化钾溶液中 D.澄清石灰水和稀硝酸反应
10.下列电离方程式中,书写正确的是
A. B.
C. D.
11.常温常压下,用等质量的He、CH4、O2、SO2分别吹出四个气球,其中气体为SO2的是
A. B. C. D.
12.某实验小组通过下图所示实验,探究Na2O2与水的反应:
下列说法中正确的是
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
13.下列化学反应中电子转移的表示方法正确的是
A.
B.
C.
D.
14.下列离子方程式正确的是
A.在Cu片上滴加盐酸:
B.向三氯化铁溶液中逐滴加入过量的氨水:
C.少量的NaHCO3溶液与足量澄清石灰水混合:
D.硝酸滴在石灰石上:
15.能实现下列物质间直接转化的元素是
单质 氧化物 酸或碱 盐
A.C B.Cu C.Si D.Fe
16.判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:属于不同分散系的本质原因是能否发生丁达尔效应
B.氧化还原反应:元素化合价是否变化
C.纯净物与混合物:是否仅含有一种元素
D.电解质与非电解质:物质本身的导电性
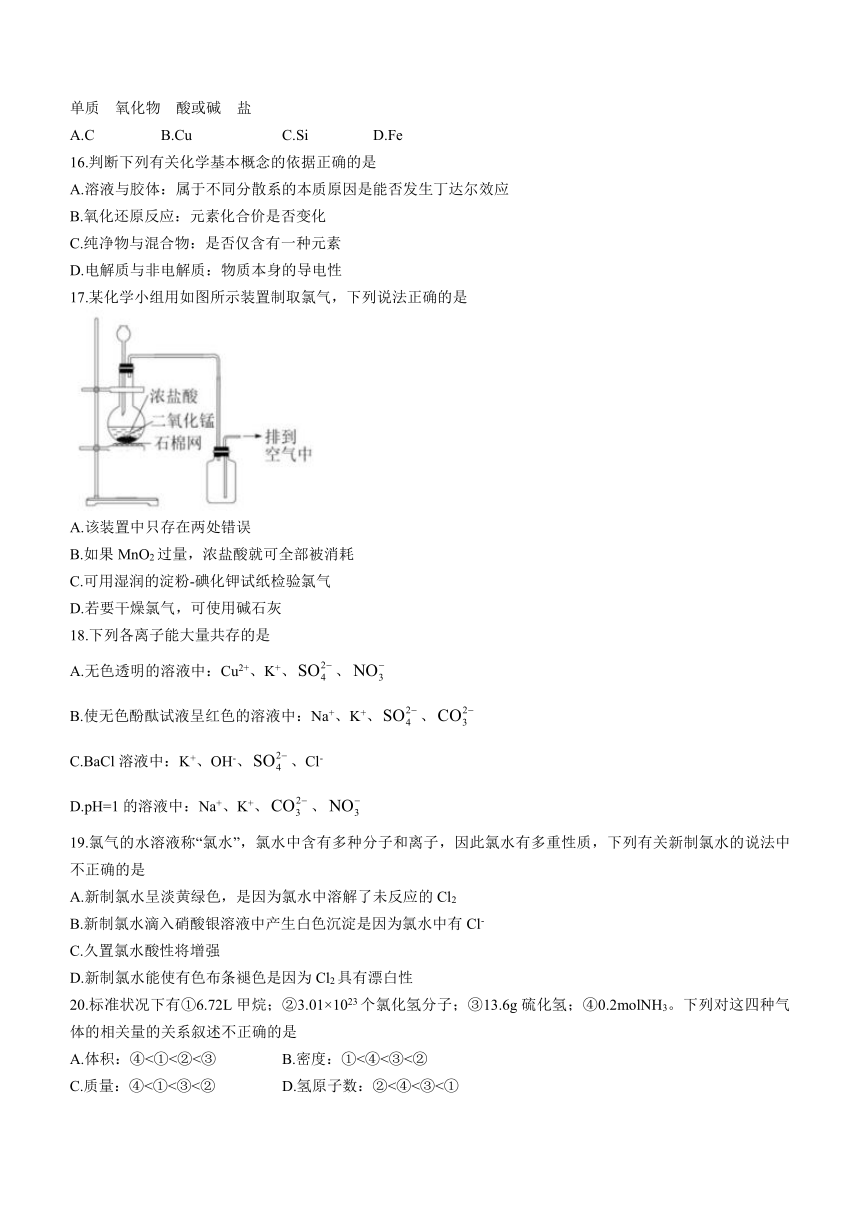
17.某化学小组用如图所示装置制取氯气,下列说法正确的是
A.该装置中只存在两处错误
B.如果MnO2过量,浓盐酸就可全部被消耗
C.可用湿润的淀粉-碘化钾试纸检验氯气
D.若要干燥氯气,可使用碱石灰
18.下列各离子能大量共存的是
A.无色透明的溶液中:Cu2+、K+、、
B.使无色酚酞试液呈红色的溶液中:Na+、K+、、
C.BaCl溶液中:K+、OH-、、Cl-
D.pH=1的溶液中:Na+、K+、、
19.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是
A.新制氯水呈淡黄绿色,是因为氯水中溶解了未反应的Cl2
B.新制氯水滴入硝酸银溶液中产生白色沉淀是因为氯水中有Cl-
C.久置氯水酸性将增强
D.新制氯水能使有色布条褪色是因为Cl2具有漂白性
20.标准状况下有①6.72L甲烷;②3.01×1023个氯化氢分子;③13.6g硫化氢;④0.2molNH3。下列对这四种气体的相关量的关系叙述不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
21.下列反应的离子方程式正确的是
A.将氯气溶于水制备次氯酸:
B.钠与FeCl3溶液反应,有黑色固体析出:
C.Na2CO3与足量的稀盐酸反应:
D.H2SO4溶液与溶液反应:
22.对于反应(FeS2中的S为-1价)下列叙述正确的是
A.铁和硫两种元素被还原 B.只有硫元素被氧化
C.Fe2O3为氧化产物,SO2为还原产物 D.生成8molSO2时转移电子总数是
23.在一定条件下,离子恰好能把离子氧化成,则还原产物中X元素的化合价为
A.+1 B.+3 C.+2 D.+4
24.为除去括号内的杂质,所选用的试剂或方法正确的是
A.CO2气体(HCl),饱和NaHCO3溶液
B.NaHCO3,固体(Na2CO3),加热至不再产生气体
C.NaCl粉末(Na2O),将混合物在空气中加热
D.Na2CO3溶液(Na2SO4),加入适量溶液,过滤
25.在一个氧化还原反应体系中,反应物、生成物共有六种粒子:Fe3+、、Fe2+、、H+、H2O.已知氧化性。下列叙述不正确的是
A.该反应说明溶液和稀硫酸能发生反应
B.该反应中氧化剂与还原剂的物质的量之比为1:8
C.若有发生氧化反应,则转移个电子
D.该反应中Fe2+是还原剂,是还原产物
第Ⅱ卷(共50分)
二、填空题(本题共5小题,共50分)
26.(12分)下列物质:①Al②③NaHSO4④CO2⑤H2SO4⑥酒精⑦KHCO3溶液⑧CuSO4⑨熔融NaCl,回答下列问题:
(1)属于电解质且能导电的是(填序号)_________,属于非电解质的是(填号)__________,既不属于电解质也不属于非电解质的是(填序号)_________。
(2)写出③溶于水的电离方程式_________。
(3)向一定体积的②溶液中逐滴加入⑧的溶液,并测得混合溶液的导电能力随时间变化的曲线如图所示。写出AB段发生反应的离子方程式_________,BC段溶液的导电能力不断增大的主要原因是_________。
27.(每空2分,共10分)某无色透明溶液中可能大量存在Ag+、Ca2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_________。
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有__________,写出生成该白色沉淀的离子方程式为_________。
(4)原溶液可能大量共存的阴离子是_________(填字母)。
A.OH- B.- C. D.Cl-
28.(8分)甘肃马家窑遗址出土的青铜刀,是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,其化学式为,“铜绿”能跟酸反应生成铜盐、CO2和H2O。回答下列问题:
(1)CO2属于__________氧化物。(填“酸性”或“碱性”)
(2)从物质分类标准看,“铜绿”属于哪类物质__________。(填选项)
A.酸 B.碱 C.盐 D.氧化物
(3)铜器表面有时会生成“铜绿”,这层“铜绿”可用化学方法除去,写出盐酸去除“铜绿”的化学方程式:____________。
(4)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:
反应I:,反应Ⅱ:。
①反应Ⅰ中,氧化产物是____________,还原产物是____________。
②反应Ⅱ中,Cu2O的作用是____________。(填“氧化剂”“还原剂”或“氧化剂和还原剂”)
29.(10分)如图是教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)
回答下列问题:
(1)实验一在加热过程中能观察到有白色沉淀生成的是___________(填“I”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是____________,通过实验一可比较出_____________(填“Na2CO3”或“NaHCO3”)不稳定。
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:_____________,请写出Na2O2与CO2反应的化学方程式:_____________。
(3)Na2O2具有强氧化性,与SO2反应能生成硫酸钠,写出反应的化学方程式:_____________。
30.(10分)氧化还原反应在高中化学中是一类重要的反应类型。KMnO4、FeCl3是中学化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是_________(填字母)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)。
①上述反应中被还原的元素为_________(填元素符号)。
②与Fe2+反应生成Mn2+,Fe2+发生_________反应(填“氧化”或“还原”。)
③配平以下化学方程式并用双线桥标出电子转移的方向和数目:
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用表示。
①上式中X的化学式为_________。
②该反应的离子方程式为__________。
广元市重点中学2022-2023学年高一上学期期末段考
化学试题参考答案
一、选择题(每小题仅一个选项符合题意,每小题2分,共50分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 B D A C C D B A D A A C C
题号 14 15 16 17 18 19 20 21 22 23 24 25
答案 C A B C B D A A D B A C
26.(每空2分,共12分)
(1)⑨ ④⑥ ①⑦
(2)
(3) 过量的CuSO4电离出的离子导电
27.(每空2分,共10分)
(1)Cu2+、Fe3+
(2)Ag+
(3)Ca2+
(4)C
28.(除标注外每空1分,共8分)
(1)酸性
(2)C
(3)(2分)
(4)①SO2 Cu2O和SO2(2分) ②氧化剂
29(10分,除标注外,其余每空2分)
(1)Ⅱ(1分) NaHCO3(1分)
(2)包有NaO2的棉花燃烧
(3)
30.(除标注外,其余每空1分,共10分)
(1)C
(2)①Mn ②氧化
③
(配平2分,双线桥2分)
(3)FeCl2 (2分)
化学试题
考试时间:90分钟 总分:100分
可能用到的相对原子质量:H:1 He:4 C:12 N:14 O:16 Na:23 Mg:24 S:32
第Ⅰ卷(共50分)
一、选择题(每小题仅一个选项符合题意,每小题2分,共50分)
1.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足图中阴影部分关系的是
① ② ③ ④
A NaCl K2SO4 KCl
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl K2SO4 KCl NH4Cl
D Na2SO4 KCl K2SO4 NH4Cl
2.以下说法正确的是
A.Na2O、Na2O2都是碱性氧化物 B.纯碱、烧碱都是碱
C.CO、CO2都是酸性氧化物 D.金刚石、石墨互为同素异形体
3.设为阿伏加德罗常数的值,下列说法正确的是
A.2.4g镁离子所含电子数目为 B.常温常压下,1molCO含原子数为
C.17gNH3所含质子数目为 D.18g水在标准状况下的体积约为22.4L
4.近期新型冠状病毒肺炎疫情在全球多地爆发,“84”消毒液是大规模环境消毒剂。下列说法不正确的是
A.“84消毒液的有效成分是NaClO
B.“洁厕灵”(主要成分为HCl)与“84"消毒液混用会发生氯气中毒
C.可以用pH试纸来测该溶液的pH值
D.检验该消毒液中是否含有Cl-的方程式为:
5.下列叙述正确的是
A.纯净的H2在Cl2中安静地燃烧,发出蓝色火焰
B.过量的Fe在Cl2中燃烧,生成FeCl2
C.加热时,金属钠剧烈燃烧,产生黄色火焰
D.金属钠着火时使用泡沫灭火器灭火
6.下列关于Na2CO3和NaHCO3的性质说法错误的是
A.二者饱和溶液的碱性强弱:NaHCO3
C.相同温度时,在水中的溶解性:NaHCO3
A. B.
C. D.
8.下列对进行焰色试验应实验操作注意事项的说明,正确的是
①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸被检物质
③每次实验后,要用硫酸把铂丝洗净
④焰色试验是物理变化
⑤没有铂丝,也可用光洁无锈的铁丝代替
A.①②④⑤ B.①②③⑤ C.①②③④ D.全部
9.能用来表示的化学反应是
A.氢氧化镁固体和稀盐酸反应 B.稀硫酸滴入氨水中
C.二氧化碳通入氢氧化钾溶液中 D.澄清石灰水和稀硝酸反应
10.下列电离方程式中,书写正确的是
A. B.
C. D.
11.常温常压下,用等质量的He、CH4、O2、SO2分别吹出四个气球,其中气体为SO2的是
A. B. C. D.
12.某实验小组通过下图所示实验,探究Na2O2与水的反应:
下列说法中正确的是
A.②中的大量气泡的主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
13.下列化学反应中电子转移的表示方法正确的是
A.
B.
C.
D.
14.下列离子方程式正确的是
A.在Cu片上滴加盐酸:
B.向三氯化铁溶液中逐滴加入过量的氨水:
C.少量的NaHCO3溶液与足量澄清石灰水混合:
D.硝酸滴在石灰石上:
15.能实现下列物质间直接转化的元素是
单质 氧化物 酸或碱 盐
A.C B.Cu C.Si D.Fe
16.判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:属于不同分散系的本质原因是能否发生丁达尔效应
B.氧化还原反应:元素化合价是否变化
C.纯净物与混合物:是否仅含有一种元素
D.电解质与非电解质:物质本身的导电性
17.某化学小组用如图所示装置制取氯气,下列说法正确的是
A.该装置中只存在两处错误
B.如果MnO2过量,浓盐酸就可全部被消耗
C.可用湿润的淀粉-碘化钾试纸检验氯气
D.若要干燥氯气,可使用碱石灰
18.下列各离子能大量共存的是
A.无色透明的溶液中:Cu2+、K+、、
B.使无色酚酞试液呈红色的溶液中:Na+、K+、、
C.BaCl溶液中:K+、OH-、、Cl-
D.pH=1的溶液中:Na+、K+、、
19.氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是
A.新制氯水呈淡黄绿色,是因为氯水中溶解了未反应的Cl2
B.新制氯水滴入硝酸银溶液中产生白色沉淀是因为氯水中有Cl-
C.久置氯水酸性将增强
D.新制氯水能使有色布条褪色是因为Cl2具有漂白性
20.标准状况下有①6.72L甲烷;②3.01×1023个氯化氢分子;③13.6g硫化氢;④0.2molNH3。下列对这四种气体的相关量的关系叙述不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
21.下列反应的离子方程式正确的是
A.将氯气溶于水制备次氯酸:
B.钠与FeCl3溶液反应,有黑色固体析出:
C.Na2CO3与足量的稀盐酸反应:
D.H2SO4溶液与溶液反应:
22.对于反应(FeS2中的S为-1价)下列叙述正确的是
A.铁和硫两种元素被还原 B.只有硫元素被氧化
C.Fe2O3为氧化产物,SO2为还原产物 D.生成8molSO2时转移电子总数是
23.在一定条件下,离子恰好能把离子氧化成,则还原产物中X元素的化合价为
A.+1 B.+3 C.+2 D.+4
24.为除去括号内的杂质,所选用的试剂或方法正确的是
A.CO2气体(HCl),饱和NaHCO3溶液
B.NaHCO3,固体(Na2CO3),加热至不再产生气体
C.NaCl粉末(Na2O),将混合物在空气中加热
D.Na2CO3溶液(Na2SO4),加入适量溶液,过滤
25.在一个氧化还原反应体系中,反应物、生成物共有六种粒子:Fe3+、、Fe2+、、H+、H2O.已知氧化性。下列叙述不正确的是
A.该反应说明溶液和稀硫酸能发生反应
B.该反应中氧化剂与还原剂的物质的量之比为1:8
C.若有发生氧化反应,则转移个电子
D.该反应中Fe2+是还原剂,是还原产物
第Ⅱ卷(共50分)
二、填空题(本题共5小题,共50分)
26.(12分)下列物质:①Al②③NaHSO4④CO2⑤H2SO4⑥酒精⑦KHCO3溶液⑧CuSO4⑨熔融NaCl,回答下列问题:
(1)属于电解质且能导电的是(填序号)_________,属于非电解质的是(填号)__________,既不属于电解质也不属于非电解质的是(填序号)_________。
(2)写出③溶于水的电离方程式_________。
(3)向一定体积的②溶液中逐滴加入⑧的溶液,并测得混合溶液的导电能力随时间变化的曲线如图所示。写出AB段发生反应的离子方程式_________,BC段溶液的导电能力不断增大的主要原因是_________。
27.(每空2分,共10分)某无色透明溶液中可能大量存在Ag+、Ca2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_________。
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有__________,写出生成该白色沉淀的离子方程式为_________。
(4)原溶液可能大量共存的阴离子是_________(填字母)。
A.OH- B.- C. D.Cl-
28.(8分)甘肃马家窑遗址出土的青铜刀,是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,其化学式为,“铜绿”能跟酸反应生成铜盐、CO2和H2O。回答下列问题:
(1)CO2属于__________氧化物。(填“酸性”或“碱性”)
(2)从物质分类标准看,“铜绿”属于哪类物质__________。(填选项)
A.酸 B.碱 C.盐 D.氧化物
(3)铜器表面有时会生成“铜绿”,这层“铜绿”可用化学方法除去,写出盐酸去除“铜绿”的化学方程式:____________。
(4)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:
反应I:,反应Ⅱ:。
①反应Ⅰ中,氧化产物是____________,还原产物是____________。
②反应Ⅱ中,Cu2O的作用是____________。(填“氧化剂”“还原剂”或“氧化剂和还原剂”)
29.(10分)如图是教师在课堂中演示的两个实验装置(铁架台等辅助仪器略去未画)
回答下列问题:
(1)实验一在加热过程中能观察到有白色沉淀生成的是___________(填“I”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是____________,通过实验一可比较出_____________(填“Na2CO3”或“NaHCO3”)不稳定。
(2)实验二用来验证Na2O2与CO2的反应,观察到的实验现象是:_____________,请写出Na2O2与CO2反应的化学方程式:_____________。
(3)Na2O2具有强氧化性,与SO2反应能生成硫酸钠,写出反应的化学方程式:_____________。
30.(10分)氧化还原反应在高中化学中是一类重要的反应类型。KMnO4、FeCl3是中学化学中常用的氧化剂。回答下列问题:
(1)下列基本反应类型中一定属于氧化还原反应的是_________(填字母)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)。
①上述反应中被还原的元素为_________(填元素符号)。
②与Fe2+反应生成Mn2+,Fe2+发生_________反应(填“氧化”或“还原”。)
③配平以下化学方程式并用双线桥标出电子转移的方向和数目:
(3)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用表示。
①上式中X的化学式为_________。
②该反应的离子方程式为__________。
广元市重点中学2022-2023学年高一上学期期末段考
化学试题参考答案
一、选择题(每小题仅一个选项符合题意,每小题2分,共50分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 B D A C C D B A D A A C C
题号 14 15 16 17 18 19 20 21 22 23 24 25
答案 C A B C B D A A D B A C
26.(每空2分,共12分)
(1)⑨ ④⑥ ①⑦
(2)
(3) 过量的CuSO4电离出的离子导电
27.(每空2分,共10分)
(1)Cu2+、Fe3+
(2)Ag+
(3)Ca2+
(4)C
28.(除标注外每空1分,共8分)
(1)酸性
(2)C
(3)(2分)
(4)①SO2 Cu2O和SO2(2分) ②氧化剂
29(10分,除标注外,其余每空2分)
(1)Ⅱ(1分) NaHCO3(1分)
(2)包有NaO2的棉花燃烧
(3)
30.(除标注外,其余每空1分,共10分)
(1)C
(2)①Mn ②氧化
③
(配平2分,双线桥2分)
(3)FeCl2 (2分)
同课章节目录
