四川省宜宾市部分中学2022-2023学年高二下学期开学考试化学试题(含答案)
文档属性
| 名称 | 四川省宜宾市部分中学2022-2023学年高二下学期开学考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 417.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 08:53:17 | ||
图片预览

文档简介
宜宾市部分中学2022-2023学年高二下学期开学考试
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名和座位号填写在答题卡上。
2.考试结束后,将本试卷自己保管好,答题卡交回。
3.本次考试物理化学生物同堂分卷考试,物理110分,化学100分,生物90分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56
第I卷 选择题(48分)
一.选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中只有一项符合题目要求
1.下列关于化学与生活常识的说法正确的是
A.热的纯碱溶液具有去除油污和消毒杀菌的作用
B.太阳能、风能既属于新能源,也属于一次能源
C.农业上将草木灰和铵态氮肥一起施用肥效更佳
D.金属钠着火时,可用泡沫灭火器灭火
2.下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙显黄色的溶液:、、、
B.的溶液:、、、、
C.的混合液:、、、
D.常温下,由水电离产生的溶液中:、、、
3.下列性质、应用与盐类水解无主要关系的是
A.亚硫酸氢钠溶液呈酸性
B.利用制备无水需要在氯化氢气流中蒸干
C.明矾可作净水剂
D.实验室配制溶液时,向其中加入少量浓盐酸
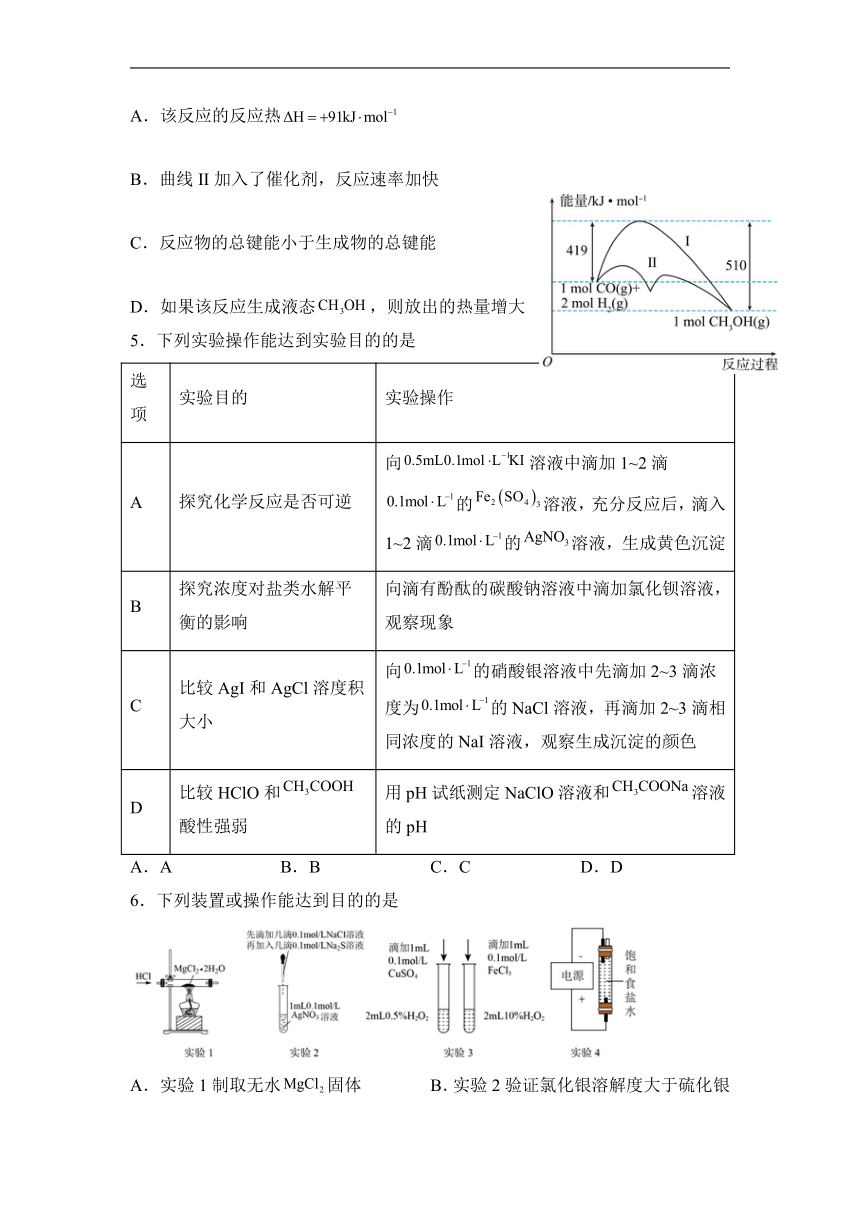
4.已知反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断错误的是
A.该反应的反应热
B.曲线II加入了催化剂,反应速率加快
C.反应物的总键能小于生成物的总键能
D.如果该反应生成液态,则放出的热量增大
5.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 探究化学反应是否可逆 向溶液中滴加1~2滴的溶液,充分反应后,滴入1~2滴的溶液,生成黄色沉淀
B 探究浓度对盐类水解平衡的影响 向滴有酚酞的碳酸钠溶液中滴加氯化钡溶液,观察现象
C 比较AgI和AgCl溶度积大小 向的硝酸银溶液中先滴加2~3滴浓度为的NaCl溶液,再滴加2~3滴相同浓度的NaI溶液,观察生成沉淀的颜色
D 比较HClO和酸性强弱 用pH试纸测定NaClO溶液和溶液的pH
A.A B.B C.C D.D
6.下列装置或操作能达到目的的是
A.实验1制取无水固体 B.实验2验证氯化银溶解度大于硫化银
C.实验3比较、对反应速率的影响 D.实验4氯碱工业
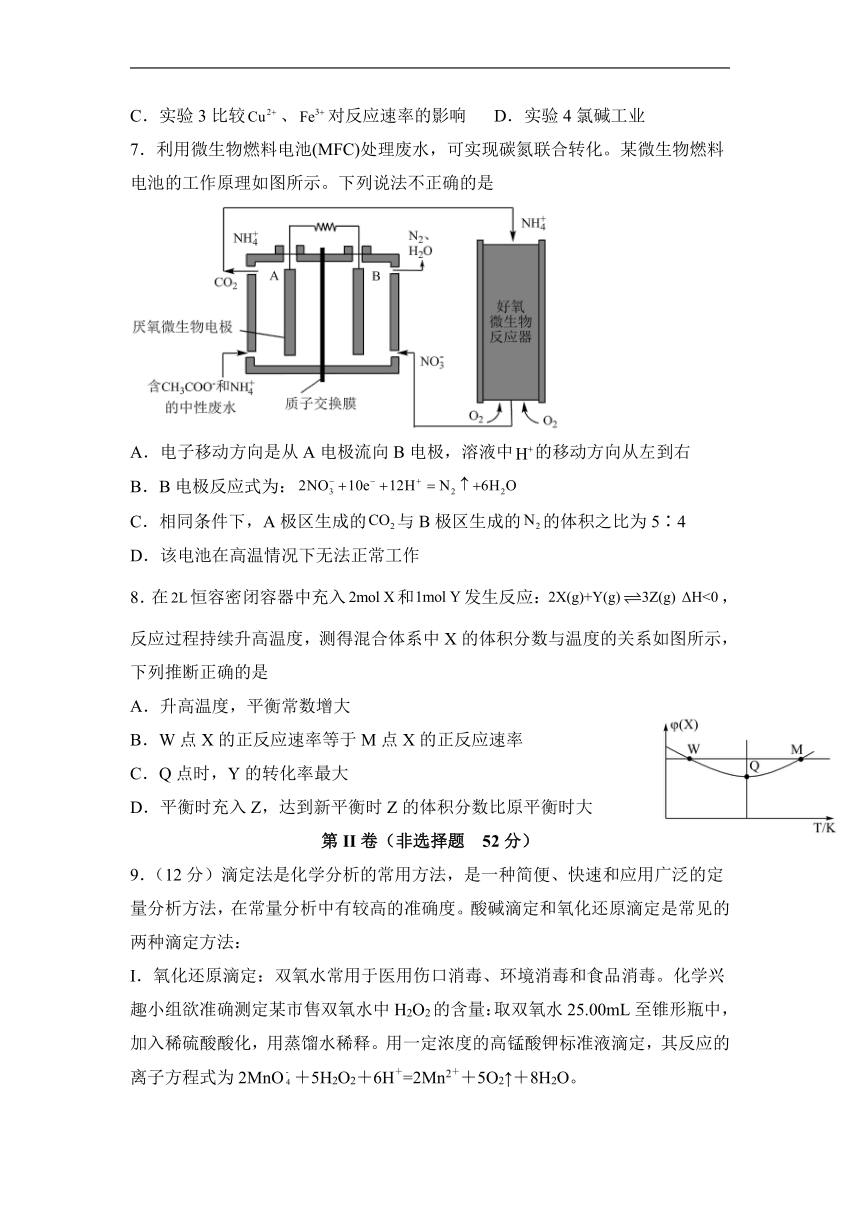
7.利用微生物燃料电池(MFC)处理废水,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示。下列说法不正确的是
A.电子移动方向是从A电极流向B电极,溶液中的移动方向从左到右
B.B电极反应式为:
C.相同条件下,A极区生成的与B极区生成的的体积之比为5∶4
D.该电池在高温情况下无法正常工作
8.在恒容密闭容器中充入和发生反应:,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
第II卷(非选择题 52分)
9.(12分)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
Ⅰ.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO+5H2O2+6H+=2Mn2++5O2↑+8H2O。
(1)滴定时,将高锰酸钾标准溶液注入___________(填“酸”或“碱”)式滴定管中。
(2)滴定到达终点的现象是___________。
Ⅱ.酸碱中和滴定:常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00 mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
(3)滴定盐酸的曲线是图___________(填“1”或“2”)。
(4)达到B、D状态时,反应消耗的NaOH溶液的体积a___________(填“>”“<”或“=”)b。
(5)D状态时,溶液中的溶质是___________。
10.(12分)A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表所示。
元素 相关信息
A 基态原子的价层电子排布为nsnnpn
B 基态原子中的未成对电子数是同周期元素原子中最多的
C 基态原子的最外层电子数是电子层数的3倍
D 简单离子是第三周期元素所形成的离子中半径最小的
E 基态原子的价电子层中的未成对电子数为4
请回答下列问题(用对应元素的元素符号作答)。
(1)写出D元素基态原子的价层电子排布式:_______;基态A原子电子占据最高能级的电子云轮廓图为_______形;基态E2+的价层电子排布图:_______。
(2)这5种元素中电负性最大的元素是_______ (用元素符号表示,下同),A、B、C三种元素的第一电离能由大到小的顺序为_______。
(3)B、C、D的简单离子的半径由大到小的顺序为_______(用离子符号表示)。
(4)写出含有C的强氧化性的氢化物的电子式:_______。
11.(12分)人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq)(尿酸根,aq)、②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,,,。
②37℃时,模拟关节滑液pH=7.4,。
(1)37℃时,HUr溶液的pH约为_______(已知)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
A.NaUr溶液显碱性 B.HUr溶液可使石蕊溶液变红
C.常温下,等浓度的尿酸溶液导电性比盐酸弱
D.10mL溶液与10mLNaOH溶液完全反应
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中_____(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______(填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
A.多喝水,食用新鲜蔬果 B.饮食宜多盐、多脂
C.适度运动,注意关节保暖 D.减少摄入易代谢出尿酸的食物
12.(16分)常作食品加工中的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)可作净水剂,其原理是_______(用离子方程式说明)。
(2)相同条件下,溶液中的_______(填“等于”“大于”或“小于”)溶液中的。
(3)几种均为的电解质溶液的pH随温度变化的曲线如图所示。
①其中符合溶液的pH随温度变化的曲线是_______(填罗马数字),导致溶液的pH随温度变化的原因是_______。
②20℃时,溶液中_______。(列计算式不必化简)
(4)室温时,向溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是_______点。
②在b点,溶液中各离子浓度由大到小的排列顺序是_______。
③由b到c发生反应的离子方程式为_______。
宜宾市部分中学2022-2023学年高二下学期开学考试
化学试题参考答案:
1.B 2.B 3.A 4.A 5.B 6.A 7.C 8.C
9.(1)酸 (2)滴入最后一滴高锰酸钾溶液,溶液呈紫色,且30秒内不褪色
(3)1 (4)> (5)CH3COOH和CH3COONa
10.(1) 哑铃 (2) O
(3) (4)
11.(1)3.7 (2)AC (3)>
(4),故有尿酸钠晶体析出
(5)吸热 (6)ACD
12.(1)
(2)小于
(3) I 水解使溶液呈酸性,升高温度使其水解程度增大,pH减小
(4) a
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名和座位号填写在答题卡上。
2.考试结束后,将本试卷自己保管好,答题卡交回。
3.本次考试物理化学生物同堂分卷考试,物理110分,化学100分,生物90分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56
第I卷 选择题(48分)
一.选择题:本题共8小题,每小题6分,共48分。在每小题给出的四个选项中只有一项符合题目要求
1.下列关于化学与生活常识的说法正确的是
A.热的纯碱溶液具有去除油污和消毒杀菌的作用
B.太阳能、风能既属于新能源,也属于一次能源
C.农业上将草木灰和铵态氮肥一起施用肥效更佳
D.金属钠着火时,可用泡沫灭火器灭火
2.下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙显黄色的溶液:、、、
B.的溶液:、、、、
C.的混合液:、、、
D.常温下,由水电离产生的溶液中:、、、
3.下列性质、应用与盐类水解无主要关系的是
A.亚硫酸氢钠溶液呈酸性
B.利用制备无水需要在氯化氢气流中蒸干
C.明矾可作净水剂
D.实验室配制溶液时,向其中加入少量浓盐酸
4.已知反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。下列判断错误的是
A.该反应的反应热
B.曲线II加入了催化剂,反应速率加快
C.反应物的总键能小于生成物的总键能
D.如果该反应生成液态,则放出的热量增大
5.下列实验操作能达到实验目的的是
选项 实验目的 实验操作
A 探究化学反应是否可逆 向溶液中滴加1~2滴的溶液,充分反应后,滴入1~2滴的溶液,生成黄色沉淀
B 探究浓度对盐类水解平衡的影响 向滴有酚酞的碳酸钠溶液中滴加氯化钡溶液,观察现象
C 比较AgI和AgCl溶度积大小 向的硝酸银溶液中先滴加2~3滴浓度为的NaCl溶液,再滴加2~3滴相同浓度的NaI溶液,观察生成沉淀的颜色
D 比较HClO和酸性强弱 用pH试纸测定NaClO溶液和溶液的pH
A.A B.B C.C D.D
6.下列装置或操作能达到目的的是
A.实验1制取无水固体 B.实验2验证氯化银溶解度大于硫化银
C.实验3比较、对反应速率的影响 D.实验4氯碱工业
7.利用微生物燃料电池(MFC)处理废水,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示。下列说法不正确的是
A.电子移动方向是从A电极流向B电极,溶液中的移动方向从左到右
B.B电极反应式为:
C.相同条件下,A极区生成的与B极区生成的的体积之比为5∶4
D.该电池在高温情况下无法正常工作
8.在恒容密闭容器中充入和发生反应:,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
第II卷(非选择题 52分)
9.(12分)滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
Ⅰ.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO+5H2O2+6H+=2Mn2++5O2↑+8H2O。
(1)滴定时,将高锰酸钾标准溶液注入___________(填“酸”或“碱”)式滴定管中。
(2)滴定到达终点的现象是___________。
Ⅱ.酸碱中和滴定:常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00 mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
(3)滴定盐酸的曲线是图___________(填“1”或“2”)。
(4)达到B、D状态时,反应消耗的NaOH溶液的体积a___________(填“>”“<”或“=”)b。
(5)D状态时,溶液中的溶质是___________。
10.(12分)A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表所示。
元素 相关信息
A 基态原子的价层电子排布为nsnnpn
B 基态原子中的未成对电子数是同周期元素原子中最多的
C 基态原子的最外层电子数是电子层数的3倍
D 简单离子是第三周期元素所形成的离子中半径最小的
E 基态原子的价电子层中的未成对电子数为4
请回答下列问题(用对应元素的元素符号作答)。
(1)写出D元素基态原子的价层电子排布式:_______;基态A原子电子占据最高能级的电子云轮廓图为_______形;基态E2+的价层电子排布图:_______。
(2)这5种元素中电负性最大的元素是_______ (用元素符号表示,下同),A、B、C三种元素的第一电离能由大到小的顺序为_______。
(3)B、C、D的简单离子的半径由大到小的顺序为_______(用离子符号表示)。
(4)写出含有C的强氧化性的氢化物的电子式:_______。
11.(12分)人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq)(尿酸根,aq)、②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,,,。
②37℃时,模拟关节滑液pH=7.4,。
(1)37℃时,HUr溶液的pH约为_______(已知)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
A.NaUr溶液显碱性 B.HUr溶液可使石蕊溶液变红
C.常温下,等浓度的尿酸溶液导电性比盐酸弱
D.10mL溶液与10mLNaOH溶液完全反应
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中_____(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______(填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
A.多喝水,食用新鲜蔬果 B.饮食宜多盐、多脂
C.适度运动,注意关节保暖 D.减少摄入易代谢出尿酸的食物
12.(16分)常作食品加工中的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)可作净水剂,其原理是_______(用离子方程式说明)。
(2)相同条件下,溶液中的_______(填“等于”“大于”或“小于”)溶液中的。
(3)几种均为的电解质溶液的pH随温度变化的曲线如图所示。
①其中符合溶液的pH随温度变化的曲线是_______(填罗马数字),导致溶液的pH随温度变化的原因是_______。
②20℃时,溶液中_______。(列计算式不必化简)
(4)室温时,向溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与加入NaOH溶液体积的关系曲线如图所示。
①试分析图中a、b、c、d四个点,水的电离程度最大的是_______点。
②在b点,溶液中各离子浓度由大到小的排列顺序是_______。
③由b到c发生反应的离子方程式为_______。
宜宾市部分中学2022-2023学年高二下学期开学考试
化学试题参考答案:
1.B 2.B 3.A 4.A 5.B 6.A 7.C 8.C
9.(1)酸 (2)滴入最后一滴高锰酸钾溶液,溶液呈紫色,且30秒内不褪色
(3)1 (4)> (5)CH3COOH和CH3COONa
10.(1) 哑铃 (2) O
(3) (4)
11.(1)3.7 (2)AC (3)>
(4),故有尿酸钠晶体析出
(5)吸热 (6)ACD
12.(1)
(2)小于
(3) I 水解使溶液呈酸性,升高温度使其水解程度增大,pH减小
(4) a
同课章节目录
