5.2.2 氨和铵盐(精讲课件)(25张ppt)-2022-2023学年高一化学同步学习高效学讲练(人教版2019必修第二册)
文档属性
| 名称 | 5.2.2 氨和铵盐(精讲课件)(25张ppt)-2022-2023学年高一化学同步学习高效学讲练(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-08 09:04:20 | ||
图片预览







文档简介
(共25张PPT)
2019人教版 必修第二册 第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
第2课时 氨和铵盐
本课件内嵌有高清视频供老师参考使用
视频:氨气的喷泉实验
氨气与氯化氢的反应
铵盐与强碱的反应
本页可自行删除
【考纲要求】
了解氨气的性质、用途和实验室制法;
了解铵盐的性质及用途;
掌握铵根离子的检验方法。
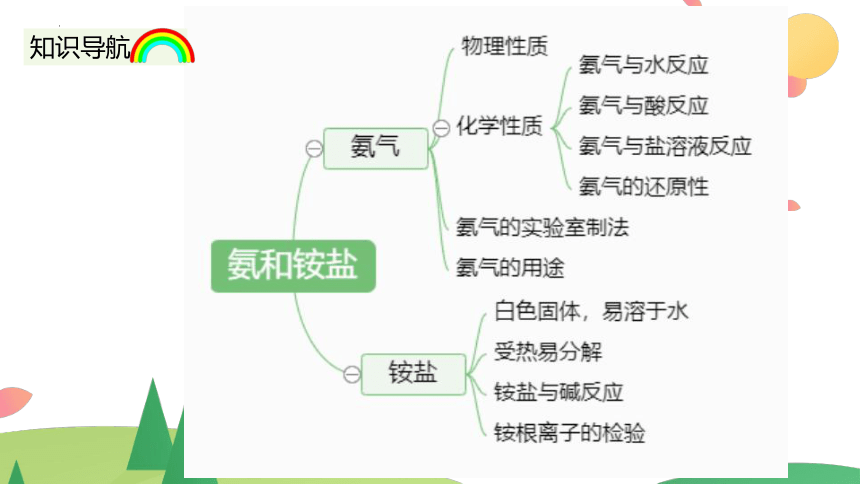
知识导航
合成氨和尿素,可以说是化学工业最伟大的发明,对人类的贡献无论如何夸大都不为过。
民以食为天,人类从诞生到1900年,几百万年时间,人口只有16亿。而1908年合成氨工业化,至现在100多年时间,人口增加到超过76亿,无疑合成氨是起了巨大的作用的。合成氨,诞生了化学肥料,使土地的粮食产量翻了几番,使地球才能养活这么多人口,而且不挨饿。这其中的意义是无法用语言来表达的。
氨还是重要的无机化工产品,在国民经济中占有重要地位。除了作肥料,也是生产硝酸、各种含氮无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等的重要原料。
合成氨与诺贝尔奖
课堂导入
1918年,德国化学家弗里茨·哈伯因为发明合成氨方法而获得诺贝尔化学奖。
1931年,卡尔·博施因改进合成氨方法获得诺贝尔化学奖。
2007年,诺贝尔化学奖授予了德国化学家格哈德·埃特尔(Gerhard Ertl),理由是他发现了哈伯-博施法合成氨的作用机理,并以此为开端推动了表面化学动力学的发展。这也是合成氨研究领域诞生的第三位诺贝尔奖得主。
一.氨的物理性质
1. 无色刺激性气味有毒气体,密度比空气小。
极易溶于水,常温下,1体积水大约可溶解700体积氨气。
氨的水溶液叫做氨水。
氨易液化(液态的氨称为液氨)。液氨汽化时要吸收的量的热,使周围温度急剧下降,因此,液氨常用作制冷剂。
液氨是纯净物,氨水是混合物
2.喷泉实验
(1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强
减小,形成压强差,大气压将烧杯中的水压入烧瓶而
形成喷泉。
(2)常见的能形成喷泉实验的气体和吸收剂如表:
气体 HCl NH3 CO2、SO2、Cl2、H2S NO2+O2
吸收剂 水或NaOH溶液 水或盐酸 浓NaOH溶液 水
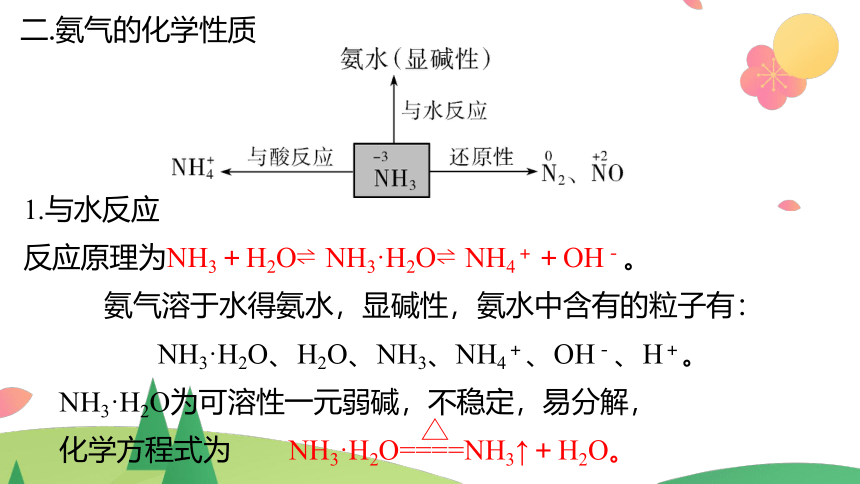
二.氨气的化学性质
1.与水反应
反应原理为NH3+H2O NH3·H2O NH4++OH-。
氨气溶于水得氨水,显碱性,氨水中含有的粒子有:
NH3·H2O、H2O、NH3、NH4+、OH-、H+。
NH3·H2O为可溶性一元弱碱,不稳定,易分解,
化学方程式为 NH3·H2O====NH3↑+H2O。
2.氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为
有白烟生成。
将浓盐酸改为浓硝酸,也会出现相同的现象。
化学方程式为 HCl+NH3===NH4Cl
NH3+HNO3===NH4NO3
氨水易挥发
3.与盐溶液的反应
过量氨水与AlCl3溶液反应的离子方程式:
Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(氢氧化铝不溶于氨水)
4.氨气的还原性
①催化氧化:
②被CuO氧化:
③被氯气氧化:
或
5.氨的用途
①液氨汽化时吸收大量的热,故用作制冷剂。
②制氮肥、硝酸、铵盐、纯碱等。
【注意】
①NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,在推断题中作为解题突破口。
②氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
三.氨的实验室制法
其它实验室制取NH3的简易方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大也有利于NH3的生成
浓氨水+固体CaO CaO与水反应生成OH-,使溶剂(水)减少;且反应放热,促使NH3·H2O分解。化学方程式: NH3·H2O+CaO==NH3↑+Ca(OH)2
四.铵盐的性质及NH4+的检验
1.铵盐的物理性质
铵盐都是白色固体,均易溶于水。
2.铵盐的化学性质
(1)受热易分解
(2)与碱溶液反应
3.NH4+的检验
未知液加入强碱共热,产生使湿润的红色石蕊试纸变蓝色的气体,则证明含NH4+
实验装置
铵盐溶液 NH4Cl溶液 NH4NO3溶液 (NH4)2SO4溶液
现象 试管中有气泡产生,试纸变蓝
结论 铵盐与强碱反应生成氨气, 离子方程式为
应用 ①检验铵根离子的存在;②制取氨气
效果检测
1.(2021·天津滨海新·高一期末)下列关于氨气、氨水和铵盐的叙述正确的是
A.NH3易液化,液氨常用作制冷剂
B.实验室常用向上排空气法收集氨气
C.氨水中只含有NH3和H2O两种分子
D.铵盐较稳定,不怕风吹雨打日晒,可露天贮存
【答案】A
2.(2021·江苏·常州横山桥高级中学高一期中)下列关于氨及铵盐的叙述中不正确的是
A.铵盐都是易溶于水的离子化合物
B.氨的喷泉实验体现了氨的溶解性和还原性
C.工业上可用氮气和氢气在一定条件下反应制氨气
D.铵盐发生分解时可能发生氧化还原反应
【答案】B
3.(2021·上海·华师大二附中高一阶段练习)如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹。下列与实验事实不相符的是
A.Cl2(饱和食盐水)无色喷泉
B.NH3(H2O含石蕊)蓝色喷泉
C.HCl(H2O含石蕊)红色喷泉
D.SO2(NaOH溶液)无色喷泉
【答案】A
4.在实验室制取干燥氨气的过程中,所给装置使用合理的是( )
A.用装置甲制备氨气 B.用装置乙除去氨气中的少量水蒸气
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
【答案】D
5.(2021·石嘴山市第三中学高一期末)下列说法正确的是
A.实验室可用NaOH溶液和NH4Cl溶液加热的方法制取氨气
B.实验室用NH4HCO3固体和Ca(OH)2固体混合加热制取氨气
C.可以用CaCl2干燥氨气
D.可以用加热并冷却的方法分离NaCl和NH4Cl的混合物
【答案】D
6.无色的混合气体甲,可能含NO、CO2、NO2、NH3、O2、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
A.NH3、NO、O2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
【答案】B
本课结束
2019人教版 必修第二册 第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
第2课时 氨和铵盐
本课件内嵌有高清视频供老师参考使用
视频:氨气的喷泉实验
氨气与氯化氢的反应
铵盐与强碱的反应
本页可自行删除
【考纲要求】
了解氨气的性质、用途和实验室制法;
了解铵盐的性质及用途;
掌握铵根离子的检验方法。
知识导航
合成氨和尿素,可以说是化学工业最伟大的发明,对人类的贡献无论如何夸大都不为过。
民以食为天,人类从诞生到1900年,几百万年时间,人口只有16亿。而1908年合成氨工业化,至现在100多年时间,人口增加到超过76亿,无疑合成氨是起了巨大的作用的。合成氨,诞生了化学肥料,使土地的粮食产量翻了几番,使地球才能养活这么多人口,而且不挨饿。这其中的意义是无法用语言来表达的。
氨还是重要的无机化工产品,在国民经济中占有重要地位。除了作肥料,也是生产硝酸、各种含氮无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等的重要原料。
合成氨与诺贝尔奖
课堂导入
1918年,德国化学家弗里茨·哈伯因为发明合成氨方法而获得诺贝尔化学奖。
1931年,卡尔·博施因改进合成氨方法获得诺贝尔化学奖。
2007年,诺贝尔化学奖授予了德国化学家格哈德·埃特尔(Gerhard Ertl),理由是他发现了哈伯-博施法合成氨的作用机理,并以此为开端推动了表面化学动力学的发展。这也是合成氨研究领域诞生的第三位诺贝尔奖得主。
一.氨的物理性质
1. 无色刺激性气味有毒气体,密度比空气小。
极易溶于水,常温下,1体积水大约可溶解700体积氨气。
氨的水溶液叫做氨水。
氨易液化(液态的氨称为液氨)。液氨汽化时要吸收的量的热,使周围温度急剧下降,因此,液氨常用作制冷剂。
液氨是纯净物,氨水是混合物
2.喷泉实验
(1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强
减小,形成压强差,大气压将烧杯中的水压入烧瓶而
形成喷泉。
(2)常见的能形成喷泉实验的气体和吸收剂如表:
气体 HCl NH3 CO2、SO2、Cl2、H2S NO2+O2
吸收剂 水或NaOH溶液 水或盐酸 浓NaOH溶液 水
二.氨气的化学性质
1.与水反应
反应原理为NH3+H2O NH3·H2O NH4++OH-。
氨气溶于水得氨水,显碱性,氨水中含有的粒子有:
NH3·H2O、H2O、NH3、NH4+、OH-、H+。
NH3·H2O为可溶性一元弱碱,不稳定,易分解,
化学方程式为 NH3·H2O====NH3↑+H2O。
2.氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为
有白烟生成。
将浓盐酸改为浓硝酸,也会出现相同的现象。
化学方程式为 HCl+NH3===NH4Cl
NH3+HNO3===NH4NO3
氨水易挥发
3.与盐溶液的反应
过量氨水与AlCl3溶液反应的离子方程式:
Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(氢氧化铝不溶于氨水)
4.氨气的还原性
①催化氧化:
②被CuO氧化:
③被氯气氧化:
或
5.氨的用途
①液氨汽化时吸收大量的热,故用作制冷剂。
②制氮肥、硝酸、铵盐、纯碱等。
【注意】
①NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,在推断题中作为解题突破口。
②氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
三.氨的实验室制法
其它实验室制取NH3的简易方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大也有利于NH3的生成
浓氨水+固体CaO CaO与水反应生成OH-,使溶剂(水)减少;且反应放热,促使NH3·H2O分解。化学方程式: NH3·H2O+CaO==NH3↑+Ca(OH)2
四.铵盐的性质及NH4+的检验
1.铵盐的物理性质
铵盐都是白色固体,均易溶于水。
2.铵盐的化学性质
(1)受热易分解
(2)与碱溶液反应
3.NH4+的检验
未知液加入强碱共热,产生使湿润的红色石蕊试纸变蓝色的气体,则证明含NH4+
实验装置
铵盐溶液 NH4Cl溶液 NH4NO3溶液 (NH4)2SO4溶液
现象 试管中有气泡产生,试纸变蓝
结论 铵盐与强碱反应生成氨气, 离子方程式为
应用 ①检验铵根离子的存在;②制取氨气
效果检测
1.(2021·天津滨海新·高一期末)下列关于氨气、氨水和铵盐的叙述正确的是
A.NH3易液化,液氨常用作制冷剂
B.实验室常用向上排空气法收集氨气
C.氨水中只含有NH3和H2O两种分子
D.铵盐较稳定,不怕风吹雨打日晒,可露天贮存
【答案】A
2.(2021·江苏·常州横山桥高级中学高一期中)下列关于氨及铵盐的叙述中不正确的是
A.铵盐都是易溶于水的离子化合物
B.氨的喷泉实验体现了氨的溶解性和还原性
C.工业上可用氮气和氢气在一定条件下反应制氨气
D.铵盐发生分解时可能发生氧化还原反应
【答案】B
3.(2021·上海·华师大二附中高一阶段练习)如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹。下列与实验事实不相符的是
A.Cl2(饱和食盐水)无色喷泉
B.NH3(H2O含石蕊)蓝色喷泉
C.HCl(H2O含石蕊)红色喷泉
D.SO2(NaOH溶液)无色喷泉
【答案】A
4.在实验室制取干燥氨气的过程中,所给装置使用合理的是( )
A.用装置甲制备氨气 B.用装置乙除去氨气中的少量水蒸气
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
【答案】D
5.(2021·石嘴山市第三中学高一期末)下列说法正确的是
A.实验室可用NaOH溶液和NH4Cl溶液加热的方法制取氨气
B.实验室用NH4HCO3固体和Ca(OH)2固体混合加热制取氨气
C.可以用CaCl2干燥氨气
D.可以用加热并冷却的方法分离NaCl和NH4Cl的混合物
【答案】D
6.无色的混合气体甲,可能含NO、CO2、NO2、NH3、O2、N2中的几种,将100mL甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
A.NH3、NO、O2 B.NH3、NO、CO2
C.NH3、NO2、CO2 D.NO、CO2、N2
【答案】B
本课结束
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
